人骨髓间充质干细胞的体外多向分化潜能
2010-06-19邓方阁李玉林
邓方阁,李玉林
骨髓间充质干细胞(mesenchymal stem cells,MSCs)具有自我更新能力及多向分化潜能,在不同的诱导条件下,可向多种组织细胞分化[1-5]。目前,利用MSCs多向分化潜能及其可自体利用且无免疫排斥等特性,作为种子细胞用于组织工程学和基因工程学研究已成为热点。本研究在体外分离人骨髓血,利用密度梯度离心及贴壁筛选法分离培养出人MSCs(human MSCs,hMSCs),分别利用3种不同的条件诱导培养基,诱导hMSCs向成骨细胞、脂肪细胞及心肌细胞分化,为细胞移植、组织再生修复可能的自体来源提供理论基础。
1 材料与方法
1.1 主要试剂 Percoll(Pharmacia,Biotec,USA),LDMEM,HDMEM和10%胎牛血清(均Hyclone,USA),100 U/ml青链霉素双抗 (华北制药厂),0.125%~0.250%胰酶(Promega,USA),鼠抗人单克隆抗体 CD31、CD34、CD44、CD45、CD105(Neomarker,USA),地塞米松、吲哚美辛、胰岛素、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxan- thine,IBMX)、抗坏血酸、β2甘油磷酸钠、阿扎胞苷(5-氮杂胞苷,5-azacitidine,5-Aza)、油红O(Sigma,USA)。
1.2 人骨髓间充质干细胞的分离培养及免疫表型检测 方法同文献[6]所述,在无菌状态下取自愿捐献者的肝素化的穿刺骨髓血3~5 ml,利用Percoll(比重为1.073 g·ml-1)密度梯度离心,抽取单个核细胞层,用含青链霉素双抗(100 U/ml)的10%胎牛血清的L-DMEM 重悬细胞,计数以(3~4)×106的细胞密度接种在6孔板中进行培养。接种后3 d首次换液,每隔3~4 d换液一次。当原代细胞接近汇流(>80%融合)时,0.25%胰酶消化传代培养,取生长状态良好的传代hMSCs用于后续研究。胰酶消化收集细胞,1×106个/mL细胞与一抗单克隆抗体 CD31 、CD34、CD44、CD45、CD105 孵育液常温下孵育30~40 min。PBS洗涤2次后与FITC标记的二抗4℃避光孵育20~30 min。PBS冲洗2次后加500 μ l PBS重悬细胞,用于流式细胞仪分析。
1.3 人骨髓间充质干细胞向成骨细胞、脂肪细胞的诱导分化 取生长状态良好的传代hMSCs,以2×105个/cm2密度接种于置有处理过的盖玻片的24孔板中,当细胞融合达到60%~70%时,更换为成骨诱导培养基(地塞米松1μ mol/L,β2甘油磷酸钠 10 mmol/L,抗坏血酸 50 μ mol/L)、成脂诱导培养基(地塞米松1 μ mol/L,吲哚美辛0.2 mmol/L,胰岛素10 mg/L,IBMX 0.5 mmol/L),每隔3 d更换培养液1次,继续诱导14 d后固定细胞,进行碱性磷酸酶染色检测或油红O染色检测。
1.4 人骨髓间充质干细胞向心肌细胞的诱导分化取生长状态良好的传代hMSCs以2×105个/cm2密度接种于置有处理过的盖玻片的24孔板中,当细胞融合达到 60%~70%时,更换成 1%FBS的HDMEM饥饿培养24 h,后换成心肌细胞诱导培养基(5-Aza,10 μ mol/L)孵育 24 h,再换成不含诱导剂的培养基继续培养14 d,细胞固定,进行PTAH染色。
2 结 果
2.1 人骨髓间充质干细胞的形态学特征及免疫表型 接种的骨髓单个核细胞,3 d后逐渐贴壁生长,经2~3次完全换液后,贴壁生长的细胞形态均一,呈长梭形。培养至10~18 d,细胞出现80%~90%的融合。传代后的hMSCs形态上更加趋于一致,均为紧密排列的成纤维细胞样细胞(图1)。流式细胞检测表明,hMSCs表达CD44、CD105,不表达血管内皮细胞标志CD31、造血干细胞标志CD34和白细胞表面抗原CD45。表型检测参见前期实验论文[5]。
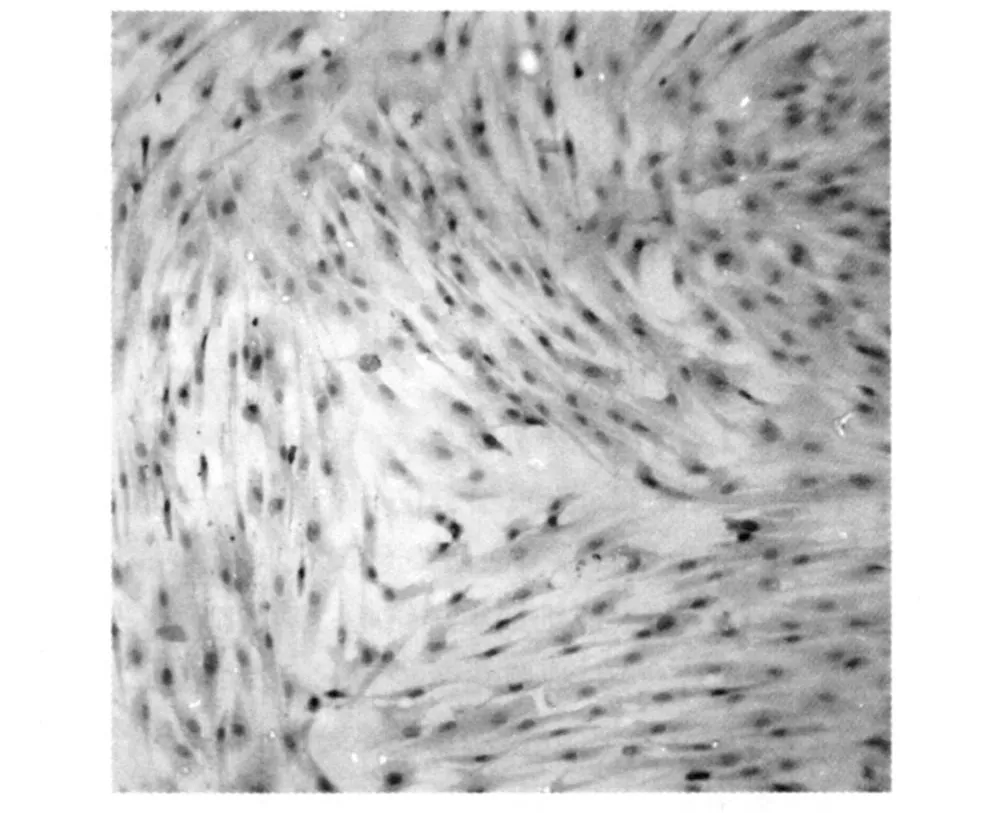
图1 传代后的hMSCs(HE ×200)
2.2 多向分化潜能的鉴定
2.2.1 成骨诱导 细胞在成骨诱导体系中培养4~5 d,细胞形态发生明显改变,细胞由原来的成纤维细胞样变为多角形,诱导1周,80%以上的细胞为不规则形,诱导2周,细胞间相互融合,并形成散在的细胞结节。碱性磷酸酶染色显示,聚集成的结节区呈棕黑色,表明此结节为钙盐沉积(图2)。
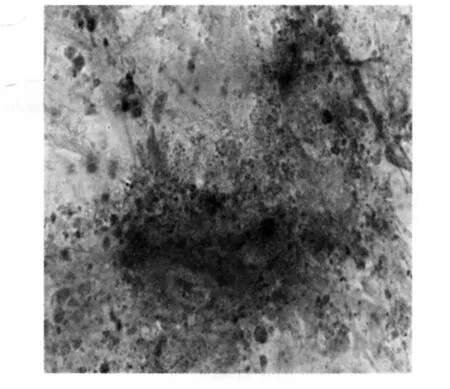
图2 hMSCs分化为成骨细胞(碱性磷酸酶染色 ×250)
2.2.2 成脂肪诱导 hMSCs在成脂肪诱导体系中培养3d,细胞内出现微小脂滴,细胞形态也逐渐由成纤维样细胞变为胞体增宽的短梭形、圆形或多角形,培养2周时,细胞内的脂滴增大,并相互融合。油红O染色显示,细胞内脂质沉积,脂滴被特染成红色,与油红O染色阳性对照的人脂肪细胞相似,表明成脂分化的hMSCs在细胞化学特性上已具有与人脂肪细胞相似的细胞化学特性(图3)。

图3 hMSCs分化为脂肪细胞(油红O染色 ×200)
2.2.3 成心肌诱导 细胞经5-Aza诱导1周,细胞变化并不明显,部分细胞变长或变宽大;诱导2周,细胞逐渐由长梭型变成多爪型或星型。PTAH染色显示,经5-Aza诱导后的细胞,胞浆呈蓝色。通过与SD乳鼠心肌细胞 PTAH染色相比较,提示成心肌细胞分化的hMSCs在细胞化学特性上具有与 SD乳鼠心肌细胞相似的细胞化学特性(图 4)。
3 讨 论
组织器官移植可能是人类攻克某些重大疾患如心脑血管疾病、癌症、老年性疾病等的根本措施。正因为这些取自人胚胎或骨髓的具有自我更新、高度增殖和多向分化潜能的细胞群体的干细胞,可用于培育不同的人体细胞、组织或器官,有望成为移植器官的新来源。但是,由于胚胎干细胞在伦理道德等方面的制约而备受争议,因此骨髓来源的干细胞越来越受到广泛关注。

图4 成心肌诱导后的hMSCs分化为心肌细胞(PTAH染色 ×200)
目前,普遍认为,在骨髓中至少存在两种干细胞群,即造血干细胞和MSCs。MSCs是中胚层发育的早期细胞,可通过体外贴壁培养加以分离,不仅能分化为造血实质和基质细胞等,还分化为多种造血以外的组织,特别是中胚层和神经外胚层来源组织的细胞[1-5]。随着干细胞工程及其相关生物技术研究发展,以及对干细胞本身特有的特性认识,使得研究者在体外培养动物MSCs,体外定向诱导分化为所需的不同细胞,同时体内动物实验也已成功证实MSCs的修复作用,如在鼠的慢性肢体缺血模型中,MSCs参与血管形成,表达内皮细胞及平滑肌细胞标志[7];将MSCs移植入鼠的心肌梗死区,可分化成心肌细胞,充填梗死病灶,并与心肌细胞形成缝隙连接,诱导血管新生,从而形成了有功能的心肌组织[8-9];将体外扩增的MSCs装入扩散小室(多孔陶瓷或陶瓷柱)后再移植入动物体内,扩散小室内的MSCs能够利用宿主动物体内的营养合成骨和软骨[10];将建系的鼠胚胎干细胞[11]或少量部分分化的胚胎干细胞形成的胚体细胞[12]植入帕金森病小鼠,可分化为多巴胺神经元。从理论上来说,由于使用的是来自患者自身组织培养扩增的治疗用细胞,因此移植时患者体内不会产生免疫排斥反应。此外,干细胞可无限高度增殖,在数量上以保证治疗的需要,从而解决了可供移植细胞、组织或器官严重不足的问题。随着整体社会的老年化,每年都有数以百计的患者需要进行修复或移植,干细胞工程及其相关生物技术研究将可能解决这些问题,为人类的健康与长寿带来新的希望。
迄今为止,尚未发现MSCs的特异性表面标志[2-3],因而缺乏直接的鉴定方法。目前判断体外培养的MSCs主要采用联合鉴定方法[1-4]:(1)体外分离培养的细胞形态为均一的梭形、纺锤状或成纤维细胞样的细胞;(2)SH2(CD105)、CD44等呈阳性表达,而CD31、CD34、CD45等呈阴性表达;(3)在不同诱导条件下可向多系定向分化。多向分化潜能和自我更新是干细胞的基本特点。因此,在本研究中,利用密度梯度离心及贴壁筛选法分离人骨髓血,培养出形态为成纤维样、梭形的细胞;经免疫细胞化学检测,表达CD44和CD105,不表达造血干细胞标志CD34和白细胞表面抗原CD45。经不同的诱导条件培养基诱导,可分别分化成成骨细胞、脂肪细胞和心肌细胞。上述的实验结果完全符合目前所定义的体外培养的MSCs主要采用联合鉴定方法,从而证实人骨髓中的MSCs易于体外分离培养,且具有多向分化潜能,在不同的诱导体系下能分化成不同类型的组织细胞,可为骨组织工程学、心肌组织再生医学中损伤组织的修复与治疗提供自体来源细胞。
[1]Morito T,Muneta1 T,Hara K,et al.Synovial fluid derived mesenchymal stem cells increase after intraarticular ligament injury in humans[J].Rheumatology (Oxford),2008,47(8):1137-1143.
[2]Krause DS.Bone marrow-derived cells and stem cells in lung repair[J].Proc Am Thorac Soc,2008,5(3):323-327.
[3]Summer R,Fine A.Mesenchymal progenitor cell research:limitations and recommendations[J].Proc Am Thorac Soc,2008,5(6):707-710.
[4]Jones E,McGonagle D.Human bone marrow mesenchymal stem cells in vivo[J].Rheumatology(Oxford),2008,47(2):126-131.
[5]Tan SC,Pan WX,Ma G,etal.Viscoelastic behaviour of human mesenchymal stem cells[J].BMC Cell Biol,2008,9(1):40-47.
[6]邓方阁,张秀英,曲丽梅,等.人骨髓间充质干细胞体外培养扩增及向心肌细胞诱导分化的实验研究[J].中国免疫学杂志,2007,23(2):123-126.
[7]Bittira B,Shum-Tim D,Al-Khaldi A,etal.Mobilization and homing of bone marrow stromal cells in myocardial infarction[J].Eur J Cardiothorac Surg,2003,24(3):393-398.
[8]Lum LG,Padbury JF,Davol PA,et al.Virtual reality of stem cell transplantation to repair injured myocardium[J].J Cell Biochem,2005,95(5):869-874.
[9]Yoon YS,Wecker A,Heyd L,et al.Clonally ex
panded novel multipotent stem cells from human bone marrow regenerate myocardium after myocardial infarction[J].J Clin Invest,2005,115(2):326-338.
[10]Bruder SP,Kraus KH,Goldberg VM,et al.The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects[J].J Bone Joint Surg Am,1998,80(7):985-996.
[11]Kim JH,Auerbach JM,Rodriguez-Gomez JA,et al.Dopamine neurons derived from embryonic stem cells function in an animal model of Parkinson's disease[J].Nature,2002,418(6893):50-56.
[12]Bjorklund LM,Sanchez PR,Chung S,et al.Embryonic stem cells develop into funtional dopaminergic neurons after transplantation in a Parkinson rat model[J].Proc Natl Acad Sci USA,2002,99(4):2344-2349.
