种植骨髓干细胞的多孔人工骨在猴脊柱后外侧融合术中的应用
2010-06-15王居勇沈惠良折井久彌张庆明四宮謙一
王居勇,沈惠良,折井久彌,张庆明,四宮謙一
为了增强脊柱手术后的稳定性,临床通常采用自体骨植入脊柱横突间,达到脊柱融合。自体髂骨骨块通常被认为是最好的材料,和其他移植材料相比,自体骨仍作为金标准。然而在很多病例,取骨部位的手术通常会出现一些问题,如增加失血、延长手术时间、神经损伤以及取骨部位感染等[1-2]。另外,也有一些研究报道,应用自体骨有30%患者发生非融合和假关节形成[3-4];对于多节段脊柱融合手术,自体骨资源可能不充分。
近年来,利用骨诱导生长因子来诱导骨形成的研究也很多,尤其是骨形态蛋白(BMP)。一些研究者应用工程材料和rhBMP-2成功得到组织工程骨[5-7],目前多数研究都是针对破骨细胞的骨吸收和骨形成这一方面[8-9]。然而,大剂量BMP移植入体内可能引起意想不到的副作用,这些副作用甚至可能发生在远离BMP使用的部位,所以,很多国家还没有承认BMP的临床应用价值。
最近,很多研究证实种植了骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的多孔人工骨能够诱导骨形成[10-12]。BMSCs具有多潜能特性,容易提取并且容易培养增殖。Yoshikawa使用Maniatopoulos方法提高了细胞的培养效率[11,13]。一些学者应用低压和灌注方法提高了组织工程骨的合成效率[14-16]。传统方法是将细胞种植入多孔材料后再培养2周,而我们是利用低压方法将细胞种植入多孔生物材料后,缩短组织工程骨的培养时间。由于生物材料多孔β-磷酸三钙(β-TCP)植入体内后,具有能够逐渐被吸收,逐渐被人体自身骨生长替换的特点[17-18],所以,我们采用β-TCP和BMSCs结合合成组织工程骨。本研究将这种方法合成的组织工程骨用于灵长类动物脊柱后外侧融合手术,评估组织工程骨能否增强脊柱融合强度,能否作为手术中自体骨的替换物。
1 材料和方法
1.1 多孔生物材料 β-TCP,日本 Olympus公司提供。该材料多孔率为75%,孔径200~400 μ m,孔与孔之间的连接通道直径 100~200 μ m[10]。
1.2 BMSCs的分离和培养 BMSCs采自于3~4岁雄性食蟹猴,体重3.3~4.9 kg。全身麻醉下,使用20 ml注射器和16号骨髓穿刺针,于食蟹猴股骨大转子处抽取骨髓,DMEM(Dubberco's Minimal Essential Medium)悬浮,1000 r/min离心5 min,标准培养液混匀。标准培养液构成:DMEM、1%抗生素/抗真菌药(10000 U/ml青霉素 、10000 μ g/ml链霉素 、25 μ g/ml两性霉素 B溶入 0.85%盐水,GIBCO,USA)、10%FBS(Fetal bovine serum,GIBCOBRL,Lot No.3295241S)。将细胞培养于37℃培养温箱内,3 h后更换培养液,移除漂浮细胞,附着于培养皿的细胞主要是BMSCs[19]。以后培养液每3 d更换1次,大约2周,细胞在培养皿内增殖满意后,用0.25%trypsin-EDTA从培养皿内分离获取细胞,然后进行分盘二次培养,大约7 d后培养细胞长满培养皿。
1.3 组织工程骨的准备 细胞扩增完成后,将扩增培养液改为骨细胞分化培养液,骨细胞分化培养液由下列成分构成:标准培养液内加入100 nmol/L地塞米松(Sigma-Aldrich Co.,St.Louis,MO,USA)、10 mmol/L β-甘 油 磷 酸(Sigma-Aldrich Co.)和 0.25 mmol/L维生素C(Wako)[19]。分化培养4 d,分离细胞在4℃,1000 r/min离心5 min,计数,获取2×106/ml细胞悬浊液。将β-TCP浸入细胞悬浊液内,然后放入低压系统,100 mmHg(1 mmHg=0.133 kPa)下处理1 min,37℃温箱内培养3 h[16,20-21]。部分β-TCP/BMSCs工程骨用于电子扫描显微镜观察(Hitachi S-4500,Japan),证实多孔β-TCP内附着大量 BMSCs(图1)。细胞附着3 h后,β-TCP/BMSCs工程骨被移植到食蟹猴体内。
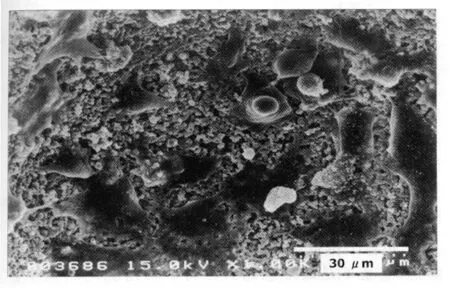
图 1 β-TCP/BMSCs复合物(Bar=30 μ m)
1.4 手术过程 6只食蟹猴,在L4-5节段后外侧横突间植入移植材料行脊柱融合手术[22]。手术在全麻下进行。麻醉成功后,食蟹猴俯卧位,手术区碘酒酒精消毒,通过术前X线确定L4-5位置。取后正中切口,沿棘突切开竖脊肌,显露椎板和横突,棘上韧带和椎小关节保持完整。术者用球磨钻将横突上方皮质去除,将移植材料放置于L4-5去皮质化横突间,缝合筋脉和皮肤。术后肌注头孢替坦2 d预防感染。食蟹猴在笼内不限制活动和饮食。
1.4.1 移植材料 本研究使用的移植材料有3组(n=4侧):①β-TCP/BMSCs工程骨:将 BMSCs种植入30×10×5 mm β-TCP 材料;②自体骨:约同样大小骨块取自于髂后上嵴;③单纯β-TCP材料:同样30×10×5 mm大小。
1.4.2 手术分组情况 2只食蟹猴体内一侧移植β-TCP/BMSCs工程骨,另一侧移植自体骨;另外2只食蟹猴一侧为自体骨,另一侧为单纯β-TCP材料;最后2只猴子为β-TCP/BMSCs工程骨和单纯β-TCP材料。
1.5 评估 术后12周通过静脉注射戊巴比妥处死猴子。手术取出L3~S1脊柱标本,清除周围软组织。采用融合节段手法触压、微CT、外周定量CT(Peripheral Quantitative Computed Tomography,pQCT)和组织学方法观察脊柱融合情况。
1.5.1 手法触压 手法触压测试观察椎体左右两个矢状面。术者双手把持融合节段的远近端掰压标本,移植材料区域没有活动即为融合,有活动即为非融合。
1.5.2 微CT 标本收获后用于微CT扫描(SMX-130CT-SV,Shimadzu,Japan)。扫描参数:34 μ A,46 kV,扫描厚度0.16 mm。评估随机区域骨形成的存在和融合骨量。
1.5.3 pQCT 所有L4-5横突节段标本都采用pQCT扫描,扫描参数:0.12×0.12×0.77 mm voxel。每个标本取用3个扫描切片,计算新形成骨的骨矿物质密度(BMD)并得出其平均值。同时测量体外未植入的β-TCP的BMD,用于与移植术后 12周的β-TCP/BMSCs工程骨和单纯β-TCP的比较。
1.5.4 组织学分析 标本用10%福尔马林液固定,酒精脱水,脱钙(Decalcifying Solution A,Wako,Osaka,Japan),石蜡包埋,HE染色,显微镜观察(Olympus,AX-70,Japan)。
2 结果
动物的手术过程均顺利,术后动物喂养,动物的活动均无异常。
2.1 手法触压 在β-TCP/BMSCs工程骨组和自体骨组,4例标本均有3例达到融合,未融合的工程骨和自体骨标本来源于同一只猴腰椎两侧;而单纯β-TCP组无一例融合。β-TCP/BMSCs工程骨组和自体骨组相比较,融合效果没有明显不同。
2.2 微CT 在β-TCP/BMSCs工程骨组,术后12周显示腰椎横突部位大量的新骨形成,明显多于自体骨组的骨形成量;自体骨组仅表现为原植入骨的同质融合(图2)。

图2 移植术后12周的微CT图像(Bar=6.250 mm)
2.3 pQCT β-TCP/BMSCs工程骨组骨形成的BMD平均值明显高于手术前的β-TCP。单纯β-TCP组术后BMD平均值比术前β-TCP的BMD降低(图3),可能由于β-TCP被吸收。
2.4 组织学观察 横断面切片组织学染色显示所有β-TCP/BMSCs工程骨内存在骨生长,并与腰椎横突生长融合(封三彩图2.1)。矢状面切片显示β-TCP/BMSCs工程骨完全出现新生骨,没有纤维组织形成(封三彩图2.2);在单纯β-TCP组,材料碎裂且没有形成融合,取出的部分β-TCP材料组织图像内没有骨性形成(封三彩图2.3)。材料移植部位未见任何炎症细胞存在。
3 讨论
在食蟹猴脊柱后外侧融合手术,我们尝试应用了多孔人工骨β-TCP材料,在种植有BMSCs的多孔β-TCP组织工程骨内能够观察到大量的新生骨,而单纯β-TCP材料内却观察不到骨形成。这些结果显示对于多孔人工骨β-TCP的应用,BMSCs是重要的。TCP材料在体内的降解可以为骨形成提供Ca和P[18,23-24]。在移植手术前,由BMSCs分化得到成骨样细胞,通过细胞在多孔材料内的种植,大量成骨细胞附着于β-TCP内,这为移植术后多孔材料内广泛均匀成骨提供了基本保证。本研究使用的β-TCP内具有和松质骨类似的较大孔隙和连接通道,这也有益于多孔材料内细胞的种植和术后组织血管的长入。多孔材料内血运的建立,可以为人工骨内骨形成提供一个较好的营养环境。β-TCP/BMSCs工程骨能够在多孔材料内诱导早期骨形成,新形成的骨覆盖在 TCP材料内孔的表面,并且限制TCP材料和组织液的接触,这将导致β-TCP材料吸收的减慢[25]。
一些研究者在他们的研究里进一步改进骨细胞的
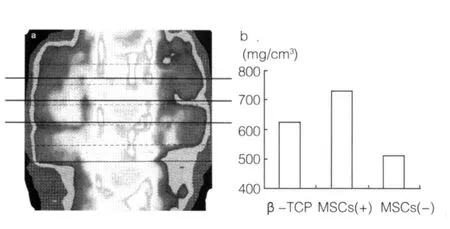
a:pQCT图像;b:骨密度均值。
图3 移植术后12周的pQCT结果培养技术[11,26-27]。然而,对于较大尺寸的人工骨材料,不是很容易将细胞种植入材料的中心部位;人工骨移植入体内以后,多孔材料内的BMSCs还需要与周围组织液和血液进行物质交换;然而,体外培养过程中,多孔材料内的BMSCs并不能得到足够的氧和其他营养物质的支持。为了避开这一问题,我们把细胞种植进入多孔材料后,很快就将β-TCP/BMSCs工程骨移植入动物体内。
在脊柱后外侧融合手术,在脊柱两侧应该植入相同移植物材料来融合固定脊柱。然而在本研究中,我们在脊柱同一节段两侧植入了不同的移植材料,目的在于相同条件下比较不同移植材料的融合固定效果。这种研究方法证明,脊柱融合手术中,β-TCP/BMSCs工程骨能够替换自体骨。
本研究显示在移植手术12周后,β-TCP/BMSCs工程骨内存在很好的骨形成。对于本研究的较好成骨结果,去皮质化横突与β-TCP/BMSCs工程骨的直接接触可能是导致β-TCP内骨生长的一个原因;分化后BMSCs的骨生成作用更为重要;另外,移植人工骨处存在的生物力学因素可能是保持骨代谢的又一个因素[28]。
在工程组织骨应用在临床之前,需要解决以下几个问题:①培养细胞使用的胎牛血清(FBS)不符合医学伦理,应该用自体血清替换目前的FBS;②即使β-TCP是一个很好的材料,由于其不够强硬的生物力学特点,它也不是最理想的人工骨。移植脆弱的人工骨将会导致假关节形成,然而,本研究所采用的β-TCP/BMSCs工程骨多数标本全部形成新骨。在移植有多孔人工骨的手术后,必须采取必要的术后指导以防止移植物断裂和假关节形成等危险发生。然而,这个应用组织工程骨的脊柱融合手术,并未采用钉棒系统固定脊柱。如果将工程组织骨和钉棒系统共同用于手术,应该可以得到确实的脊柱融合固定。
本研究成功地建立组织工程骨脊柱融合手术动物模型。我们推断在临床脊柱融合手术中,可以用多孔组织工程骨来建立确实的脊柱融合固定,多孔组织工程骨可以用于替换自体骨。
致谢:感谢Olympus公司无偿提供β-TCP人工骨。
[1]Fernyhough J,Schimandle J,Weigel M,et al.Chronic donor site pain complicating bone graft harvesting from the posterior iliac crest for spinal fusion[J].Spine,1992,17(12):1474-1480.
[2]Singh J,Nwosu U,Egol K.Long-term functional outcome and donor-site mo rbidity associated with autogenous iliac crest bone grafts utilizing a modified anterior approach[J].Bull NYU Hosp Jt Dis,2009,67(4):347-351.
[3]DePalma A,Rothman R.The nature of pseudarthrosis[J].Clin O rthop Relat Res,1968,59:113-118.
[4]Steinmann J,Herkowitz H.Pseudarthrosis of the spine[J].Clin Orthop Relat Res,1992,284:80-90.
[5]Boden S,Kang J,Sandhu H,et al.Use of recombinant human bone morphogenetic protein-2 to achieve posterolateral lumbar spine fusion in humans:a prospective,randomized clinical pilot trial:2002 Volvo Award in clinical studies[J].Spine,2002,27(23):2662-2673.
[6]Schimandle J,Boden S,Hutton W.Experimental spinal fusion with recombinant human bone morphogenetic protein-2[J].Spine,1995,20(12):1326-1337.
[7]Jiang X,Sun X,Lai H,et al.M axillary sinus floor elevation using a tissue-engineered bone complex with beta-TCP and BMP-2 genemodified bM SCs in rabbits[J].Clin Oral Implants Res,2009,20(12):1333-1340.
[8]Kanatani M,Sugimoto T,Kaji H,et al.Stimulatory effect of bone morphogenetic protein-2 on osteoclast-like cell fo rmation and bonereso rbing activity[J].J Bone Miner Res,1995,10(11):1681-1690.
[9]Boden S,Martin G,Morone M,et al.Posterolateral lumbar intertransverse process spine arthrodesis with recombinant human bone morphogenetic protein-2/hydroxy apatite-tricalcium phosphate after laminectomy in the nonhuman primate[J].Spine,1999,24(12):1179-1185.
[10]Dong J,Uemura T,Shirasaki Y,et al.P romotion of bone formation using highly pure porous beta-TCP combined with bone marrow-derived osteoprogenitor cells[J].Biomaterials,2002,23(23):4493-4502.
[11]Yoshikawa T,Ohgushi H,Uemura T,et al.Human marrow cells-derived cultured bone in porous ceramics[J].Biomed M ater Eng,1998,8:311-320.
[12]Kotobuki N,Katsube Y,Katou Y,et al.In vivo survival and osteogenic differentiation of allogeneic rat bone marrow mesenchymal stem cells(MSCs)[J].Cell Transplant,2008,17(6):705-712.
[13]M aniatopoulos C,Sodek J,Melcher A.Bone formation in vitro by stromal cells obtained from bone marrow of young adult rats[J].Cell Tissue Res,1988,254(2):317-330.
[14]Uemura T,Dong J,Wang Y,et al.Transplantation of cultured bone cells using combinations of scaffolds and culture techniques[J].Biomaterials,2003,24(13):2277-2286.
[15]Dong J,Uemura T,Kikuchi M,et al.Long-term durability of porous hydroxyapatite with low-pressure system to support osteogenesis of mesenchy mal stem cells[J].Biomed M ater Eng,2002,12(2):203-209.
[16]王居勇,张怀华,沈慧良.低压细胞灌注法提高多孔人工骨成骨能力的体外研究[J].中国组织工程研究与临床康复,2007,11(31):6130-6134.
[17]Kurashina K,Kurita H,Wu Q,et al.Ectopic osteogenesis with biphasic ceramics of hydroxyapatite and tricalcium phosphate in rabbits[J].Biomaterials,2002,23(2):407-412.
[18]Damron T.Use of 3D beta-tricalcium phosphate(Vitoss)scaffolds in repairing bone defects[J].Nanomedicine,2007,2(6):763-775.
[19]Jaiswal N,Haynesworth S,Caplan A,et al.Osteogenic differentiation of purified,culture-expanded human mesenchymal stem cells in vitro[J].J Cell Biochem,1997,64(2):295-312.
[20]Dong J,Uemura T,Kojima H.Application of low pressure system to sustain in vivo bone formation in osteoblast/porous hydroxyapatite composite[J].Mater Sci Eng C,2001,17:37-43.
[21]王居勇,沈惠良,麻生义则.低压细胞灌注多孔人工骨的成骨能力:与常压灌注的比较[J].中国组织工程研究与临床康复,2008,12(49):9601-9605.
[22]Akamaru T,Suh D,Boden S,et al.Simple carrier matrix modifications can enhance delivery of recombinant human bone morphogenetic protein-2 for posterolateral spine fusion[J].Spine,2003,1(28):429-434.
[23]Wang J,Chen W,Li Y,et al.Biological evaluation of biphasic calcium phosphate ceramic vertebral laminae[J].Biomaterials,1998,19(15):1387-1392.
[24]Guha A,Sing h S,Kumaresan R,et al.Mesenchymal cell response to nanosized biphasic calcium phosphate composites[J].Colloids Surf B Biointerfaces,2009,73(1):146-151.
[25]Kurashina K,Kurita H,Kotani A,et al.In vivo study of a calcium phosphate cement consisting of alpha-tricalcium phosphate/dicalcium phosphate dibasic/tetracalcium phosphate monoxide[J].Biomaterials,1997,18(2):147-151.
[26]Ohgushi H,Dohi Y,Katuda T,et al.In vitro bone formation by rat marrow cell culture[J].J Biomed Mater Res,1996,32(3):333-340.
[27]Tokumoto S,Sotome S,Torigoe I,et al.Effects of cry opreservation on bone marrow derived mesenchymal cells of a nonhuman primate[J].J Med Dent Sci,2008,55(1):137-143.
[28]Yuan H,Yang Z,Bruij JD,et al.Material-dependent bone induction by calcium phosphate ceramics:a 2.5-y ear study in dog[J].Biomaterials,2001,22(19):2617-2623.
