不同类型杀线剂对甘薯茎线虫趋化性的影响
2010-06-12张声扬
何 琪, 邢 骥, 张声扬, 丁 中*
(1.湖南农业大学生物安全科学技术学院,长沙 410128; 2.湖南农业大学东方科技学院,长沙 410128)
甘薯茎线虫(Ditylenchusdestructor)又称马铃薯腐烂茎线虫,属迁移性内寄生线虫,在我国主要危害甘薯块根使其腐烂,引起甘薯茎线虫病[1]。目前化学防治仍然是综合防治线虫病害中重要的手段之一,用于防治该线虫的化学药剂主要是非熏蒸类如有机磷类、氨基甲酸酯类、大环内酯类等几类化合物,由于其施用方法主要是土壤处理,使得一部分杀线虫剂残留在土壤环境中。
土壤中的线虫对环境变化有很高的敏感性[2],具有对环境的各种变化,包括污染胁迫效应做出较迅速的反应等特点[3]。残留于土壤的低剂量杀线虫剂将对线虫的扩散、繁殖、趋化性等行为产生影响。目前,在低剂量杀线虫剂胁迫下甘薯茎线虫的趋化性将会受到怎样的影响鲜有报道。本研究在低剂量涕灭威、甲氨基阿维菌素苯甲酸盐和丙溴磷胁迫条件下对甘薯茎线虫的趋化性进行了测定,以期为线虫的化学防治和综合治理提供依据。
1 材料与方法
1.1 试验材料
1.1.1 药剂
98.6%涕灭威(aldicarb)原药,华阳农药化工集团有限公司提供;70.3%甲氨基阿维菌素苯甲酸盐(emamectin benzoate)原药,95%丙溴磷(profenofos)原药,均由湖南大方农化有限公司提供。
1.1.2 供试线虫
甘薯茎线虫:采自河北省昌黎市,在PDA培养基上采用半裸镰刀菌(Fusariumsemitectum)培养40d左右收集备用[4-5]。
1.2 试验方法
1.2.1 原药的配制
将涕灭威、甲氨基阿维菌素苯甲酸盐、丙溴磷原药分别用溶剂丙酮和乳化剂吐温80配制1%的乳油,再将药剂用水稀释成需要的浓度以备试验。
1.2.2 测定方法
1.2.2.1 甘薯茎线虫在含不同浓度药剂水琼脂中的趋化性测定
用去离子水配制水琼脂,加热溶化,加入各药液配制成含5、5×10-1、5×10-2、5×10-3μg/mL 4个浓度的1%水琼脂,待水琼脂凝固前将25mL水琼脂倒入9.5cm培养皿。待其凝固后在中心打直径1cm小孔(线虫母液滴加处),并在水琼脂平板上靠近培养皿内缘部分每隔90°分别放置直径1.5cm的灰霉菌(Botrytiscinerea)、甘薯切块、半裸镰刀菌菌饼和马铃薯切块,并在每个引诱物之间放置同样大小的1%水琼脂块(如图1),并设不加药剂的空白对照,每个药剂5个处理,每处理重复3次。
测定前在中心打孔处加入0.2mL线虫悬浮液(含线虫800~1 200头左右),用保鲜膜将培养皿封口放入25℃黑暗恒温培养箱内培养36h,挖出每个菌饼和切块及其覆盖下的水琼脂块,用改良的贝尔曼漏斗法分离线虫并进行计数,计算线虫与引诱物的亲和率。
亲和率=引诱出的线虫头数/投入线虫总头数×100%
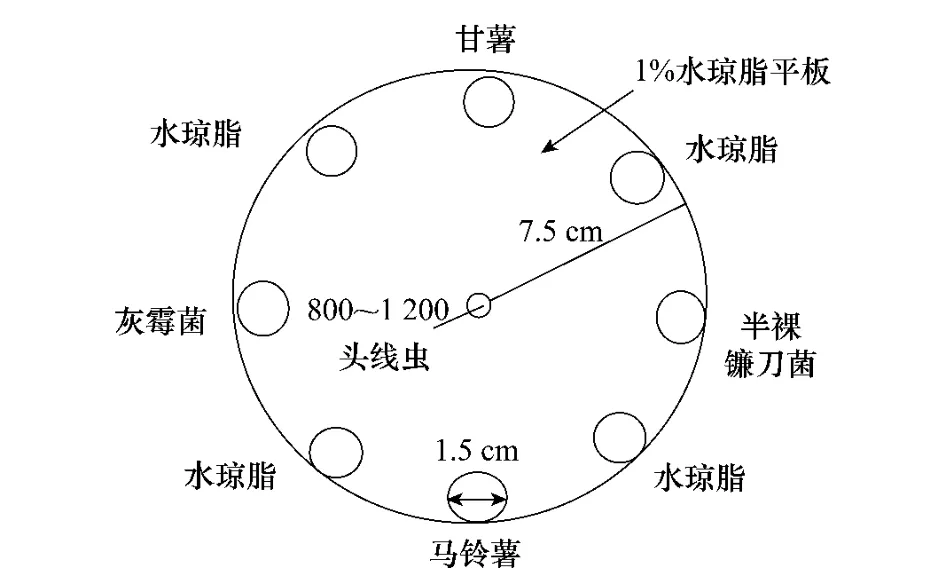
图1 甘薯茎线虫趋化性测定方法
1.2.2.2 甘薯茎线虫经不同浓度药剂处理后在水琼脂中的趋化性测定
将分离得到的甘薯茎线虫浸渍在上述3种药液中,其浓度分别为10-1、10-2、10-3、10-4μg/mL,24h后用灭菌去离子水清洗并恢复24h,然后滴入1%不含药剂的水琼脂平板中央,趋化性测定方法同上。
2 结果与分析
2.1 甘薯茎线虫在含不同浓度药剂水琼脂中的趋化性
2.1.1 甘薯茎线虫在含不同浓度涕灭威水琼脂中的趋化性
将甘薯茎线虫加入含不同浓度涕灭威的1%水琼脂平板中央,36h后观察记录线虫对不同目标物的趋化性(见表1)。结果表明,在无药剂水琼脂平板上甘薯茎线虫对灰霉菌和半裸镰刀菌表现出明显的趋性。在含涕灭威5μg/mL的水琼脂平板上,由于受到涕灭威的抑制作用,甘薯茎线虫对引诱物的趋性降低,但随着涕灭威浓度的降低,其趋性逐渐恢复提高,当水琼脂培养基上的涕灭威含量为5×10-3μg/mL时,线虫趋性已恢复到原来的水平。此外,从表1还可以看出,无论涕灭威浓度的高低,其对灰霉菌或半裸镰刀菌均保持明显的趋性。
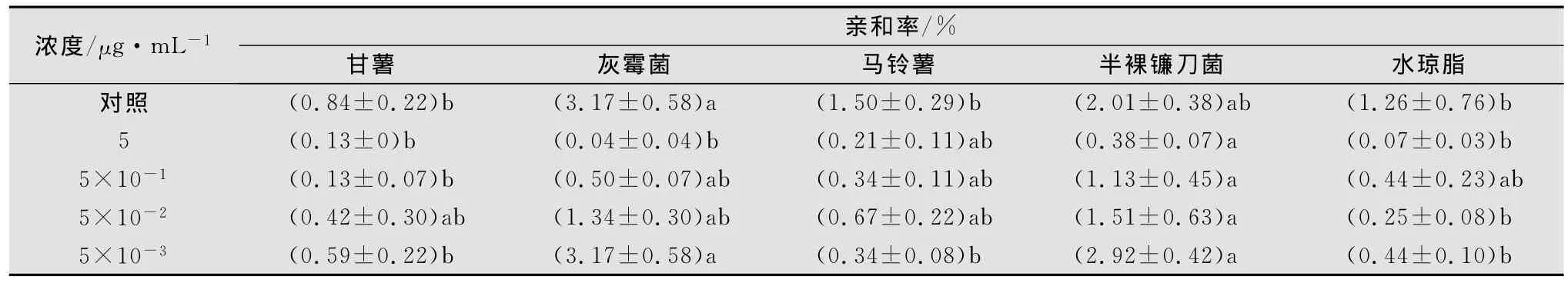
表1 甘薯茎线虫在含不同浓度涕灭威水琼脂中的趋化性1)
2.1.2 甘薯茎线虫在含不同浓度甲氨基阿维菌素苯甲酸盐水琼脂中的趋化性
与涕灭威相比较,甲氨基阿维菌素苯甲酸盐对甘薯茎线虫的趋化性影响较大(见表2)。在含甲氨基阿维菌素苯甲酸盐5、5×10-1μg/mL的水琼脂中,线虫的趋性受到抑制,与灰霉菌或半裸镰刀菌的亲和率较低,其扩散表现为随机性。在药剂浓度为5×10-2μg/mL和5×10-3μg/mL时,则又表现出对真菌的趋性,但与对照相比其亲和率仍较低。
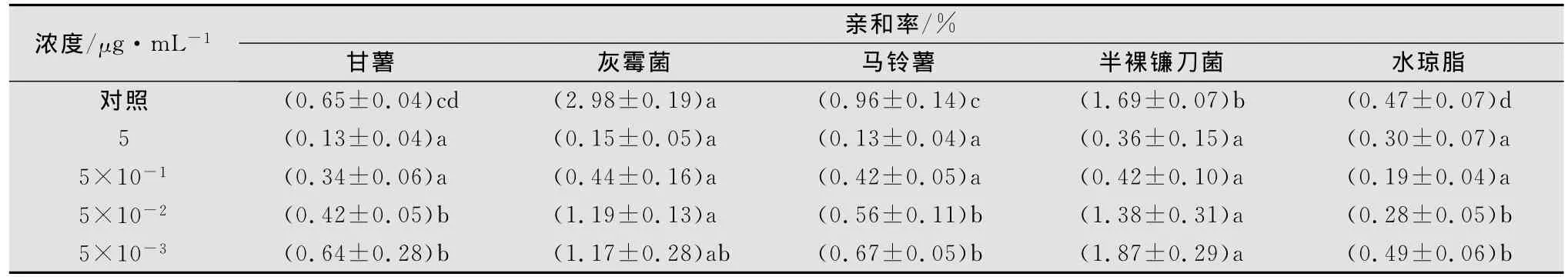
表2 甘薯茎线虫在含不同浓度甲氨基阿维菌素苯甲酸盐水琼脂中的趋化性1)
2.1.3 甘薯茎线虫在含不同浓度丙溴磷水琼脂中的趋化性
丙溴磷对甘薯茎线虫趋化性的影响与甲氨基阿维菌素苯甲酸盐的相似(见表3)。在含丙溴磷5、5×10-1μg/mL的水琼脂平板,线虫与引诱物的亲和率明显低于空白对照,且其扩散也表现出随机性。然而,值得注意的是,甘薯茎线虫在含丙溴磷的水琼脂平板中对甘薯薯块的趋化性发生了改变,尤其在5×10-3μg/mL时,其对甘薯块的趋性显著高于其对马铃薯薯块和半裸镰刀菌的趋性。

表3 甘薯茎线虫在含不同浓度丙溴磷水琼脂中的趋化性1)
2.2 甘薯茎线虫经不同浓度药剂处理后在水琼脂中的趋化性
2.2.1 甘薯茎线虫经不同浓度涕灭威处理后在水琼脂中的趋化性
将甘薯茎线虫浸渍在不同浓度涕灭威药液中24 h,并用灭菌水清洗且恢复24h后滴入1%水琼脂平板中央,36h后观察记录线虫对不同目标物的趋化性(见表4)。结果表明,甘薯茎线虫经涕灭威10-1~10-3μg/mL处理后与灰霉菌或半裸镰刀菌的亲和率较空白对照有所下降,但其趋化性未发生明显的改变,仍对灰霉菌、半裸镰刀菌保持明显的趋性。
2.2.2 甘薯茎线虫经不同浓度甲氨基阿维菌素苯甲酸盐处理后在水琼脂中的趋化性
甘薯茎线虫经甲氨基阿维菌素苯甲酸盐药液10-1~10-3μg/mL处理24h后,其趋性受到很大的影响,且不易恢复,虽与真菌的亲和率明显低于空白对照,但仍然表现出对真菌的趋性(见表5)。甲氨基阿维菌素苯甲酸盐10-3μg/mL处理对线虫的运动、趋性无明显影响。
2.2.3 甘薯茎线虫经不同浓度丙溴磷处理后在水琼脂中的趋化性
甘薯茎线虫经不同浓度丙溴磷药液处理24h并用灭菌水清洗后恢复24h测定发现,经丙溴磷10-1~10-3μg/mL处理后,线虫与真菌的亲和率降低,并表现出扩散的随机性。从表6还可以看出,经丙溴磷10-3~10-4μg/mL处理后,线虫对甘薯薯块的趋性与对灰霉菌块、半裸镰刀菌块和马铃薯块的趋性无显著性差异。
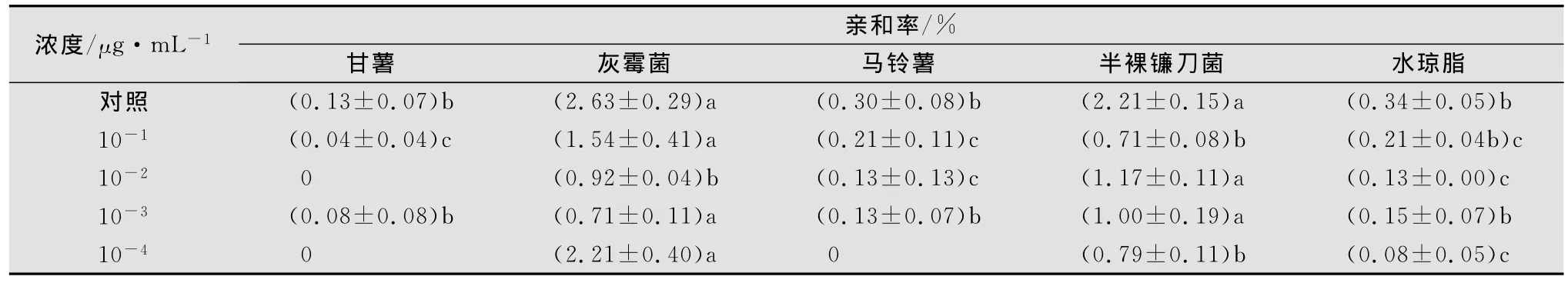
表4 甘薯茎线虫经不同浓度涕灭威处理后对其趋化性的影响1)
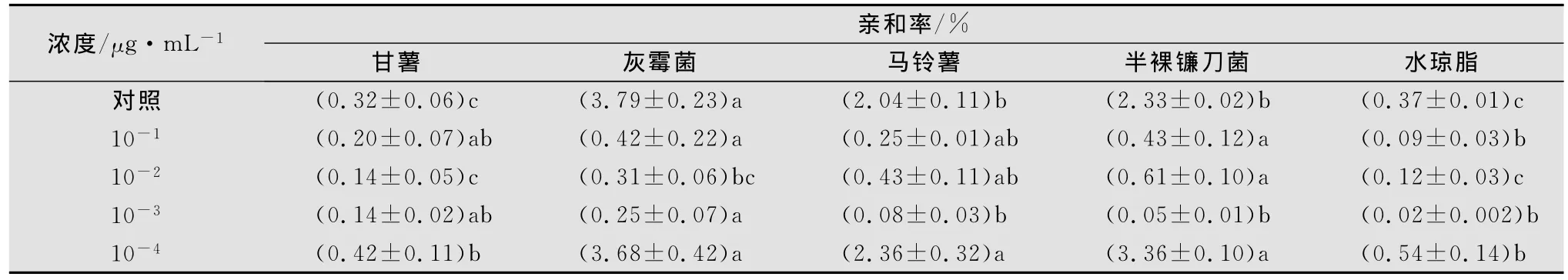
表5 甘薯茎线虫经不同浓度甲氨基阿维菌素处理后对其趋化性的影响1)
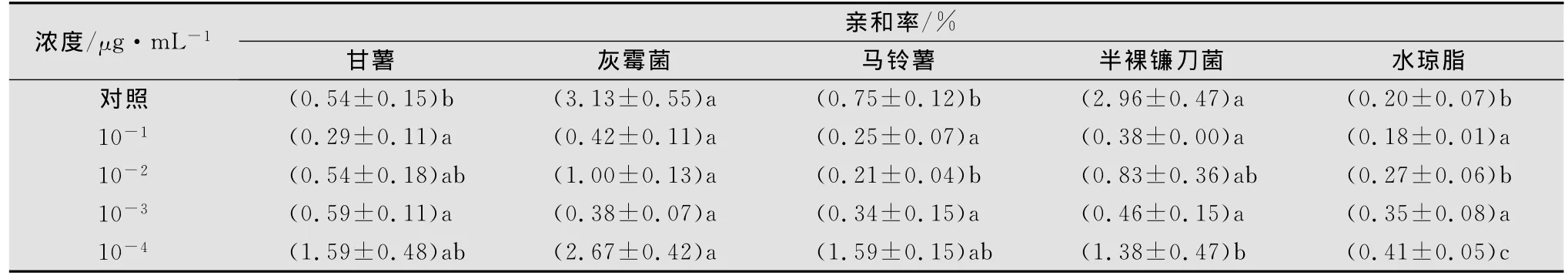
表6 甘薯茎线虫经不同浓度丙溴磷处理后对其趋化性的影响1)
3 讨 论
目前使用的非熏蒸类杀线虫剂均为神经毒剂,杀线虫剂不论是通过何种途径进入线虫体内,其最终的靶标都是线虫的神经系统,破坏其正常功能。由于神经系统控制及调节着整个生物机体的功能,当线虫神经系统的完整性受到破坏后,其生理生化、行为生态等各方面都将受到极大的影响。涕灭威等氨基甲酸酯类杀线虫剂不仅引起线虫麻痹、瘫痪或死亡,低剂量的杀线虫剂还可干扰破坏植物寄生线虫的化学感应[6-8]。线虫的感觉器官不发达,植物寄生线虫仅有位于体表的乳突和虫体前端的1对侧器(amphid),侧器是线虫的化学信号感受器,是加工、传递化学信号的器官[9]。一般认为,涕灭威等药剂在高浓度下可通过线虫的表皮进入体内[10-11],但在低浓度下可通过线虫的化感器并经树突逆向运输到达作用靶标位点,且认为在较低浓度下药剂首先通过神经元而不是通过表皮来进行转移[8]。本研究也证实了线虫在涕灭威、丙溴磷和甲氨基阿维菌素苯甲酸盐一定范围的低浓度环境下或经低浓度药剂处理后,均可对其趋化性产生影响,且不易恢复。
值得注意的是,甘薯茎线虫是一种主要侵染甘薯块根的植物寄生线虫。甘薯茎线虫在本试验中显示出对灰霉菌、半裸镰刀菌的高度趋性,而对甘薯薯块未能表现出趋性,这可能是由于甘薯薯块不含有吸引线虫的趋化物质而影响了线虫的侵入[12]。当然也由于甘薯茎线虫有食菌的特性,该线虫能够在大约40个属70种真菌上繁殖,常见的有Alternaria,Botrytis,Fusarium,Penicillium,Phoma,Trichoderma,Verticillium和Cylindrocarpon属等[13],尤其是Fu-sariumsolani[14]和Botrytiscinerea[15]是甘薯茎线虫培养的良好菌种,其真菌代谢分泌产物中可能含有使线虫产生趋性的趋化物质。同时作者也发现,甘薯茎线虫在低浓度(5×10-3μg/mL)有机磷杀虫剂丙溴磷环境中或经低浓度(10-3~10-4μg/mL)处理后其趋化性发生了改变,表现为对甘薯薯块具有较高的趋性。这可能是由于不同类型的杀线虫剂由于其作用机制的差异,对线虫的化学感应系统产生的影响不同而引起的。在这种情况下田间有可能加重甘薯茎线虫的危害,在应用该类药剂时需要引起注意。
[1]林茂松,文玲,方中达.马铃薯腐烂线虫与甘薯茎线虫病[J].江苏农业学报,1999,15(3):186-190.
[2]Maurof,Robert D.Meiofauna distribution and mesoscale variability in two sites of the Ross Sea(Antarcica)with contrasting food supply[J].Polar Biology,1999,22:115-123.
[3]梁文举,闻大中.土壤生物及其对土壤生态学发展的影响[J].应用生态学报,2001,12(1):137-140.
[4]徐进军,李世东,杨之为.马铃薯茎线虫的培养[J].西北农业学报,2004,13(4):77-80.
[5]丁中,彭德良,何旭峰,等.不同地理种群甘薯茎线虫对不同类型杀线剂的敏感性[J].农药,2007,46(12):851-853.
[6]Trett MW,Perry R N.Effects of the carbamoyloxime,aldicarb,on the ultrastructure of the root-lesion nematodePratylenchuspenetrans(Nematoda,Pratylenchidae)[J].Nematologica,1985,31:321-334.
[7]Perry R N.Chemoreception in plant parasitic nematodes[J].Annual Review of Phytopathology,1996,34:181-199.
[8]Winter MD,Mcpherson MJ,Atkinson H J.Neuronal uptake of pesticides disrupts chemosensory cells of nematodes[J].Parasitology,2002,125:561-565.
[9]王明祖.中国植物线虫研究[M].武汉:湖北科学技术出版社,1998:62-63.
[10]Marks C F,Thomason I J,Castro C E.dynamics of the permeation of nematodes by water,nematocides and other substances[J].Experimental Parasitology,1968,22,321-337.
[11]Ho N F H,Sims S M,Vidmar T J,et al.Theoretical perspectives on anthelmintic drug discovery-interplay of transport kinetics,physicochemical properties,and in-vitro activity of anthelmintic drugs[J].Journal of Pharmaceutical Sciences,1994,83:1052-1059.
[12]漆永红,李秀花,马娟,等.马铃薯腐烂茎线虫侵入甘薯部位以及在植株内的种群动态[J].华北农学报,2008,23(增刊):234-237.
[13]Faukner L R,Darling H M.Pathological histology,hosts and culture of the potato rot nematode[J].Phytopathology,1961,5(11):778-785.
[14]Young H K,Seung H O.In vitro culture and factors affecting population changes ofDitylenchusdestructorof ginseng[J].Korean Journal of Plant Pathology,1995,11(1):39-46.
[15]刘斌,郑经武.腐烂茎线虫单异活体繁殖方法研究[J].浙江农业学报2006,18(6):445-447.
