小菜蛾GluCl受体α亚基cDNA基因克隆和序列分析
2010-06-12梁延坡吴青君刘长仲张友军王少丽徐宝云
梁延坡, 吴青君, 刘长仲, 张友军, 王少丽, 徐宝云
(1.甘肃农业大学草业学院,兰州 730070; 2.中国农业科学院蔬菜花卉研究所,北京 100081)
谷氨酸是脊椎动物和无脊椎动物神经系统内重要的神经递质,在脊椎动物体内主要通过门控阳离子通道介导兴奋性的神经传递,而在无脊椎动物体内谷氨酸既是兴奋性的神经递质[1-3]又是抑制性的神经递质[4]。作为抑制性的神经传递介质,谷氨酸与突触后受体结合后,开启氯离子通道,称为谷氨酸门控的氯离子通道(glutamate-gated chloride channel,GluCl)[5]。GluCl属于半胱氨酸环门控离子通道基因超家族,目前仅在无脊椎动物的神经和肌肉细胞中发现[4],在脊椎动物中尚未发现,因此是较为理想的杀虫剂作用靶标。作用于GluCl的杀虫剂包括阿维菌素/美倍霉素类、苯基吡唑类杀虫剂氟虫腈以及吲哚二萜类化合物nodulisporic acid等[6-8]。人们对于GluCl受体的分子结构和功能的了解大多数来自于对线虫和模式昆虫的研究[5],而对农业昆虫的研究较少。
小菜蛾[Plutellaxylostella(L.)]属鳞翅目菜蛾科,是世界性的十字花科蔬菜重要害虫,对多种杀虫剂都产生了抗药性[9]。近年来对特效生物制剂阿维菌素类也产生了不同程度抗性[10]。早期的研究认为,阿维菌素作用于γ-氨基丁酸(GABA)受体达到杀虫效果[11]。但是后来的研究发现,在较低浓度时,阿维菌素可引起与GABA系统无关的Cl-通道的开放,即谷氨酸控制的Cl-的开放,从而导致膜对Cl-通透性增加,带负电荷的Cl-引起神经元休止电位的超极化,使正常的动作电位不能释放,神经传导受阻,最终引起虫体麻痹死亡[12]。而且研究发现,线虫对伊维菌素(阿维菌素的衍生物)的主要抗性机理是GluCl受体α亚基(GluClα)的碱基突变导致与药物的亲和力下降[13]。可见GluCl受体是阿维菌素类杀虫剂的更为主要的作用靶标。目前小菜蛾对阿维菌素的抗性机理尚未明确,小菜蛾GluCl受体国内外也未见研究报道。本研究利用反转录-多聚酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)的方法首先对小菜蛾的GluCl受体α亚基cDNA片断进行克隆和序列分析,然后采用RACE技术获取小菜蛾GluCl受体α亚基的全长序列,为深入研究小菜蛾GluCl受体的分子特性和揭示阿维菌素类杀虫剂的抗性机理奠定基础。
1 材料与方法
1.1 供试昆虫
供试小菜蛾为于室内用甘蓝苗连续饲养多年的敏感种群,室内饲养温度为(25±2)℃,RH为50%~70%,光周期L∥D=16h∥8h。
1.2 主要试剂和仪器
Trizol Reagent RNA kit和cDNA synthesis kit(SuperScript III)购 自 Invitrogen (USA)公 司;dNTP Mix、DNA Marker,100bp DNA Ladder均购自天根生化科技(北京)有限公司;TaqDNA聚合酶购自Promega公司;克隆载体pEASY-T1vector、Mach1-T1感受态细胞:购自全式金公司;PCR产物回收与纯化试剂盒购自北京百泰克公司;TaKaRa LA Taq®:TaKaRa宝生物工程(大连)有限公司,TaKaRa 3′-Full RACE coreset试剂盒:购自 TaKa-Ra公司;SMARTTMRACE cDNA Amplification Kit:Clontech公司产品,PCR引物由上海生工合成;测序由北京诺赛基因组研究中心有限公司完成;PCR扩增仪为PTC-200,MJR。
1.3 试验方法
1.3.1 总 RNA的提取
参照Trizol Reagent RNA提取试剂盒说明书进行总RNA抽提。
1.3.2 cDNA第1链合成
按Invitrogen公司的cDNA kit说明书进行。cDNA合成步骤参照Invitrogen in SuperScript III First-strand synthesis systeMfor RT-PCR 使 用 程序进行。
1.3.3 GluCl受体α基因cDNA片段的克隆
根据GenBank中已收录的果蝇(Drosophila melanogaster)和秀丽隐杆线虫(Caenorhabditiselegans)GluCl受体α亚基氨基酸序列的保守性区域,设计简并性上下游引物(表1),进行同源克隆。
以cDNA为模板进行PCR扩增,50μL反应体系中含:第1链cDNA产物2μL,5μL 10×TaqDNA Buffer,2mmol/L dNTP,2mmol/L MgCl2,2μL dNTP(10mmol/L),2μL(10μmol/L)DEGF/DEG-R和0.5μL(5U/μL)TaqDNA polymerase。PCR反应条件为:94℃预变性3min,94℃变性1min,50℃退火1min,72℃延伸1min,循环35次,72℃延伸10min。
1.3.4 GluCl受体α亚基全长基因的克隆
1.3.4.1 GluCl受体α亚基3′-末端cDNA的克隆
根据 TaKaRa 3′-Full RACE coreset Kit说明书合成3′端cDNA,并根据片段测序结果,设计了3条特异性上游引物(表1),用于小菜蛾GluClα3′端cDNA序列的扩增,以3′GSP1和3′RACE Outer Primer为第1轮扩增引物,以3′GSP2或3′GSP3和3′RACE Inner Primer为第2轮扩增引物。
第1轮PCR在50μL反应体系中3′cDNA 4μL,1×cDNA Dilution BufferⅡ (Mg2+Plus)6μL,3′GSP1(10μmol/L)2μL,3′Outer Primer(20μmol/L)2 μL,TaKaRa LATaq(5U/μL)0.25μL,10×LA PCR BufferⅡ(Mg2+Plus)4μL,去离子水31.75μL;扩增程序为:95℃3min,94℃30s,55 ℃ 30s,72 ℃ 1.5min,35个循环;72℃10min。将第1轮PCR产物稀释50倍作Nest-PCR 模 板,以 (3′NGSP2/3′RACE Innerprimer)和(3′NGSP3/3′RACE Inner-primer)为引物,进行第2轮PCR,扩增程序为:95℃3min;94℃30s,58 ℃ 30s,72 ℃ 1.5min,35个循环;72℃10min。
1.3.4.2 GluCl受体α亚基5′-末端cDNA的克隆
参照SMARTTMRACE cDNA Amplification Kit(Clontech)使用说明进行5′cDNA的合成,根据片段和3′RACE结果设计5′RACE特异性引物(表1)用于获取5′端cDNA序列。
以5′GSP1和UPM为第1轮引物,94℃30s,72℃3min,5个循环;94℃30s,70℃ 30s,72 ℃3min,5 个 循 环;94 ℃ 30s,68 ℃ 30s,72 ℃3min,30个循环;72℃10min。将第1轮PCR产物稀释50倍用5μL做Nest-PCR模板,以5′NGSP1和NUP为第2轮引物进行PCR扩增,扩增程序为:94℃30s,68℃30s,72℃3min,30个循环;72℃10min。

表1 试验中设计的引物序列
1.3.5 cDNA 全长的验证
根据扩增得到的5′和3′端片段的序列分别设计扩增全长cDNA的引物 QC-F/QC-R(表1)以验证基因的完整性。扩增程序为:95℃3min,94℃30s,55 ℃ 30s,72 ℃ 2min,35 个 循 环;72 ℃10min。
1.3.6 PCR产物的克隆与测序
将PCR产物经DNA纯化回收试剂盒回收纯化后,克隆于PEASY-T1载体中,挑取阳性克隆经酶切和PCR鉴定后,送北京诺赛基因组研究中心有限公司进行测序。
1.3.7 在线序列比对和分析程序
蛋白质序列分析采用ExPASy在线ScanProsite程序;蛋白质分子量和等电点分析采用http∥:www.expasy.org/tools/pi-tool.html在线工具;序列比对使用ClustalW程序;序列和数据搜索使用NCBI上的Blast在线程序;信号肽序列预测采用http:∥www.cbs.dtu.dk/services/SignalP 在线程序进行;进化分析采用 MEGA4.0软件[14]。
2 结果与分析
2.1 小菜蛾GluCl受体α亚基cDNA全长的克隆及序列分析
通过简并性上下游引物进行RT-PCR扩增,结果见图1a,扩增所得的片段大小约为192bp,与预期的目的扩增片段大小相符。将PCR产物克隆测序,所得cDNA片段总长度为192bp,与已知昆虫的GluCl受体α亚基氨基酸序列进行相似性分析,与果蝇和飞蝗(Locustamigratoria)的氨基酸序列相似性为80%,表明克隆的cDNA片段是小菜蛾GluClα亚基基因的部分序列。根据已获得的基因序列,分别设计5′-和3′-特异性引物,通过 RACE策略,成功的获得含有5′-及3′-非编码区的序列,其中3′端长度为1 014bp(图1b),测序结果分析后发现,在这个片段包含一个TGA终止子以及多个TAA,在终止子的下游包含一个长603bp的非编码区(UTR)。末端具有真核生物mRNA典型特征:一个含15个腺嘌呤的poly(A),在前面出现了加尾信号 AATAAA;5′-端序列长为1 090bp(图1c),在这个片段中包含一个起始密码子(ATG),在起始密码子前有197bp的非编码区(图2)。序列分析结果可以证实得到了小菜蛾GluClαcDNA的完整序列。
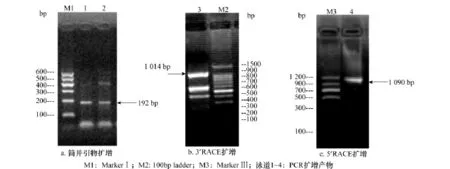
图1 PCR扩增电泳图谱
将5′-和3′-端序列拼接,得到了基因的全序列。为了进一步验证拼接序列的正确性,通过已获得的序列设计了基因编码区的特异性引物以扩增全长cDNA片段。PCR扩增获得了与预期大小相符的条带,克隆结果同拼接序列比较,氨基酸序列并无差异,进一步验证了获得的基因序列的准确性和完整性。
2.2 序列分析
GluClα亚基cDNA全长2 144bp,用DNAMAN软件进行分析,其开放阅读框(ORF)长为1 344bp,编码447个氨基酸残基,根据在线软件SignalP 3.0(http:∥www.cbs.dtu.dk/servi-ces/SignalP/)分析GluClα亚基氨基酸序列信号肽剪切位点,其信号肽最有可能的切割位点在第24位与第25位之间,预测出GluClα亚基蛋白信号肽序列含25个氨基酸,其序列为:MDVLRPSCALFVLFLLYCAHLTECV(图2);蛋白质切割信号肽后经过简单的加工过程而成为成熟肽;预测其蛋白分子量为51348.7u,其蛋白序列的理论等电点为8.46;相似性分析表明:它与埃及伊蚊的相似性为75%,与果蝇的相似性为73%,与赤拟谷盗的相似性为73%,与东亚飞蝗的相似性为79%。用在线软件TMHMM2.0预测跨膜结构其包含有4个跨膜结构域,TM1-4(图2)具有 GluClα亚基的典型特征:有一个长的N-末端半胱氨酸的胞外区和4个跨膜区和C-端胞外区,在其亲水的胞外区由2对十分保守的半胱氨酸二硫键形成氨基酸残基的桥环,其中第1对包含13个氨基酸残基,第2个包含10个氨基酸残基(图2),这些特征表明该基因编码受体α亚基。


图2 编码小菜蛾的GluClα亚基核酸序列及推导的氨基酸序列
2.3 进化分析
在GenBank中搜索果蝇、赤拟谷盗(TriboliuMcastaneum)、蝗虫、蜜蜂(Apismellifera)和秀丽隐杆线虫、犬心丝线虫(Cylicocyclusnassatus)、肿孔古柏线虫(Cooperiaoncophora)等物种的GluCl基因的α、β亚基的氨基酸序列,应用MEGA4.0软件通过邻位法(neighbor-joining)进行系统进化分析,以1 000次回抽的置信度作置信分析,结果如图3所示,分别标注在分支节点上,每个分支末端依次为不同物种的GluCl的蛋白基因登录号和物种名。系统进化分析表明:GluCl基因分为Ⅰ、Ⅱ两个组,分别代表GluClα基因和GluClβ基因,Ⅰ组又可分两亚族:昆虫组Ⅰa和线虫组Ⅰb;小菜蛾的GluCl属于Ⅰa,昆虫α亚基;由此证明了克隆的基因为GluCl受体的α亚基。
3 讨论
谷氨酸是一种重要的神经递质,在无脊椎动物中GluCl作为抑制性配体起作用,在昆虫和甲壳类动物中,谷氨酸被公认为是作用于H受体而导致其去极化的这一假说。目前,在一些线虫和果蝇属中,GluCl已被克隆,并在爪蟾卵母细胞中表达,通过已克隆的通道显示,无脊椎动物的GluCl受体上具有阿维菌素类药剂的作用位点[15]。相对于线虫,人们对昆虫GluCl受体研究较少,其通道特性与线虫的亦有所不同。目前GluCl受体在其他昆虫如非洲钝缘蜱、扁虱、草地贪夜蛾、谷实夜蛾[16]、美洲大蠊[7]、家蝇[17]和东亚飞蝗[18]等体内也有发现,但目前对任何生物的GluCl亚基的构成都不明确。
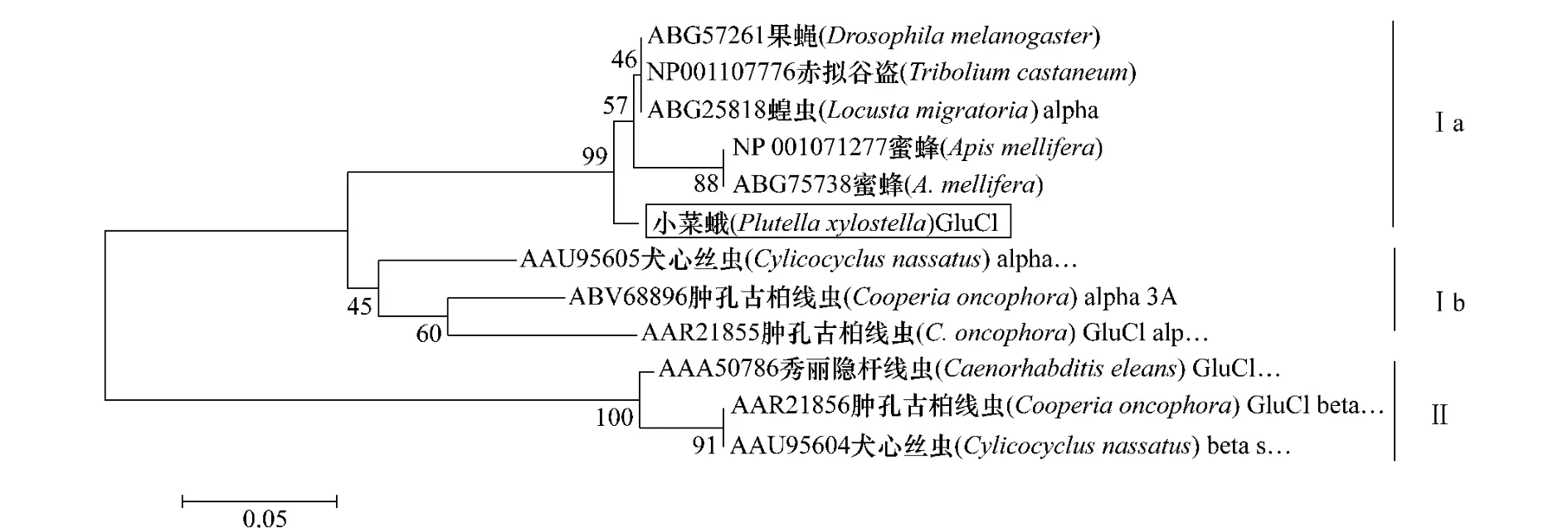
图3 不同物种间GluCl蛋白的系统进化分析
靶标不敏感性是害虫对杀虫剂产生抗性极为重要的一种机制,尤其与高水平抗性有关。遗传学研究表明,小菜蛾对阿维菌素的抗性是常染色体、不完全隐性遗传,而且可能是有多基因控制的抗性遗传[19]。吴青君[20]的研究认为,GABA 受 体 结合 数目的降低是小菜蛾对阿维菌素产生抗性的重要机制之一,放射性配体结合分析表明,敏感和抗性种群的受体亲和力均无显著差异,但抗性种群受体最大的结合数目比敏感种群降低了63.6%,说明是受体数目的减少,而不是结构上的改变导致了小菜蛾对阿维菌素的抗性。目前,还没有GluCl受体不敏感性与昆虫抗药性关系的报道。本研究首次利用简并引物通过RT-PCR和RACE技术成功地克隆了小菜蛾GluClα亚基的全长序列,根据这段序列可设计特异性引物进行抗性小菜蛾cDNA全长克隆和功能表达,比较其抗性和敏感种群的氨基酸差异,从分子水平明确小菜蛾GluCl功能亚基的分子性质,为研究小菜蛾对阿维菌素类杀虫剂抗性靶标不敏感的分子机制奠定基础。
[1]Gration K A,Clark R B,Usherwood P N.Three types of L-glutamate receptor on junctional membrane of locust muscle fibres[J].Brain Research,1979,171(2):360-364.
[2]Patlak J B,Gration K A,Usherwood P N.Single glutamateactivated channels in locust muscle[J].Nature,1979,278:643-645.
[3]Uitsch A,Schuster C M,Laube B,et al.Glutamate receptors ofDrosophilamelanogaster:cloning of a kainite-selective subunit expressed in the central nervous system[J].Proc Natl Acad Sci USA,1992,89(21):10484-10488.
[4]Cleland T A.Inhibitory glutamate receptor channels[J].Mol Neurobiol,1996,13:97-136.
[5]吴青君,张友军,徐宝云.抑制性谷氨酸受体(IGluRs)通道及其相关杀虫剂的作用[J].农药学学报,2008,10(3):251-259.
[6]Bloomquist J R.Chloride channels as tools for developing selective insecticides[J].Arch Insect BiocheMPhysiol,2003,54:145-156.
[7]Zhao X L,Yeh J Z,Salgado V L,et al.Fipronil is a potent open channel blocker of glutamate-activated chloride channels in cockroach neurons[J].Journal of Pharmacology and Experimental Therapeutics,2004,314(1):363-373.
[8]Smith MM,Warren V A,Thomas B S,et al.Nodulisporic acid opens insect glutamate-gated chloride channels:identification of a new high affinity modulator[J].Biochemistry,2000,39(18):5543-5554.
[9]吴青君,张文吉,朱国仁.小菜蛾的发生为害特点及抗药性现状[J].中国蔬菜,2001(5):49-51.
[10]Syed T S,Abro G H,Ahmed S.Efficacy of different insecticides againstPlutellaxylostellaunder field conditions[J].Pakistan Journal of Biological Sciences,2004,7(1):10-13.
[11]Campbell W C.Ivermectin:an update[J].Parasitol Today,1985,1(1):10-16.
[12]Shoop W L,Mrozik H,Fisher MH.Structure and actvity of avermectins and milbemycins in animal health[J].Veterinry Parasitology,1995,59(2):139-156.
[13]Kane N S,Hirschberg B,Qian S,et al.Drug-resistantDrosophilaindicate glutamate-gated chloride channels are targets for the antiparasitics nodulisporic acid and ivermectin [J].PNAS,2000,97(25):13949-13954.
[14]Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Mol Biol Evol,2007,24:1596-15991.
[15]Cully D F,Wilkinson H,Vassilatis D K,et al.Molecular biology and electrophysiology of glutamate-gated chloride channels of invertebrates[J].Parasitology,1996,113:S191-S200.
[16]Cully D F,Paress P F,Liu K K,et al.Identification of aDrosophilamelanogasterglutamate-gated channel sensitive to the antiparasitic agent avermectin[J].The American Society for Biochemistry and Molecular Biology,1996,271:20187-20191.
[17]Eguchi Y,Ihata M,Ochi E,et al.Functional characterization ofMuscaglutamate-and GABA-gated chloride channels expressed independently and coexpressed inXenopusoocytes[J].Insect Molecular Biology,2006,15(6):773-783.
[18]Janssen D,Derst C,Buckinx R,et al.Dorsal unpaired median neurons ofLocustamigratoriaexpress ivermectin and fipronilsensitive glutamate-gated chloride channels[J].Journal of Neurophysiology,2007,97:2642-2650.
[19]李腾武,高希武,郑炳宗,等.小菜蛾对阿维菌素的抗性遗传分析及交互抗性研究[J].植物保护,1999,25(6):12-14.
[20]吴青君,张文吉,张友军,等.表皮穿透和GABAA受体不敏感性在小菜蛾对阿维菌素抗性中的作用[J].昆虫学报,2002,45(3):336-340.
