不同剂量的 β-胡萝卜素对仿刺参((Aposti chopus japoni cus)组织和粪便中 β-胡萝卜素含量的影响
2010-06-08王秋一姜玉声王吉桥
王秋一 姜玉声 王吉桥
(大连水产学院农业部海洋水产增养殖学与生物技术重点开放实验室 辽宁 大连 116023)
前 言:动物体内不能合成β-胡萝卜素,只能由食物中摄取。人们一般认为水产动物金黄的色泽没有任何营养价值,只是为了满足人们的审美观。其实在饲料中合理添加 β-胡萝卜素对动物和人都有一定的保健功能。单从表面来看,添加色素只是为了水产品表观色泽鲜艳,以满足人们的视觉需求。对于商品水产品来说,色素在其内的吸收与其机体健康状况紧密相关,如果水产品生病或长期处于不良环境的应激下,会极大地影响色素的吸收,所表现的外表色彩与正常健康的产品有着明显的差异。这样通过色素在水产品外表上的体现,让消费者非常容易分辨产品的质量。另外目前饲用着色剂主要是天然和化学合成的β-胡萝卜素及其衍生物。β-胡萝卜素具有提高机体抗氧化能力、抗肿瘤、提高免疫力和繁殖力等重要功能,与动物和人类的健康有着密切的关系,在人类疾病预防治疗癌症及慢性病等过程中起到非常重要的作用。
国外对海胆中 β-胡萝卜素含量,代谢等研究较多[1-6],对海参研究较少,国内更是几乎空白。
探讨投喂含不同水平β-胡萝卜素饲料对仿刺参各个组织β-胡萝卜素的吸收和沉积情况,饲料中添加不同剂量的 β-胡萝卜素,饲养一个周期后对仿刺参肠、体壁、粪便中 β-胡萝卜素进行测定,为海参 β-胡萝卜素的代谢及实际生产应用提供参考。
1 材料与方法
1.1 实验试剂与仪器
721型可见分光光度计(上海光谱仪器有限公司),电子天平,β-萝卜素标准品(购于大连精细化工),旋转蒸发仪,玻璃色谱柱,冷冻离心机,10m l离心管,滤纸,针头式 0.45μ m微孔滤膜(有机相),研钵,氧化铝(100-200目),石油醚,丙酮,无水硫酸钠(以上试剂均为分析纯)。
1.2 实验动物及养殖方式
实验用仿刺参购于大连市周边养殖场,规格为 76~145g;使用自制自净式循环水养殖系统(参考本文第二章)养殖;实验共用海参 32头,每 2头置于一个小格中,使每格海参体重保持在210±10g。
本实验,饲料中添加 β-胡萝卜素分别为 30(C组)、60(B组)、90mg/kg(A组)饲料,并设对照组(D组);每组为 8头海参。
1.3 试验方法
1.3.1 样品中 β-胡萝卜素的提取
实验方法参考国标及杨式华[7-13]等人的方法,步骤如下:
⑴称取仿刺参组织,置于研钵中,加入石油醚 +丙酮(1+1)混合液 3m l反复研磨。⑵吸取上清液并置于10m l离心管中,使用冷冻离心机离心(7000r a/min,5min)。⑶离心后吸取上清液,余下液体及沉积物放回研钵中,加入石油醚 +丙酮(1+1)混合液继续研磨,反复 2、3步骤 3-4次,直到研钵中上清液无色。⑷合并上清液,用滤纸过滤;滤纸中放 2g无水硫酸钠。⑸过滤液放置于旋转蒸发仪中蒸干。⑹用少量石油醚溶解旋转蒸发仪中物质,吸出溶液。⑺氧化铝湿法填装玻璃色谱柱,将⑹中溶液倒入色谱柱并用石油醚淋洗。⑻收集最先洗出的橙色物质于 2m l离心管中定容。⑼用分光光度计于 454n m波长处测定。
1.3.2 标准曲线的绘制
精确称取β-胡萝卜素标准品 12.5mg于烧杯中,用石油醚溶解并洗涤数次,置于 50m l容量瓶中,用石油醚定容,浓度为 250μ g/m l,-20℃储存。备用,2个月内稳定。使用时可稀释至成100μ g/m l。
分别吸取 β-胡萝卜素使用液配置成浓度梯度 0、0.5、1.0、2.0、3.0、4.0μ g/m l。
标准曲线:y=0.1848x+0.0107,R 2=0.9975
1.3.3 数据处理
所有测定数据经Excel和SPSS16.0软件进行计算分析进行相关性检验、方差分析和L S D多重比较,以 P<0.01为差异极显著,P<0.05为差异显著。
2 结果
2.1 样品中 β-胡萝卜素定性
用紫外 -可见分光光度计在 350n m~600n m波长范围内进行扫描,结果如图 1、2所示。可看出,β-胡萝卜素在 350n m~600n m波长范围内有两个特征吸收高峰,分别为 454n m波长处(最大)和 478n m波长处(次之)。
比较图 1、图 2,两图形状相同,可以认为提取的样品为 β-胡萝卜素。


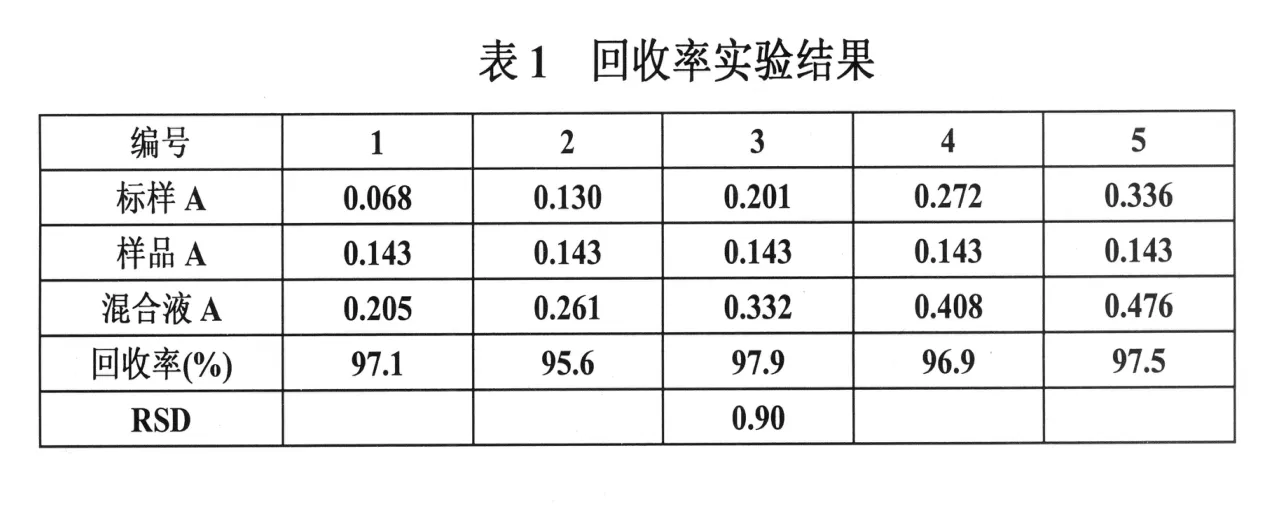
2.2 回收率实验
分别取各浓度标样溶液各 5m l稀释至 10m l,分别其吸收度,再测定按体积比为 1:1的标准溶液与混合液的吸收度,结果列入表 1。平均回收率 97.0%,R S D为 0.90%。
?
2.3 添加不同剂量的 β-胡萝卜素对仿刺参各组织及粪便中 β-胡萝卜素含量影响

饲料中分别添加30(C组)、60(B组)、90(A组)mg/kg,仿刺参肠中 β-胡萝卜素含量如图 3。A组仿刺参性腺中 β-胡萝卜素含量最高(42.67μ g/g),B组次之(12.07μ g/g),对照组第三(11.76μ g/g),C组最低(10.45μ g/g),A组极显著高于其他组(P<0.010),其他 3组相差不明显(P>0.050)。

四组仿刺参体壁中β-胡萝卜素含量如图4。B组仿刺参体壁中 β-胡萝卜素含量最高(1.61μ g/g),A组次之(1.58μ g/g),对照组第三(1.55μ g/g),C组最低(1.54μ g/g),四组差异均不显著((P>0.050)。

四组仿刺参粪便中 β-胡萝卜素含量如图 5。A组仿刺参粪便中 β-胡萝卜素含量最高(16.37μ g/g),B组次之(13.50μ g/g),C照组第三 (7.48μ g/g),D组最低 (4.37μ g/g),而高剂量β-胡萝卜素添加组极显著高于对照组(P<0.010);并且四组仿刺参粪便中 β-胡萝卜素含量与饲料中添加 β-胡萝卜素剂量有良好的相关性,R 2=0.9795。
3 讨论
β-胡萝卜素作为维生素 A原,动物体只能通过摄食来取得。对水产动物的生理功能主要有:①抗紫外辐射的保护作用;②作为受精激素,改善卵质;③提高免疫,促进生长和成熟;④增强对高氨和低氧的耐受性;⑤作为维生素 A的前体;⑥水生动物的强抗氧化剂和脂质过氧化的抑制剂;⑦在鱼的肌肉生长和皮肤中沉积作为着色剂,在繁殖季节成熟的雄鱼将类胡萝卜素集中到皮肤上形成第二性征—婚姻色,而雌鱼则将类胡萝卜素集中在卵巢形成幼体的保护色。
国外对同为棘皮动物的海胆在 β-胡萝卜素作用方面做了很多研究[14-16],但国内外鲜有对 β-胡萝卜素对海参生理、生化及代谢等方面的报道。本文对摄食不同剂量 β-胡萝卜素的仿刺参性腺、肠、体壁及粪便分别进行了取样、测定 β-胡萝卜素的含量。
本实验饲料中分别添加 30(C组)、60(B组)、90(A组)mg/kg的 β-胡萝卜素。A组仿刺参肠中β-胡萝卜素含量最高(42.67μ g/g),B组次之(12.07μ g/g),对照组第三(11.76μ g/g),C组最低(10.45μ g/g),A组极显著高于其他组(P<0.010),其他 3组相差不明显(P>0.050),可以看出高剂量 β-胡萝卜素添加时仿刺参肠中可大量储存 β-胡萝卜素。体壁中,B组仿刺参 β-胡萝卜素含量最高(1.61μ g/g),A组次之(1.58μ g/g),对照组第三(1.55μ g/g),C组最低(1.54μ g/g),四组差异均不显著((P>0.050),可知 β-胡萝卜素对仿刺参体壁中 β-胡萝卜素没有显著性影响。粪便中 β-胡萝卜素含量:A组 >B组 >C组 >D组,且与饲料中 β-胡萝卜素添加量有良好的相关性,说明仿刺参的 β-胡萝卜素摄入量与排泄量正相关,即摄入多,排泄多;摄入少,排泄少,这有可能是海参对 β-胡萝卜素吸收效率较低造成。
略)
