小麦可溶性非淀粉多糖对大鼠肠道形态与功能的影响
2010-06-07贺永惠王清华苗志国刘长忠王艳荣崔艳红
贺永惠 王清华 苗志国 刘长忠 王艳荣 崔艳红 何 云
小麦中的非淀粉多糖(non-starch polysaccharides,NSP)作为功能性多糖的重要组成成分是阿拉伯木聚糖,具有通便、降血脂、抗结肠癌、抗肿瘤、增强免疫力等生理功能。在常规条件下无法区分天然存在的小麦及其副产品中可溶性NSP对小肠形态结构的影响,人们趋于提取出相应的成分分别进行研究。因此我们用酶法从小麦麸皮中提取出可溶性NSP,以大鼠作为动物模型,研究可溶性NSP对大鼠肠道形态与功能的影响,从而对深入了解小麦NSP的生理功能有重要意义。
1 材料与方法
1.1 试验材料
按Choct和Annison[2]的方法用水从小麦麸皮中提取出可溶性NSP,提取物均为白色,其主要的单糖组成是阿拉伯糖和木糖,其粗蛋白质含量为12.2%,总非淀粉多糖含量为82.3%。
1.2 试验设计
试验采用单因素随机区组设计,研究在玉米淀粉-酪蛋白纯合日粮的基础上梯度添加0%、2%、3%、4%小麦可溶性NSP对大鼠肠道结构与功能的影响。试验选用48只初始体重(190.9±2.0)g的SD雄性大鼠,随机分成4个处理(基础试验日粮配方见表1),每处理6个重复,每重复2只大鼠,饲养在尺寸为20 cm×17.5 cm×19.5 cm的代谢笼内。舍内气温由空调控制在(22±2)℃,相对湿度为(50±10)%,每天光照 12 h,自由饮水。日粮配方按美国营养协会制定的AIN-93G配制而成[3]。试验期8 d,第8 d饲喂后,将大鼠用乙醚麻醉后打开体腔,取十二指肠、空肠、回肠的中段各两份,一份用甲醛固定,苏木精和乙红染色,分别观察绒毛长度和隐窝深度。一份经液氮冷冻后按Bardocz和White的方法[4]分析组织中蛋白质、RNA和DNA的含量。取盲肠食糜-20℃冷冻,按Zhang等[5]的方法测定盲肠挥发性脂肪酸含量。
1.3 统计分析
采用 SAS 软件(SAS Institute,1998)的一般线性模型(GLM)进行线性、二次回归分析。差异显著时采用LSD多重比较,以P<0.05作为判定差异显著性的标准。
2 结果与讨论
2.1 可溶性NSP对大鼠小肠形态的影响(见表2)
从表2可以看出,随着日粮中可溶性NSP水平的提高,可线性降低小肠各段绒毛高度(P<0.05)。大鼠十二指肠、空肠的隐窝深度随可溶性NSP水平的提高而线性增加(P<0.05),而大鼠回肠的隐窝深度随日粮中可溶性NSP的水平而变化不显著(P>0.05)。黏性食糜可以增加小肠绒毛损失率从而导致绒毛萎缩,可促进隐窝细胞的发育从而提高隐窝深度[6],说明小麦水溶性NSP可从小肠形态方面影响大鼠营养物质的消化吸收。
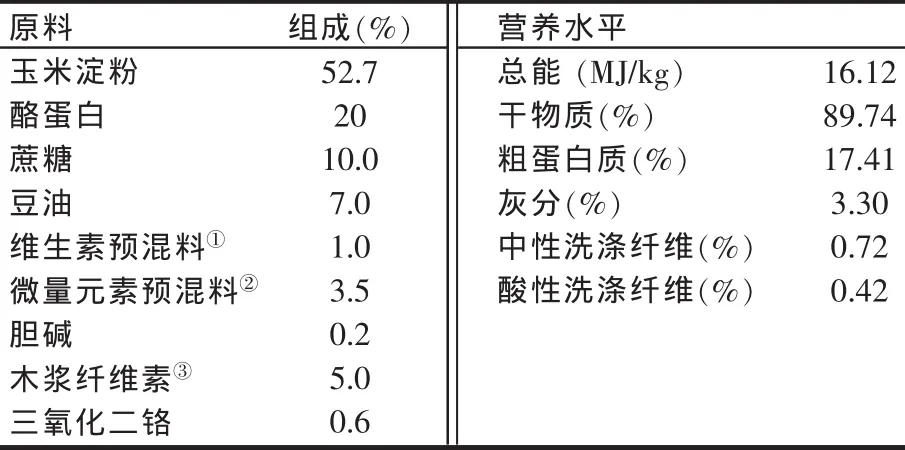
表1 基础试验日粮成分及营养水平
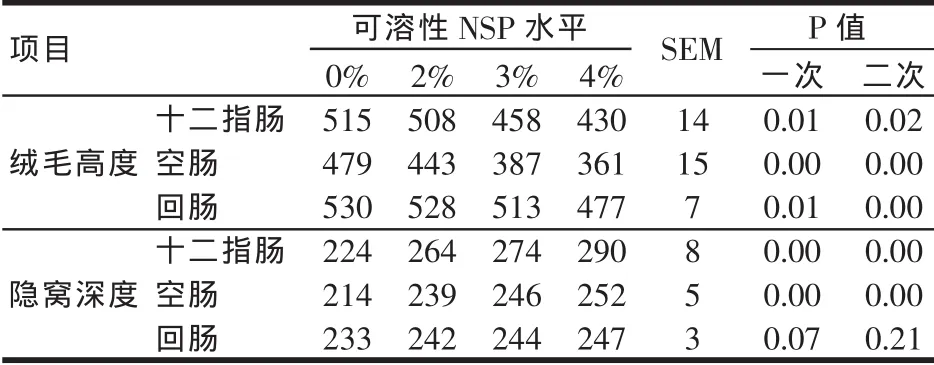
表2 可溶性NSP对大鼠小肠形态结构的影响
2.2 可溶性NSP水平对大鼠小肠细胞增殖和多胺含量的影响(见表3)

表3 可溶性NSP水平对大鼠小肠蛋白质、核酸和多胺含量的影响
从表3可以看出日粮中添加不同水平的NSP在8 d的饲养时间内对小肠蛋白质总量、DNA、RNA、蛋白质/DNA、RNA/DNA、蛋白质/RNA各值无显著影响(P>0.05)。据报道水溶性NSP可增加肠道黏蛋白和胰液的分泌[7]及黏膜细胞的生成[8]。Iji等[9](2001)报道高粘度的NSP可提高肉鸡空肠蛋白质合成率(蛋白质/RNA)和细胞大小(蛋白质/DNA),却降低回肠细胞的增殖(RNA/DNA),提高回肠蛋白质合成率(蛋白质/RNA)。然而本试验中这几个指标未表现出显著性差异,这也许是在短时间内该项指标灵敏度不高所致。
日粮中梯度添加可溶性NSP可线性提高小肠腐胺和精胺的含量(P<0.05),不影响小肠中亚精胺含量(P>0.05)。多胺是促进细胞分化、蛋白质合成和组织生长发育的重要物质,尤其是对小肠黏膜上皮细胞等快速增殖和分化的组织细胞[10]。在体内多胺生成的增加可能是小肠黏膜中鸟氨酸脱羧酶活性增加所致,也可能是肠道增生的微生物合成所致,也可能是体内的其它器官或组织进行分解代谢而释放的多胺,经血液循环被小肠吸收的。
2.3 可溶性NSP水平对大鼠盲肠挥发性脂肪酸的影响(见表 4)

表4 可溶性NSP水平对大鼠盲肠挥发性脂肪酸的影响
从表4可以看出,日粮中添加不同水平的NSP可线性提高大鼠盲肠乙酸、丙酸、丁酸及总挥发性脂肪酸的含量(P<0.05),其中丁酸可抑制结肠细胞增殖,诱导结肠癌细胞的分化,并加速其凋亡,可起到防止结肠癌、大肠癌作用。说明可溶性NSP可作为微生物发酵的底物,促进盲肠微生物的发酵[11-12]。
3 小结
日粮中梯度添加小麦可溶性NSP可改变大鼠肠道形态、多胺的含量和微生物的发酵。从而提高动物的生产性能,减少疾病的发生。
[1]Annison G.Relationship between the levels of soluble non starch polysaccharides and the apparent metabolizable energy of wheats assayed in broiler chickens[J].J.Agric.Food Chem.,1991(39):1252-1256.
[2]Choct M,G.Annison.Anti-nutritive activity of wheat pentosans in broiler diets[J].Br.Poult.Sci.,1990(31):811-821.
[3]Reeves P G,F.H.Nielsen,G.C.Fahey Jr.AIN-93 purifed diets for laboratory rodents:Final report of the American institute of nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J].J.Nutr.,1993,123:1939-1951.
[4]Bardocz S,A.White.Effect of lectins on uptake of polyamine.In:J.M.Rhodes,and J.D.Milton (ed.)Methods in Molecular Medicine,Volume 9:Lectin Methods and Protocols.New Jersey:Human Press,1997:393-405.
[5]Zhang D F,D.F.Li,X.S.Piao,et al.Effects of replacing corn with brown rice or brown rice with enzyme on growth performance and nutrient digestibility in growing pigs.Asian-Aust[J].J.Anim.Sci.,2002(15):1334-1340.
[6]Montagne L,Pluske J R,Hampson D J,A review of interactions between dietary fibreand the intestinalmucosa,and their consequences on digestive health in young non-ruminant animals[J].Anim.Feed Sci.,Tech.,2003,108:95-117.
[7]Ikegami S,F.Tsuchihashi,H.Harada,et al.Effect of viscous indigestible polysaccarides on pancreatic-biliary secretion and digestive organs in rats[J].J.Nutr.,1990,120:353-360.
[8]Johnson I T,J.M.Gee.Gastrointestinal adaptation in response to soluble non-available polysaccharides in the rat[J].Br.J.Nutr.,1986,55:497-505.
[9]Iji P A,A.A.Saki,D.R.Tivey.Intestinal development and body growth of broiler chicks on diets supplemented with non-starch polysacchariedes[J].Anim.Feed Sci.,Technol.,2001,89:175-188.
[10]Wu G.,N.E.Flynn,D.A.Knabe.Enhanced intestinal synthesis of polyamines from proline in cortisol-treated piglets[J].Am.J.Physiol.Endocrinol.Metab.2000,279:E395-E402.
[11]Bach Knudsen K E,B.Borg Jensen,J.O.Andersen,et al.Gastrointestinal implications in pigs of wheat and oat fractions.2.Microbial activity in the gastrointestinal tract.Br.J.Nutr.1991,65:233-248.
[12]Choct M,R.J.Hughes,J.Wang,et al.Increased small intestinal fermentation is partly responsible for the anti-nutritive activity of non-starch polysaccharides in chickens [J].Br.Poult.Sci.,1996,37:609-621.
