谷胱甘肽电化学检测方法的研究
2010-06-05方桂杰,谢卫红
谷胱甘肽(GSH)是细胞内最丰富的低分子量巯基化合物,在人体代谢中发挥重要的作用,包括外源化学物质解毒作用、细胞稳态的维持、辐射防护和抗氧化等[1];且GSH的消除与人体多种疾病密切相关,如糖尿病、艾滋病和神经退行性疾病等[2~4]。现已发展了多种GSH分析检测方法,如酶法[5,6]、荧光测定法[7]、高效液相色谱法等。但这些方法存在灵敏度和选择性较低、需要大型仪器及复杂耗时的柱前或柱后衍生[8~10]等缺陷;而电化学方法灵敏、简便、快速。
作者在此研究了铜(Ⅱ)和铬(Ⅵ)两种金属离子在金电极上的电化学响应与GSH浓度的关系,由此建立了一种灵敏、简便的GSH电化学检测方法。
1 实验
1.1 试剂及仪器
GSH,Sigma公司;其它试剂均为分析纯;实验用水为二次蒸馏水。
CHI760c型电化学工作站,上海辰华仪器公司;Mettler-Toledo DELTA 320型pH计,Mettler-Toledo Instruments(上海)Co.,Ltd.;三电极体系:裸金电极为工作电极,铂丝电极为对电极,饱和甘汞电极为参比电极。文中所有电位均相对于参比电极而言。
1.2 方法
在循环伏安(CV)法扫描前,溶液均通N2除氧15 min。将金电极先用Al2O3粉末抛光,再依次用Piranha溶液[V(浓H2SO4)∶V(30% H2O2)=1∶1]、丙酮水溶液[V(丙酮)∶V(水)=1∶1]、二次蒸馏水超声振荡清洗,放干待用。所有测定均在室温下进行。
1.3 GSH对铜(Ⅱ)在金电极上的电化学行为的影响
在+0.6~-0.5 V电位范围内,对硫酸铜浓度为2.0×10-4mol·L-1的磷酸缓冲溶液(0.1 mol·L-1,pH=5.6,NaH2PO4-Na2HPO4缓冲溶液)以100 mV·s-1的扫描速度进行CV扫描,记录CV曲线。再加入不同浓度的GSH溶液在同等条件下进行CV扫描。
1.4 GSH对铬(Ⅵ)在金电极上的电化学行为的影响
参照文献[11],分别配制0.02 mol·L-1、0.01 mol·L-1的K2Cr2O7标准溶液。准确量取K2Cr2O7标准溶液0.05 mL于5 mL量瓶中,用含0.001 mol·L-1H2SO4的0.1 mol·L-1NaNO3溶液加至刻度,摇匀,倒入10 mL烧杯中通N215 min,即为2.0×10-4mol·L-1和1.0×10-4mol·L-1的铬(Ⅵ)溶液。将铬(Ⅵ)溶液分别在三电极体系中扫描,记录CV曲线,电位范围为+0.8~-0.2 V,扫描速度为200 mV·s-1。再加入不同浓度的GSH溶液在同等条件下进行CV扫描。
2 结果与讨论
2.1 GSH对铜(Ⅱ)在金电极上的电化学行为的影响(图1)

1.2.0×10-4 mol·L-1铜(Ⅱ) 2.2.0×10-4 mol·L-1铜(Ⅱ)+1.0×10-9 mol·L-1 GSH
由图1可以看出,2.0×10-4mol·L-1铜(Ⅱ)在约0.28 V处出现了一个还原峰,当加入GSH溶液后,峰电流下降,见表1。

表1 不同浓度GSH对铜(Ⅱ)在金电极上峰电流的抑制
铜(Ⅱ)峰电流与1.0×10-8~8.0×10-8mol·L-1范围内的GSH浓度呈线性相关,见图2。

图2 GSH浓度与2.0×10-4 mol·L-1铜(Ⅱ)在金电极上的还原峰电流的线性关系图
其线性回归方程为y=-0.1321x+3.4262,R=0.9822,检测限为1.0×10-9mol·L-1。
随扫描速度(10 mV·s-1、20 mV·s-1、50 mV·s-1、100 mV·s-1、200 mV·s-1)的加快,2.0×10-4mol·L-1铜(Ⅱ)+7.0×10-4mol·L-1GSH溶液还原峰电流呈线性增加(图3)。表明铜(Ⅱ)在GSH存在下的电化学行为是一个受吸附控制的过程。

图3 2.0×10-4 mol·L-1铜(Ⅱ)+7.0×10-4 mol·L-1 GSH溶液在金电极上的还原峰电流与扫描速度的线性关系图
2.2 GSH对铬(Ⅵ)在金电极上的电化学行为的影响(图4)

1.2.0×10-4 mol·L-1铬(Ⅵ) 2.2.0×10-4 mol·L-1铬(Ⅵ)+1.0×10-11 mol·L-1 GSH
由图4可以看出,2.0×10-4mol·L-1铬(Ⅵ)在约0.25 V处出现了一个还原峰,当加入GSH溶液后,峰电流下降,见表2。
铬(Ⅵ)峰电流与1.0×10-11~7.0×10-11mol·L-1范围内的GSH浓度呈线性相关,见图5。

表2 不同浓度GSH对铬(Ⅵ)在金电极上的峰电流的抑制
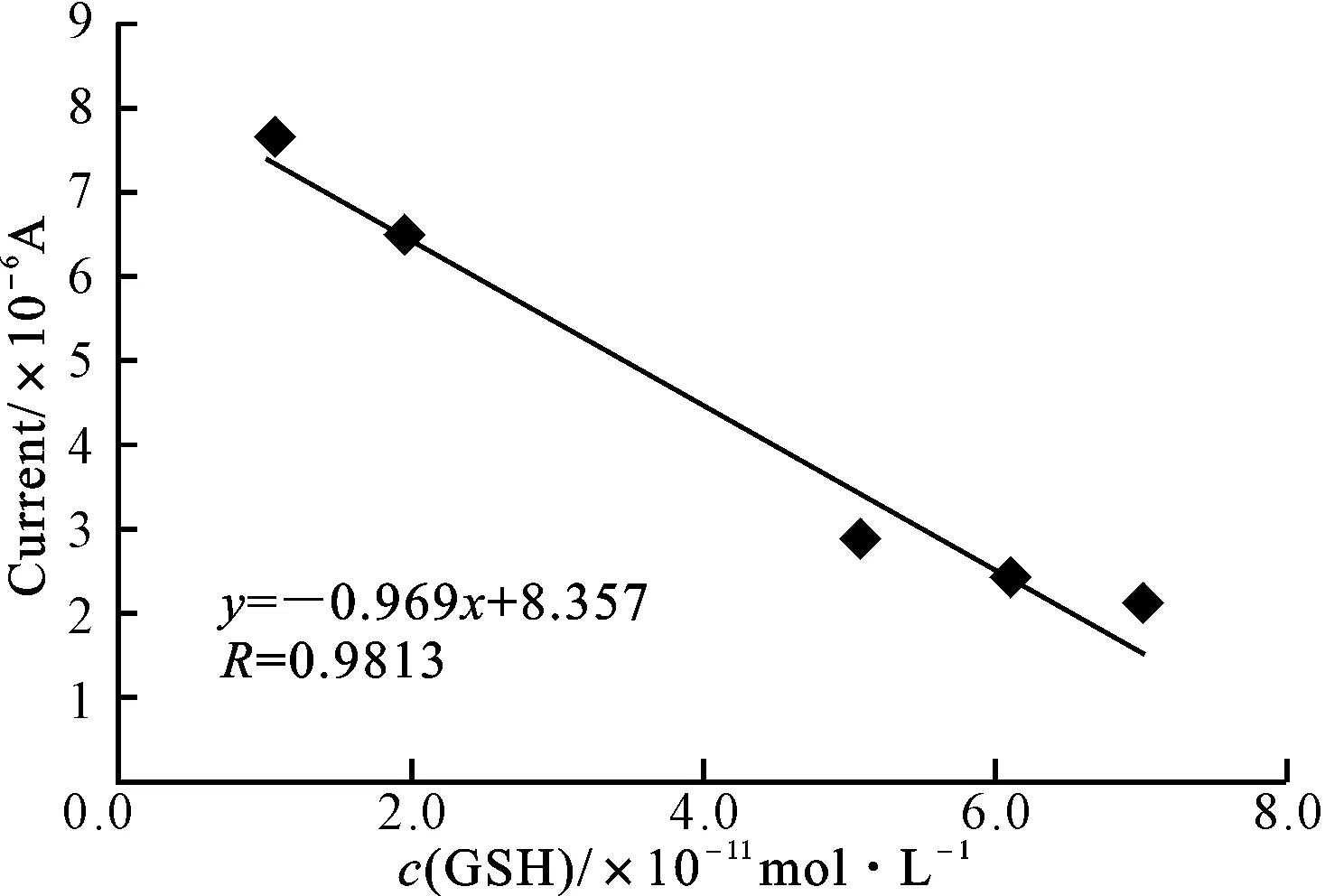
图5 GSH浓度与2.0×10-4 mol·L-1铬(Ⅵ)在金电极上的还原峰电流的线性关系
其线性回归方程为y=-0.969x+8.357,R=0.9813,检测限为1.0×10-11mol·L-1。杨培慧等[11]报道在1.0×10-4mol·L-1的铬(Ⅵ)溶液中加入不同浓度GSH进行CV扫描,GSH检测限为1.0×10-9mol·L-1,线性范围为7.0×10-8~1.0×10-9mol·L-1,线性回归方程为y=-55.063x+5.216,R=0.9526。可见,加大铬(Ⅵ)的浓度,可显著提高GSH的检测限。
随扫描速度(200~1000 mV·s-1)的加快,1.0×10-4mol·L-1铬(Ⅵ)+2.0×10-5mol·L-1GSH溶液还原峰电流呈线性增加(图6)。表明铬(Ⅵ)在GSH存在下的电化学行为是一个受吸附控制的过程,与文献[11]报道结果一致。
3 结论
首次以铜(Ⅱ)的还原峰为信号,建立了GSH的间接检测方法;并通过增大铬(Ⅵ)的浓度,极大地提高了以铬(Ⅵ)的还原峰为信号的GSH间接检测方法的检测限。从而建立了一种灵敏、简便的GSH电化学检测方法。

图6 1.0×10-4 mol·L-1 铬(Ⅵ)+2.0×10-5 mol·L-1 GSH溶液在金电极上的还原峰电流与扫描速度的线性关系
参考文献:
[1] Halliwell B,Gutterridge J M C.In Free Radicals in Biology and Medicine(3rd ed)[M].Oxford:Oxford University Press,1999:163-179.
[2] Murakami K,Kondo T,Ohtsuka Y et al.Impairment of glutathione metabolism in erythrocytes from patients with diabetes mellitus[J].Metabolism,1989,38(8):753-758.
[3] Sprietsma J E.Cysteine,glutathione (GSH) and zinc and copper i-ons together are effective,natural,intracellular inhibitors of (AIDS) viruses[J].Medical Hypotheses,1999,52(6):529-538.
[4] Schulz J B,Lindenau J,Seyfried J,et al.Glutathione,oxidative stress and neurodegeneration[J].European Journal of Biochemistry,2000,267(16):4904-4911.
[5] Tietze F.Enzymic method for quantitative determination of nano-gram amounts of total and oxidized glutathione:Applications to mammalian blood and other tissues[J].Analytical Biochemistry,1969,27(3):502-522.
[6] Griffith O W.Determination of glutathione and glutathione disulfi-de using glutathione reductase and 2-vinylpyridine[J].Analytical Biochemistry,1980,106(1):207-212.
[7] Hissin P J,Hilf R A.A fluorometric method for determination of oxidized and reduced glutathione in tissues[J].Analytical Biochemistry,1976,74(1):214-226.
[8] Velury S,Howell S B.Measurement of plasma thiols after derivatization with monobromobimane[J].Journal of Chromatography,1988,424(1):141-146.
[9] Newton G L,Dorian R,Fahey R C.Analysis of biological thiols:Derivatization with monobromobimane and separation by reverse-phase high-performance liquid chromatography[J].Analytical Biochemistry,1981,114(2):383-387.
[10] Toyo′oka T,Imai K.High-performance liquid chromatography and fluorometric detection of biologically important thiols,derivatized with ammonium 7-fluorobenzo-2-oxa-1,3-diazole-4-sulphonate (SBD-F)[J].Journal of Chromatography,1983,282:495-500.
[11] 杨培慧,赵秋香,蔡继业.铬(Ⅵ)存在下谷胱甘肽的电化学检测[J].中国生化药物杂志,2004, 25(5):273-275.
