吴茱萸次碱的合成、结构表征及体内抗肿瘤作用研究
2010-06-05郭惠,杨云云,余大领等
癌症是威胁人类生命最严重的疾病之一。中药抗肿瘤药物的研究是在20世纪上半叶逐步形成和发展的,在恶性肿瘤引起死亡率呈上升趋势的今天,开发疗效显著、不良反应小的抗肿瘤新药具有重要意义,其中中药抗肿瘤新药具有广阔的前景[1]。
吴茱萸为芸香科植物吴茱萸、石虎或疏毛吴茱萸的干燥近成熟果实。味苦辛、性温热、有小毒,具有散寒止痛、降逆止吐、助阳止泻之功效,用于厥阴头痛、腹脘冷痛、呕吐泄泻、痛经、高血压等症[2]。吴茱萸含有多种生物碱、挥发油、苦味素等化学成分[3,4],其有效活性成分吴茱萸次碱(Rutaecarpine)属于喹唑啉酮咔啉生物碱,具有良好的强心、降压、舒血管、利尿、镇痛、抗炎、降低血小板凝聚、松弛血管平滑肌及肛门括约肌等作用[5~9]。近年来,国内外已有一些吴茱萸次碱抗肿瘤作用的报道[10~12],但是到目前为止,国内外学者的研究焦点主要集中于吴茱萸提取物的抗肿瘤活性,而对吴茱萸的有效单体化合物的合成及抗肿瘤活性研究很少,并且由于从吴茱萸中提取的有效成分含量很低,难于进行深入的研究。
作者以色胺和靛红酸酐为起始原料经三步反应合成吴茱萸次碱,通过元素分析、IR、质谱、1HNMR等对合成的目标化合物进行了表征。并考察了吴茱萸次碱对小鼠移植性肉瘤S180和肝癌H22的作用情况。吴茱萸次碱(化合物Ⅰ)的合成路线如下:

1 实验
1.1 试剂与仪器
色胺(98%),J&K Chemical Ltd.;三氟乙酸酐(99%)、靛红酸酐(98%),New Jersey USA:1-800-ACROS-01;注射用环磷酰胺(Cytoxan,CTX),山西普德药业有限公司;其它常规试剂均为国产分析纯。
WRS-1A型数字熔点仪,上海物理光学仪器厂;Vario EL-Ⅲ型元素分析仪,德国;EQUINOX55型红外光谱仪(KBr压片),德国Bruker公司;VARIAN INOVA 400 MHz型超导核磁共振仪,美国Varian公司;AXIMA-CFRTMplus型基质辅助激光解吸附电离飞行质谱仪,英国克雷斯托公司;Motic AE21型倒置显微镜;100级超净工作室,苏州;离心机,湖南湘仪离心机仪器有限公司。
1.2 实验动物和瘤株
昆明种小鼠[合格证号:SCXK(陕)2007-001],西安交通大学医学院实验动物中心;小鼠S180肉瘤细胞、小鼠H22腹水型肝癌细胞,第四军医大学实验动物中心。
1.3 吴茱萸次碱的合成
1.3.1 化合物Ⅳ的合成
在装有回流冷凝管、温度计、滴液漏斗和磁子的三颈瓶中加入1.63 g(0.01 mol)靛红酸酐(化合物Ⅱ)和20 mL吡啶(干燥),常温下滴加1.5 mL(0.01 mol)三氟乙酸酐和5 mL吡啶的混合溶液。搅拌1 h后,146℃加热回流1.5 h。然后滴加1.6 g(0.01 mol)色胺(化合物Ⅲ)和5 mL吡啶混合溶液,滴加完后回流1.5 h。冷却,倒入50 mL冰水中,静置50 h,析出灰白色沉淀。过滤,用少量氯仿洗涤3次,干燥,得到白色固体2.08 g。m.p.176~178℃(文献[13]值:178~180℃)。
1.3.2 化合物Ⅴ的合成
在装有回流冷凝管、温度计和磁子的三颈瓶中加入1.78 g(0.005 mol)化合物Ⅳ、10 mL乙酸和2 mL盐酸,加热搅拌回流1.5 h。冷却,加入50 mL冰水,静置24 h,析出灰色沉淀。过滤,用少量乙醇洗涤3次,干燥,得到白色粉末状晶体1.3 g。m.p.268~269℃(文献[14]值:270℃)。
1.3.3 吴茱萸次碱的合成
在装有回流冷凝管、温度计和磁子的三颈瓶中加入0.5 g NaOH和3 mL水,搅拌至NaOH溶解后,加入8 mL乙醇,加热搅拌,慢慢加入1.07 g(0.003 mol)化合物Ⅴ,130℃回流1.5 h,冷却,倒入100 mL冰水中,静置48 h,析出灰褐色沉淀。过滤,用10 mL氯仿和甲醇的混合溶剂(1∶1)重结晶,得到浅黄色固体0.62 g。m.p.260~262℃(文献[15]值:258~259℃)。
1.4 抑瘤实验[16,17]
实验动物随机分为5组:阴性对照组(蒸馏水20 mL·kg-1),阳性CTX组(20 mg·kg-1),吴茱萸次碱高、中、低剂量组(20 mg·kg-1、10 mg·kg-1和5 mg·kg-1)。选取移植肿瘤7 d、肿瘤生长良好、腹部膨隆明显的小鼠,在超净工作台内,进行腹部皮肤消毒。用一次性无菌采血器经腹壁刺入腹腔,抽取腹水,放入无菌试管中,从中抽取0.1 mL以生理盐水稀释50倍,用细胞计数板在显微镜下计数,调细胞浓度为1×107个·mL-1。于每只实验小鼠右侧腋部皮下接种0.2 mL。各组动物于接种肿瘤次日随机分组(H22每组10只,S180每组12只)并开始灌胃给药。每日1次,连续给药10 d。给药结束次日,将动物称重后脱颈椎处死,剥离出皮下瘤块,并取出脾脏和胸腺,称重,比较各组间肿瘤质量的差异性。按照下列公式计算抑瘤率、脾脏指数和胸腺指数。

脾脏指数=脾脏平均质量(mg)/小鼠平均质量(g)
胸腺指数=胸腺平均质量(mg)/小鼠平均质量(g)
2 结果与讨论
2.1 元素分析(表1)

表1 中间化合物和吴茱萸次碱的颜色及元素分析
由表1可见,各化合物的元素分析实测值和理论值基本相符。
2.2 红外光谱分析
以KBr为基质,在4000~400 cm-1范围内测定吴茱萸次碱的红外光谱,见图1。

图1 吴茱萸次碱的红外光谱图
由图1可见,吴茱萸次碱在3339 cm-1处出现N-H的伸缩振动吸收峰,在1655 cm-1处出现C=O的特征吸收峰,在1545 cm-1处出现C=N的特征吸收峰,在1598 cm-1、1461 cm-1、731 cm-1出现苯环的特征吸收峰,与文献[18]报道的一致,说明已成功合成目标化合物。
2.3 质谱及核磁共振氢谱分析
吴茱萸次碱的质谱图(CDCl3为溶剂)和1HNMR(CDCl3为溶剂)谱图见图2和3。

图2 吴茱萸次碱的质谱图
由图3可见,吴茱萸次碱的1HNMR图谱中存在6种不同环境的氢,分别归属为:11.87(s,1H,N-H),8.31(d,1H),7.79(t,1H),7.65(d,1H),7.52(d,1H),7.41(t,1H),7.26(t,1H),7.10(t,1H),4.59(t,2H),3.25(t,2H),这与文献[18]报道的一致。且质谱最高强度峰为吴茱萸次碱的分子量,进一步证实已成功合成目标化合物。

图3 吴茱萸次碱的1HNMR谱图
2.4 抗肿瘤活性
2.4.1 吴茱萸次碱对移植S180小鼠的影响(表2)
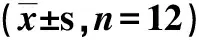
表2 吴茱萸次碱对移植S180小鼠的影响
由表2可见,与阴性对照组比较,吴茱萸次碱高、中、低剂量给药组瘤体质量都有所降低,平均抑瘤率分别为42.83%、41.05%、37.55%。说明吴茱萸次碱对瘤体生长有一定的抑制作用。但吴茱萸次碱给药组的平均抑瘤率低于阳性CTX组,说明吴茱萸次碱对S180移植瘤瘤体生长的抑制作用不如环磷酰胺。阳性CTX组与阴性对照组相比,小鼠的脾脏指数和胸腺指数有所降低,且有统计学意义(P<0.05),表明环磷酰胺有损伤免疫器官的作用。而吴茱萸次碱各给药组能明显增加小鼠脾脏指数(P<0.05),对胸腺指数影响不明显,提示吴茱萸次碱能够保护免疫器官,增强免疫力。
2.4.2 吴茱萸次碱对移植H22小鼠的影响(表3)
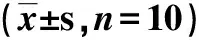
表3 吴茱萸次碱对移植H22小鼠的影响
由表3可见,与阴性对照组比较,吴茱萸次碱高、中、低剂量给药组瘤体质量都有所降低(P<0.05),平均抑瘤率分别为43.83%、43.53%、35.03%。说明吴茱萸次碱对瘤体生长有一定的抑制作用。但吴茱萸次碱给药组的平均抑瘤率低于阳性CTX组,说明吴茱萸次碱对H22移植瘤瘤体生长的抑制作用不如环磷酰胺。而阳性CTX组与阴性对照组相比,小鼠的脾脏指数和胸腺指数有所降低,且有统计学意义(P<0.05),表明环磷酰胺有损伤免疫器官的作用。而吴茱萸次碱作用移植H22小鼠后,脾脏指数略有下降,虽然对免疫器官有损伤,但比环磷酰胺的损伤作用小。
3 结论
吴茱萸是一种药效明确的天然植物,吴茱萸次碱作为其主要活性成分,对小鼠移植性肿瘤S180和H22瘤体生长均具有抑制作用,且它们作用肿瘤小鼠后对脾脏指数和胸腺指数影响较小,甚至有增加作用。因此,吴茱萸次碱是吴茱萸抗肿瘤活性的物质基础,作为抗肿瘤药物具有极大的开发潜力。
参考文献:
[1] 丁健.抗肿瘤药物的研究新进展[J].中国新药杂志,2000,9(3):149-154.
[2] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:118-119.
[3] 唐元清,冯孝章,黄量.吴茱萸化学成分的研究[J].药学学报,1996,31(2):151-155.
[4] 刘蕴秀,罗淑荣.吴茱萸中生物碱成分的研究新进展(1985-1997年)[J].天然产物研究与开发,2000,12(1):87-94.
[5] 戴媛媛,刘保林,窦昌贵.吴茱萸及其有效成分的药理研究进展[J].中药材,2003,26(4):295-297.
[6] 胡长平,李元建.吴茱萸碱和吴茱萸次碱的药理学研究进展[J].中国药理学通报,2003,19(10):1084-1087.
[7] 王翠玲,刘建利,令亚萍.吴茱萸次碱的合成进展[J].有机化学,2006,26(10):1437-1443.
[8] 王承学,楚占芳.吴茱萸次碱和喹唑酮类化合物的合成[J].应用化学,2008,25(12):1439-1443.
[9] Deng P Y,Ye F,Cai W J.Stimulation of calcitonin gene-related peptide synthesis and release:Mechanisms for a novel antihypertensive drug,rutaecarpine[J].J Hypertension,2004,22(9):1819-1829.
[10] Lee S K,Kim N H,Lee J.Induction of cytochrome P450s by rutaecarpine and metabolism of rutaecarpine by cytochrome P450s[J].Planta Med,2004,70(8):753-757.
[11] 曹亚杰,曹伟,余奇,等.吴茱萸次碱在人肝微粒体中对细胞色素P450酶的抑制作用[J].中南药学,2005,3(4):243-245.
[12] 张莹,张起辉,吴立军,等.吴茱萸碱在诱导小鼠纤维肉瘤L929细胞凋亡过程中对细胞周期的阻滞作用[J].中国中西医结合杂志,2004,24(S1):169-172.
[13] Bergman J,Bergman S.Studies of rutaecarpine and related quinazolinocarboline alkaloids[J].J Org Chem,1985,50(8):1246-1247.
[14] Horvath-Dora K,Clauder O.Alkaloids containing the indolo[2,3-c] quinazolino[3,2-a],pyridine skeleton[J].Acta Chim Acad Sci Hun,1975,84(1):93-97.
[15] Mhaske S B,Argade N P.Faeile zeolite induced Fischer-indole synthesis:A new approach to bioactive natural product rutaecarpine[J].Tetrahedron,2004,60(15):3417-3421.
[16] 徐叔云,卞如濂,陈修.药理实验方法学(第二版)[M].北京:人民卫生出版社,1991:1423.
[17] 李仪奎,王钦茂,周金黄.中药药理实验方法学[M].上海:上海科学技术出版社,1991:512.
[18] 王翠玲.色胺酮、吴茱萸次碱等天然产物的生物合成及仿生合成研究[D].西安:西北大学,2007.
