正常和膜迷路积水豚鼠内耳水通道蛋白的表达及意义
2010-06-05韩红蕾张连山顾凤明
韩红蕾 张连山 顾凤明
正常和膜迷路积水豚鼠内耳水通道蛋白的表达及意义
韩红蕾1张连山2顾凤明3
目的 检测正常和膜迷路积水豚鼠内耳水通道蛋白(aquaporins,AQPs)的表达,探讨其机理和意义。方法 20只健康豚鼠随机分为实验组和对照组,每组10只,实验组(膜迷路积水模型组)豚鼠腹腔注射醋酸去氨加压素,4μg·kg-1·d-1,共1周,诱导其内耳膜迷路积水,对照组豚鼠腹腔注射等量生理盐水。用免疫组化方法检测两组豚鼠内耳水通道蛋白的表达,并进行比较。结果 对照组豚鼠内耳中有AQP0、1、2、3、5、7、8的表达,其中AQP0仅在血管纹和螺旋神经节细胞有较弱的表达;AQP1分布于包绕骨迷路、内淋巴囊、内淋巴管的纤维细胞,基底膜鼓阶面细胞、螺旋韧带纤维细胞、螺旋缘纤维细胞、Corti’s器、内外螺旋沟、血管纹、椭圆囊壁、球囊壁、螺旋神经节等;AQP2表达在血管纹、Corti’s器、螺旋神经节细胞和内淋巴囊中;AQP3、7、8三者的分布类似,在螺旋神经节和包绕膜迷路的组织中表达,包括Corti’s器、内外螺旋沟、血管纹、螺旋韧带纤维细胞、螺旋缘、椭圆囊壁、球囊壁、内淋巴囊等;AQP5则表达在Corti’s器、内外螺旋沟、螺旋神经节、螺旋韧带纤维细胞。实验组豚鼠内耳中,血管纹AQP2的表达与对照组较正常豚鼠表达增加,其它亚型AQPs的表达与对照组无明显差异。结论 正常豚鼠内耳中有多种AQPs表达,膜迷路积水后豚鼠内耳中AQP2的表达增强,提示膜迷路积水可能与AQP2表达上调有关。
水通道蛋白; 膜迷路积水; 醋酸去氨加压素; 豚鼠
梅尼埃病的病理基础是膜迷路积水,但其发病机理仍不清楚。水通道蛋白(aquaporins,water channel protein,AQPs)是一种膜通道蛋白家族,负责生物体内多种组织和细胞的水的快速跨膜转运。目前的多种研究表明[1],水通道蛋白对生物体内环境的稳定起着重要的作用,其数量、结构或功能的异常与多种病理和生理异常有关,但水通道蛋白与膜迷路积水之间的关系,目前尚无定论。国内外的相关研究表明,内耳结构中有多种水通道蛋白亚型的表达,可能在膜迷路积水中起着一定的作用[2,3]。为探讨水通道蛋白和膜迷路积水的关系,本研究观察并分析了正常和膜迷路积水豚鼠内耳AQPs的表达及其意义,现报告如下。
1 材料与方法
1.1 实验动物及分组 健康白色红目豚鼠20只购自北京协和医院实验动物中心,雌雄不限,体重200~300 g,活动敏捷,耳廓反射灵敏。将豚鼠随机分为实验组和对照组,每组10只。动物的饲养和管理均符合北京市实验动物管理规定。
1.2 实验试剂及仪器 醋酸去氨加压素(弥柠,Desmin)购自瑞典辉凌(Ferring)制药有限公司,批号为CD6580S,批准文号为X20010203。SP免疫组化试剂盒购自北京中山生物技术有限公司。AQP1、2抗体购自美国Chemicon试剂公司,AQP0、1、3、5、7、8抗体由美国Mayo医学院Chen Xianming博士惠赠。
切片机(德国LEICA RM2145),奥林巴斯生物显微镜(美国BX51),数显调恒温水箱(北京长风仪器仪表公司,浙制0281028),电热恒温鼓风干燥箱(上海一恒科技有限公司DHG-9030A),水浴机(北京市百姓佳商贸有限公司SY-1型)。
1.3 实验方法
1.3.1 造模及取材 实验组每日给予去氨加压素4μg/kg-1·d-1,腹腔注射,共1周,以造成膜迷路积水的模型;对照组每日给予等量生理盐水腹腔注射,共1周。停药1周后,同时处死2组动物,取材。方法如下:将豚鼠全身麻醉后,快速开胸,暴露心脏,自心尖插入注射器针头并固定之,取血1 ml,离心,取血清备用。剪开右心耳,依次用温生理盐水和4%的多聚甲醛快速灌注至豚鼠颈项强直、四肢僵硬,断头,快速打开听泡,取出颞骨,打开前庭窗,在蜗尖和圆窗处各钻一小孔后,将颞骨标本置于4%多聚甲醛中固定。48 h后,将耳蜗标本脱钙,常规石蜡包埋,沿平行于蜗轴的平面切片,每片厚3μm,每隔5片取2片,行免疫组化染色,每个标本取20片。取出豚鼠颞骨后,取其心、肝、肾和肺,用4%多聚甲醛固定,常规石蜡包埋,切片。
1.3.2 血清学检测及HE染色 用间接电极法检测血清中K+、Na+、Ca2+和Cl-的浓度。耳蜗及上述脏器切片常规行HE染色,光学显微镜下观察造模情况。
1.3.3 SP法免疫组化染色 严格按试剂盒说明操作,分别以兔抗大鼠多克隆抗体AQP0、1、2、3、5、7、8检测,其中AQP1、2、3、7均用豚鼠肾脏作为阳性对照,以肾小管上皮细胞胞浆中出现的褐色染色为阳性表现。所有实验均以PBS代替一抗做阴性对照,根据着色深浅判断表达强度。
1.3.4 造模成功即膜迷路积水的评估 正常情况下,耳蜗Reissner膜与前庭膜夹角大约为30°,Reissner膜将基底膜以上空间分为前庭阶和蜗管两部分,蜗管横截面积约为基底膜以上空间的三分之一。膜迷路积水时,Reissner膜向前庭阶方向膨隆,蜗管横截面积增加。本研究将实验动物膜迷路积水的程度粗略地分为三度,轻度:蜗管面积约占前庭阶、蜗管总面积的1/3~1/2;中度:蜗管面积约占前庭阶、蜗管总面积的1/2~2/3;重度:蜗管面积约占前庭阶、蜗管总面积2/3以上。
采用Image-Pro Plus 6.0分析软件系统分别计算横贯豚鼠耳蜗轴的切片的第2、3、4回的蜗管横截面积和蜗管加前庭阶横截面积,计算两者之比并取其平均值作为该平面的蜗管与蜗管加前庭阶的面积比(R),计算同一标本的所有平面的R值并取均值作为这一标本的平均R值,进行统计分析。
1.4 统计学方法 采用SPSS11.5软件包,对数据进行秩和检验,P<0.05为有显著性差异。
2 结果
2.1 血清学结果 实验组和对照组豚鼠血清中K+、Na+、Ca2+、Cl-的浓度差异均无显著统计学意义(表1)。说明醋酸去氨加压素在诱导膜迷路积水的过程中,对豚鼠血清中电解质无明显影响。
表1 两组豚鼠血清中部分电解质的浓度

表1 两组豚鼠血清中部分电解质的浓度
组别Ca2+Cl-K+Na+对照组9.32±1.11 98.34±4.10 6.537±0.42 122.5±8.09实验组9.11±0.94 98.33±4.24 6.523±0.36 127.33±5.15
2.2 膜迷路积水造模结果 两组豚鼠的心、肺、肝和肾组织均无明显充血水肿。对照组豚鼠内耳Re-issner膜平直无膨隆,前庭阶、鼓阶、蜗管和内淋巴囊均无结构异常。实验组中,有6只豚鼠出现膜迷路积水,积水始于耳蜗底回,表现为耳蜗2、3、底回Reissner膜不同程度地膨向前庭阶,部分Reissner膜有破裂;其中有2只豚鼠为轻度膜迷路积水,3只为中度膜迷路积水,1只为重度膜迷路积水(图1)。造模过程中,有2只豚鼠在用药5天后出现行动较缓慢,平衡不稳,停药2天后好转。实验组与对照组的R值也有明显差异(P=0.000<0.05)(表2)。
表2 两组豚鼠耳蜗蜗管、蜗管加前庭阶横截面积(像素数pix)及二者之比(R值

表2 两组豚鼠耳蜗蜗管、蜗管加前庭阶横截面积(像素数pix)及二者之比(R值
注:*与对照组相比较,P<0.05
组别蜗管面积蜗管加前庭阶面积R值对照组130.24±28.55 395.37±97.42 0.33±0.03实验组141.46±31.23 329.83±79.97 0.43±0.09*

图1 :实验组豚鼠耳蜗(HE×100)

图5 对照组豚鼠耳蜗AQP5的表达(SP×200)

图4 对照组豚鼠耳蜗AQP8的表达(SP×200)

图2 对照组耳蜗AQP1的表达(SP×200)

图3 AQP2在对照组耳蜗血管纹的表达(SP×200)
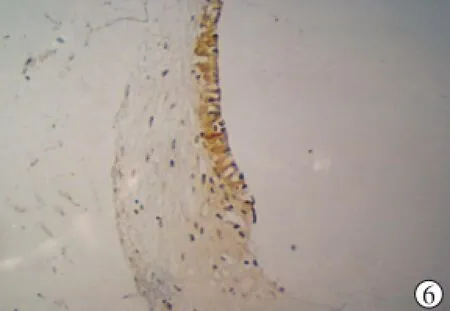
图6 实验组豚鼠血管纹AQP2的表达(SP×200)
2.3 免疫组化结果 对照组豚鼠内耳中,各型AQP均有表达:①AQP0仅在血管纹和螺旋神经节细胞有较弱的表达;②AQP1的分布最广泛,既见于包绕骨迷路的组织,如:骨迷路周围纤维细胞、基底膜鼓阶面细胞、包绕内淋巴囊及内淋巴管的纤维细胞等,也见于包绕膜迷路的组织中,包括Corti器、内外螺旋沟、血管纹、螺旋韧带纤维细胞、螺旋缘、椭圆囊壁、球囊壁等,还见于螺旋神经节细胞、颞骨骨质中的毛细血管等,同时AQP1的表达最强,尤其在与骨质相接触的纤维细胞、血管纹、螺旋神经节细胞(图2);③AQP2表达血管纹、Corti器、螺旋神经节细胞和内淋巴囊中(图3);④AQP3、7、8在Corti器、内外螺旋沟、血管纹、螺旋韧带纤维细胞、螺旋缘、椭圆囊壁、球囊壁、内淋巴囊等以及螺旋神经节细胞中均有表达,其中,在Corti器、内外螺旋沟、血管纹以及螺旋神经节细胞表达较强(图4),同时,AQP3、7在Reissner膜也有较弱表达;⑤AQP5在Corti器、内外螺旋沟、螺旋神经节细胞表达较强(图5),在螺旋韧带纤维细胞表达略弱。实验组豚鼠内耳中AQP0、1、3、5、7、8的表达部位和强度均与对照组相同,AQP2表达的部位也与对照组相同,但在血管纹表达的强度明显增加(着色明显加深)(图6)。
3 讨论
建立膜迷路积水动物模型的方法有多种,如栓塞法、免疫法、毒素法、激素法等。鉴于临床梅尼埃病患者发病时有抗利尿激素(antidiuritic hormone,ADH)升高的表现,国外学者尝试用ADH诱导膜迷路积水,Takeda等[4]通过在豚鼠皮下植入微泵,缓慢持续给予ADH造成豚鼠耳蜗底回、中回甚至顶回的轻中度积水,但皮下植入微泵操作相对复杂。本研究改用腹腔注射的方法,同时为了减少ADH升高血压的作用,采用了ADH的类似物——醋酸去氨加压素。该药品为天然激素——精氨酸加压素的类似物,其结构改良为:把(1)位置上的半胱氨酸脱氨,并以8-D-精氨酸代替8-L-精氨酸,改良后其抗利尿作用更加强大,加压作用减弱。从文中结果看,在实验组豚鼠中60%(6/10)产生了膜迷路积水,而且豚鼠血清中钾、钠、钙、氯浓度没有明显变化,心、脑、肺、肾也没有明显的病理变化,说明醋酸去氨加压素在诱导豚鼠膜迷路积水的同时,对豚鼠的主要脏器和电解质无明显影响,可以作为膜迷路积水动物造模药物选择。
国内外学者陆续研究了动物内耳水通道蛋白的表达。Beitz[2]用RT-PCR的方法,检测了大鼠血管纹、内淋巴囊、Reissner膜、前庭和Corti器的AQP1~5的表达,发现AQP1在上述各组织中均存在,可能是“看家蛋白”,AQP2、3和4见于内淋巴囊,AQP5只表达于Reissner膜和柯替氏器;提示大鼠内淋巴囊中存在细胞水通透系统,该系统可能与肾脏集合管主细胞中的水通透系统类似。黄德亮等[5]通过RT-PCR方法发现AQP1、3、4、7、9在成年小鼠的耳蜗、前庭和内淋巴囊,均有较强表达,AQP5则只在耳蜗和内淋巴囊中有较弱表达,未见AQP2表达;斑点杂交表明成年小鼠内耳中AQPs的含量多少依次为:AQP4>AQP1>AQP3>AQP5,提示可能各亚型水通道蛋白在内淋巴的循环和稳定中起着各自的作用,他们相互协调,共同维持内耳内环境的稳定。近几年研究表明,人类的内耳中,也存在不同类型AQPs的表达[6,7],从而提出了将AQP作为治疗梅尼埃病的新靶点的观点[8]。
在本研究前期工作中,已经发现豚鼠内耳中有AQPs各亚型的表达[9],本研究再次证实了该结论。在以往的研究中,发现醋酸去氨加压素腹腔注射可以诱导豚鼠内耳膜迷路积水[10],ADH可以使大鼠内耳AQP2的表达增加,AQP7的表达减少[11]。本研究发现,醋酸去氨加压素在诱导豚鼠膜迷路积水的同时,也使豚鼠内耳血管纹AQP2的表达增加。可能由于醋酸去氨加压素是ADH的类似物,可以诱导内耳AQP2的表达增加,而AQP2的增加使得内淋巴的生成增多,造成了膜迷路积水。但AQP7的表达无明显变化,分析可能原因如下:①醋酸去氨加压素是ADH的类似物,其作用与ADH不完全等同;②大鼠和豚鼠可能存在种属的差异;③本研究采用的是免疫组化的方法,虽然定位准确,但不能精确定量。
AQP1是持续活化型水通道蛋白,不受ADH的调节。在AQP1的持续作用下,肾近曲小管的管腔面对水的通透性很大(Pf>1 200μm/s)。大约20%的肾小球滤过的原尿不能在近曲小管吸收,但在加压素的调节下,可以被集合管重新吸收。集合管主细胞至少有3种AQP,AQP2存在于主细胞管腔膜及其下的胞浆囊泡中,受ADH调节。AQP3和AQP4仅见于主细胞管周膜,为持续活化型[1]。在基础状态下,集合管主细胞管腔面仅存在少量AQP2,细胞膜对水的通透性较低。在加压素的刺激下,AQP2从管腔面下层的胞浆中通过穿梭机制到达管腔细胞膜表面,通过胞饮作用,将大量水摄入胞浆,再通过管周膜上的AQP3或AQP4,将水运送到细胞间质,经直小血管回到血循环。ADH水平下降时,ADH与受体分离,上述过程逆向进行,管腔面的AQP2减少,主细胞的细胞膜通透性下降,水分吸收减少。普遍认为,内耳与肾脏有相似的解剖结构,因而可能有类似的水、电解质调节机制。本研究结果中,AQP1广泛分布于内耳,表达较稳定,而AQP2则分布于内耳的部分结构中,如血管纹等,并在醋酸去氨加压素作用下表达增加,这从一定程度上证实内耳的水代谢与肾脏中的水代谢有类似之处。由此推论,醋酸去氨加压素诱导的膜迷路积水,可能是由于AQP2表达的增加引发了一系列的反应,使内淋巴产生增多所致,其具体的发病机理仍需要进一步研究。
1 Lee MD,King LS,Ager P.The aquaporin family of water channel proteins in clinical medicine[J].Medicine,1997,76:141.
2 Beitz E,Kμmagami H,Krippeit-Drews P,et al.Expression pattern of aquaporin water channels in the inner ear of the rat[J].Hearing Research,1999,132:76.
3 Huang DL,Chen P,Chen SP,et al.Expression patterns of aquaporins in the inner ear:Evidence for concerted actions of multiple types of aquaporins to facilitate water transport in the cochlea[J].Hearing Research,2002,165:85.
4 Takeda T,Takeda S,Kitano H,et al.Endolymphatic hydrops induced by chronic administration of vasopressin[J].Hearing Research,2000,140:1.
5 黄德亮.小鼠内耳水通道蛋白的定位和意义[J].中华耳鼻咽喉科杂志,2001,26:7.
6 Taguchi D,Takeda T,Kakigi A,et al.Expressions of aquaporin-2,vessopressin type-2 receptor,transient receptor potential channel vanilloid1(TRPV),TRPV4 in the human endolymphatic sac[J].Laryngoscope,2007,117:695.
7 Lopez IA,Ishiyama G,Lee M,et al.Immunohistochemical localization of aquaporins in the human inner ear[J].Cell Tissue Research,2007,328:453.
8 Takeda T,Taguchi D.Aquaporin as potential drug targets for Meniere’s disease and its releated disease[J].Handb Exp Pharmacol,2009,190:171.
9 韩红蕾,张连山,顾凤明.正常豚鼠内耳水通道蛋白的表达及意义[J].临床耳鼻咽喉科学杂志,2005,19:883.
10 韩红蕾,张连山.醋酸去氨加压素诱导豚鼠膜迷路积水[J].中国听力语言康复科学杂志,2007,1:14.
11 Gu FM,Han HL,Zhang LS.Effect of vasopressin on gene expression in rat inner ear[J].Hearing Research,2006,222:70.
(2009-08-03收稿)
(本文编辑 周涛)
Expression of Aquaporins in the Inner Ear of NormaIGuinea Pigs and Guinea Pigs with EndoIymphatic Hydrops
Han HongIei*,Zhang Lianshan,Gu Fengming(*Department of OtoIaryngoIogy of China-Japan Friendship HospitaI,Beijing,100029,China)
Objective To study the expression of aquaporins(AQPs)in the inner ear of normal guinea pig and guinea pigs with endolymphatic hydrops,and to investigate the mechanism and significance.Methods The guinea pigs were divided into two groups randomly:model group and control group.The guinea pigs in model group were given desmopressing 4μg·kg-1·d-1introperitoneally for 1 week,while the guinea pigs in control group were given saline.After one week,the expression of AQPs in the inner ears of all guinea pigs was evaluated.ResuIts Expression of AQP0,1,2,3,5,7 and 8 were found in the ears of normal guinea pigs.Weak expression of AQP0 was found in stria vascularis and spiral ganglion.The distribution of AQP1 consisted of cellular lining the bony labyrinth,fibrocytes lining in the endolymphatic duct and sac,cells under the basilar membrane,fibrocytes of the spiral ligament and the spiral limbus,Corti's organ,inner and outer spiral sulcus,stria vascularis,saccular and utricular wall,and spiral ganglion.AQP2 were found in stria vascularis,Corti's organ,spiral ganglion and endolymphatic sac.AQP3,7 and 8 were distributed in a similar manner as the surrounding membranous labyrinth,including Corti's organ,inner and outer spiral sulcus,stria vascularis,fibrocytes of the spiral ligament and the spiral limbus,saccular and utricular wall,endolymphatic sac and spiral ganglion.AQP5 was found at Corti's organ,inner and outer spiral sulcus,spiral ganglion and fibrocytes in spiral ligment.The AQP2 in stria vascularis and endolymphatic sac was stronger in the inner ears with ELH than that in normal ears.ConcIusion There are various AQPs in inner ears of normal guinea pigs,and their distributions are overlapping and without obvious regional specificity.Desmopressing induces the expression of AQP2 in the inner ears of guinea pigs.The results indicate that ELH maycorrelate toupregulation of AQP2,but the mechanism remains unclear.
Aquaporins; Endolymphatic hydrops; Desmopressin; Guineapigs
10.3969/j.issn.1006-7299.2010.04.015
R764.5
A
1006-7299(2010)04-0363-04
1 卫生部中日友好医院耳鼻咽喉科(北京 100029); 2 北京协和医院耳鼻咽喉科; 3 复旦大学附属眼耳鼻喉医院
韩红蕾,女,山东人,副主任医师,研究方向:耳科学基础与临床。
