凝血酶活化的富血小板血浆促进人骨髓间充质干细胞增殖
2010-06-05具星爱郭子宽靳继德李占全
具星爱 郭子宽 靳继德 李占全
凝血酶活化的富血小板血浆促进人骨髓间充质干细胞增殖
具星爱 郭子宽 靳继德 李占全
目的探索凝血酶活化的富血小板血浆(Thrombin-activated platelet-rich plasma,tPRP)替代牛血清,进行人骨髓间充质干细胞(Mesenchymal stme cells,MSC)分离及培养扩增的可行性。方法分别用MTT法和羧基荧光素二醋酸盐琥珀酰亚胺酯标记细胞技术,观察人骨髓MSC在含有tPRP和胎牛血清培养体系中的增殖状态;利用流式细胞学技术检测细胞表面表型;细胞化学染色法分析不同培养体系所获细胞的成骨及成脂细胞分化能力。结果tPRP培养的人骨髓MSC呈典型的成纤维细胞样形态,且tPRP促MSC增殖能力优于筛选后的胎牛血清。tPRP培养的MSC均表达CD29、CD73、CD166和HLA-ABC,而不表达CD31、CD34、CD45和HLA-DR。体外分化实验显示,利用tPRP培养的MSC具有体外成骨和成脂能力。结论tPRP可以替代胎牛血清,用于人骨髓MSC的培养。
凝血酶富血小板血浆骨髓间充质干细胞
近年来,基于骨髓间充质干细胞(Mesenchymal stem cells,MSC)的细胞治疗和组织工程,已成为医学领域乃至整个生命科学领域中的研究热点和前沿。但是,国内外临床级别MSC的体外扩增体系,多使用经过筛选的胎牛血清。胎牛血清成分不明确,其中可能含有动物携带的已知或未知的病原体;将这种体系应用于临床试验,增加了人畜共患病传播和异种免疫反应的风险。为了优化MSC培养体系,我们制备凝血酶活化的富血小板血浆上清(Thrombin-activated platelet-rich plasma,tPRP),用于人骨髓MSC的培养扩增,探讨以其替代胎牛血清的可能性。
1 材料与方法
1.1 tPRP的制备
富血小板血浆由全军采供血中心制备。每1 mL富血小板血浆加入1 U人凝血酶(Sigma公司)活化;1 500 g离心15 min后留取上清,即为tPRP。加入肝素钠500 U/mL,以避免形成凝胶。分装冻存于-80℃冰箱备用。
1.2 人骨髓间充质干细胞的分离培养
取肝素抗凝的正常人骨髓5 mL,用1 mL注射器过滤后,加入PBS以1∶1比例稀释骨髓,充分混匀,计数后调整有核细胞浓度为1×107cells/mL,按照1∶1比例将骨髓细胞悬液加于Ficoll细胞分离液(1.077 g/mL)液面之上,1 500 r/min离心20 min;吸出单个核细胞层,用PBS稀释,1 500 r/min离心8 min,收获单个核细胞。以α-MEM重悬细胞,将培养体系分成3组,分别加入2%tPRP、5%tPRP、10%筛选FCS(Stem Cell Co),计数后按2×105cells/cm2的密度分瓶培养。72 h后换液,去除未贴壁细胞。以后3 d换1次液。原代培养第4天,可见分裂中的纺锤形的贴壁细胞;第6天,可见明显细胞克隆形成;第10天,可见细胞呈漩涡状生长,达80%融合。此时,以0.05%胰蛋白酶消化传代,按6 000 cells/cm2接种于新培养瓶,记为第1代。第3代细胞用于本实验研究。重复上述细胞传代的操作即可实现细胞的有效扩增。
1.3 细胞增殖能力测定
将第3代细胞以1.5×103个/孔接种于平底96孔板内,每孔200 μL的不同培养体系,每组3孔。将培养板移入CO2培养箱中,在37℃、5%CO2、饱和湿度条件下培养72 h。每孔加入5 mg/mL MTT溶液20 μL,37℃继续孵育4 h。之后,每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫检测仪上测定光吸收值,记录结果。
1.4 羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)细胞增殖能力检测
0.05 %胰蛋白酶消化细胞,磷酸盐缓冲液重悬,调整细胞浓度为1×106cells/mL,加入CFSE 5 μmol/L,37℃避光孵育15 min。4℃磷酸盐缓冲液离心洗涤2次,用α-MEM重悬细胞并分别加入2%tPRP、5% tPRP和10%筛选FCS培养。培养72 h后,收集细胞,FACS Calibur收集数据,WinMDI 2.9软件分析荧光强度。
1.5 细胞表型的流式分析
将第3代处于对数生长期的培养细胞,以0.05%胰蛋白酶消化并计数,分别取2×105个细胞与鼠抗人CD29、CD31、CD34、CD45、CD73、CD166、HLA-ABC和HLA-DR单克隆抗体(Becton-Dickinson公司)避光、室温反应30 min,用冰冷的PBS+1%BSA彻底洗涤细胞2遍,用FCM缓冲液(含1%多聚甲醛+0.1%叠氮化钠+0.5%BSA的PBS液)固定细胞。FACS Calibur流式细胞仪收集数据,WinMDI 2.9软件分析结果。
1.6 成骨分化诱导及检测
将处于对数生长期的培养细胞,接种于24孔细胞培养板(1.0×104个/孔),非诱导组继续用完全培养基培养,诱导组培养液中加入标准诱导剂(Dex 100 nM+β-GP 10 mM+AsAP 0.05 mM)进行成骨分化诱导,每3天换液,第14天应用碱性磷酸酶组化染色试剂盒进行碱性磷酸酶(ALP)染色。
1.7 成脂分化诱导及检测
将处于对数生长期的培养细胞,接种于24孔细胞培养板(1.5×104个/孔),非诱导组继续用完全培养基培养,诱导组培养液中加入标准诱导剂(Dex 1 μM+IBMX 0.5 mM+吲哚美辛100 μM)进行成脂分化诱导,每3天换液,第8天进行油红O染色。
1.8 统计学分析
数据以均数±标准差(x±s)表示,采用SPSS 13.0统计软件进行t检验,P<0.05为具有统计学差异。
2 结果
2.1 细胞形态学观察
骨髓分离的单个核细胞,分别用2%tPRP,5% tPRP与10%FCS接种72 h后镜下观察,可见散在分布的贴壁的纺锤形细胞,经两次全量换液后可基本去除非贴壁细胞。培养7~10 d,细胞克隆增大,接近80%融合。传代的MSC形态均一,呈成纤维细胞样,排列紧密,生长旺盛,融合密度可达2.0×104cells/cm2(图1)。

图1 tPRP培养的人骨髓MSC的典型形态(100×)(左:72 h;右:1周)
2.2MTT法与CFSE细胞增殖实验评价
将2%tPRP、5%tPRP与10%FCS体系培养的MSC,以MTT法比较72 h的细胞增殖状况。发现tPRP对MSC的促增殖作用优于10%FCS(P<0.05),而2%tPRP与5%tPRP之间无差异(P>0.05)。利用CFSE细胞标记技术,实验结果表明,tPRP促MSC增殖效果优于10%FCS(图2)。

图2 不同体系培养的MSC的增殖能力比较
2.3 MSC细胞表型的流式分析
收获第5代不同体系培养的MSC,流式细胞仪分析细胞免疫表型,发现细胞均一表达CD29、CD73、CD105和CD166,阳性率均在95%以上;不表达内皮细胞标志CD31及造血细胞标志CD34和CD45;表达HLA-ABC,但不表达HLA-DR。该结果表明,所培养细胞无造血细胞、内皮细胞的混杂,具有典型的间充质干细胞表型特征(图3)。

图3 tPRP培养的人MSC表型特点(纵坐标:细胞数;横坐标:相对荧光强度)
2.4 成骨与成脂定向诱导分化与鉴定
成骨分化定向诱导培养后1周,部分细胞基质出现结节样钙沉积。培养2周之后,按碱性磷酸酶检测试剂盒操作步骤进行碱性磷酸酶染色。染色后,碱性磷酸酶在胞浆内显示为蓝色颗粒状物,对照组细胞未加诱导剂,碱性磷酸酶染色呈阴性。成脂分化定向诱导培养后1周时,少数细胞内就出现微小明亮的脂滴。随着诱导时间的延长,出现脂滴的细胞增多,细胞由梭形变成椭圆形或角形。培养2周后,脂滴数目增多、融合。油红O染色后镜下观察,细胞内脂滴呈明亮橙红色,非诱导组呈阴性(图4)。
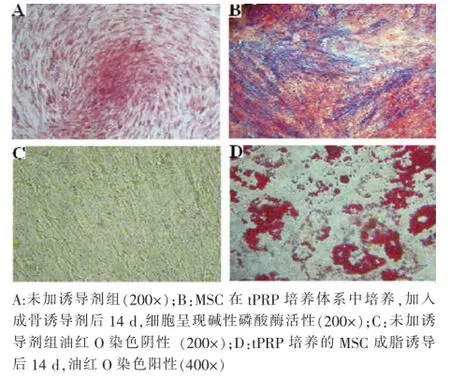
图4 tPRP培养的MSC体外分化能力分析
3 讨论
MSC在细胞替代治疗和基因治疗中具有重要的临床应用价值。将体外扩增的MSC移植至组织损伤部位后,通过两种功能发挥促进组织再生作用:①在局部微环境作用下,可定向分化为某一特定类型功能细胞,直接参与组织损伤修复过程;②可分泌多种生物活性物质,包括细胞因子和细胞生长因子等,以改善组织损伤部位的再生微环境。这些作用具体表现为:①趋化周围的宿主干/祖细胞迁徙至损伤部位;②促进干祖细胞的增殖分化;③抑制受损伤细胞的凋亡;④促进毛细血管发芽,加速血管新生;⑤激活周围细胞金属硫蛋白酶活性,抑制瘢痕形成;⑥调节免疫细胞功能,抑制炎性反应[1-5]。然而,由于直接从体内获取的MSC数量很少,无法满足临床治疗要求,需要在较短时间内扩增至足量的细胞数目。因此,对于MSC培养支持物,除了要获得符合标准的细胞,还需要良好的扩增效率,这是至关重要的[6]。
富血小板血浆含有多种生长因子,包括血小板衍生生长因子(PDGF)、转移生长因子-β1和β2(TGF-β1、β2)、血管内皮生长因子(VEGF)、血小板衍生内皮细胞生长因子,白介素-1(IL-1)、表皮生长因子(EGF)、成纤维细胞生长因子和血小板激活因子等[7]。但是,血小板作用的发挥有赖于其浓缩血小板被激活后α颗粒释放各类生长因子及纤维蛋白原所形成的纤维网状支架。人的凝血酶Thrombin,可以模仿生理状态下激活,使α颗粒释放出高浓度的生长因子,以及形成血小板微粒,促进细胞有丝分裂[8-10]。富血小板血浆中含有血小板膜等聚合物,可能抑制MSC的黏附及扩增;而且,与血小板膜联合的血小板抗原可引起免疫反应[11]。因此,我们制备tPRP时,以离心方法来除去膜成分,以避免上述问题,提高其实用性。
用富血小板血浆上清扩增的MSC,保留了固有的体外成骨和成脂肪能力,可用于组织工程的临床和实验研究。
[1]王恒湘,郭子宽.间充质干细胞在组织再生应用中的诸多问题[J].组织工程与重建外科杂志,2008,4(5):241-245.
[2]Caplan AI.Adult mesenchymal stem cells for tissue engineering versus regenerative medicine[J].J Cell Physiol,2007,213:341-347.
[3]Dasari VR,Spomar DG,Cady C,et al.Mesenchymal stem cells from rat bone marrow downregulate caspase-3-mediated apoptotic pathway after spinal cord injury in rats[J].Neurochem Res,2007, 32(12):2080-2093.
[4]Abdi R,Fiorina C,Adra N,et al.Immunomodulation by mesenchymal stem cells:a potential therapeutic strategy for type I diabetes[J]. Diabetes,2008,57:1759-1767.
[5]Humphreys BD,Bonventre JV.Mesenchymal stem cells in acute kidney injury[J].Annu Rev Med,2008,59:311-325.
[6]楼晓,汪劲松,靳继德,等.血小板裂解物支持人骨髓基质细胞的扩增[J].组织工程与重建外科杂志,2009,5(2):61-64.
[7]Yol S,Tekin A,Kucukkartallar T,et al.Effects of platelet rich plasma on colonic anastomosis[J].J Sur Res,2008,146:190-194.
[8]Marx RE.Platelet-rich plasma:Evidence to support its use[J].J Oral Maxillofac Surg,2004,62:489-496.
[9]Barry OP,FitzGerald GA.Mechanisms of cellular activation by platelet microparticles[J].Thromb Haemost,1999,82:794-800.
[10]Gruber R,Varga F,Fischer MB,et al.Platelets stimulate proliferation of bone cells:involvement of platelet-derived growth factor, microparticlesand membranes[J].Clin Oral Implants Res,2002, 13:529-535.
[11]Santoso S.Human platelet alloantigens:heterogeneity of platelet alloantibodies[J].Transfus Apher Sci,2003,28:227-236.
Thrombin-Activated Platelet-Rich Plasma Promotes the Proliferation of Human Marrow Mesenchymal Stem Cells
JU Xingai1,GUO ZiKuan2,JIN Jide2,LI Zhanquan1.1 Shengjing Hospital of China Medical University,Shengyang 110016, China;2 Department of Experimental Hematology,Beijing Institute of Radiation Medicine,Beijing 100850.Corresponding author:LI Zhanquan.
ObjectiveTo investigate whether the supernatants of thrombin-activated platelet-rich plasma could be used as a substitute for the isolation and culture-expansion of human mesenchymal stem cells.MethodsHuman marrow mesenchymal stem cells(MSC)were cultured in media containing the supernatants of thrombin-activated platelet-rich plasma (tPRP)and fecal calf sera(FCS)selected from lots.Their proliferation status was evaluated by MTT and carboxyfluorescence diacetatesuccinimidyl ester-labeling assays.Furthermore,the phenotypic characteristics were analyzed by flow cytometry and the differentiations along adipogenic and osteogenic pathways were assessed by histological staining.ResultsMSC cultured in medium containing tPRP displayed a typical fibroblast-like morphology and,compared with(FCS),tPRP exhibited more potent activities to support the expansion of MSC.Flow cytometry showed that they were homogenously positive for CD29, CD73,CD166 and HLA-ABC and negative for CD31,CD34,CD45 and HLA-DR.Differentiation assays showed that of MSC cultured with tPRP occupied the capacities of in vitro osteogenesis and adipogenesis.ConclusionIt is concluded that human tPRP might be an optional substitute to FCS for MSC proliferation.
Thrombin;Platelet-rich plasma;Mesenchymal stem cells
Q813.1+1
A
1673-0364(2010)01-0014-04
2009年10月26日;
2010年1月9日)
10.3969/j.issn.1673-0364.2010.01.004
科技重大专项项目(2009zx09503-019),国家高技术发展项目(863项目)(2007AA02z454),国家自然科学基金项目(30873018和30971068)。
110016辽宁省沈阳市中国医科大学附属盛京医院(具星爱,李占全);100850北京市军事医学科学院放射与辐射医学研究所实验血液学研究室(郭子宽,靳继德)。
李占全。
