氨基酸对大肠杆菌BL21产嘌呤核苷磷酸化酶的影响
2010-06-04张卫兰,陶国庆,刘刚等

在高密度培养重组大肠杆菌以高表达PNPase的工艺中,氮源对发酵有着重要的影响。有机氮源中存在着非常丰富的氨基酸。目前,国内外已有很多报道各种氨基酸对重组大肠杆菌高效表达目的蛋白的影响。作者在此采用单因素方差分析和粗糙集分析,考察了氨基酸对大肠杆菌BL21产PNPase的影响。
1 实验
1.1 菌种
E.coliBL21/pET28a-PNP,卡那霉素抗性,PNP来源于产气肠杆菌,自行构建。
1.2 培养基
种子培养基(LB):蛋白胨10 g·L-1,酵母粉5 g·L-1,NaCl 10 g·L-1。
M9基础培养基:Na2HPO4·12H2O 12.8 g·L-1,KH2PO43 g·L-1,NaCl 0.5 g·L-1,NH4Cl 1 g·L-1,MgSO40.002 mol·L-1,葡萄糖0.5%,CaCl20.0001 mol·L-1。
合成培养基:M9基础培养基+不同浓度的各种游离氨基酸。
复合培养基:Na2HPO4·12H2O 14.26 g·L-1,KH2PO42 g·L-1,NaCl 7 g·L-1,蛋白胨12 g·L-1,酵母粉 6 g·L-1,MgSO4·7H2O 1 g·L-1,CaCl20.05 g·L-1,甘油 15 g·L-1。
以上培养基在接种前加入终浓度为30 μg·L-1的卡那霉素。
1.3 培养方法
种子培养:从斜面上切适当大小的菌体琼脂块接种到已经加入卡那霉素的LB培养基中,37℃、200 r·min-1振荡培养12 h。
摇瓶发酵培养:以5%的接种量于发酵培养基中培养4 h后,加入终浓度为0.5 mmol·L-1的IPTG诱导3 h,发酵结束,得发酵液。
1.4 分析方法
1.4.1OD600的测定
将发酵液稀释适当倍数,用752-C型分光光度计在600 nm测其光吸收值。
1.4.2 PNPase酶活的测定
取20 μL浓度为100 g·L-1的菌液,放入200 μL含3 μmol肌苷的磷酸钠缓冲溶液中,于37℃、 pH值7.0条件下反应1 h,100℃煮沸5 min使酶灭活,13 000 r·min-1离心2 min,取上清稀释10倍,用高效液相色谱测定次黄嘌呤的含量[3]。高效液相色谱条件为:流动相10%甲醇,C18柱,柱温40℃,检测波长254 nm。以每毫升发酵液每分钟转化生成 1 μmol次黄嘌呤的量为1个酶活力单位(U)。
1.5 数据分析
用统计软件SPSS 11.5对数据进行分析。
2 结果与讨论
2.1 合成培养基中氨基酸对PNPase总酶活的影响
2.1.1 合成培养基中氨基酸浓度的确定
微生物的氮的同化代谢中,转氨的供体来自谷氨酸(Glu)与谷氨酰胺(Gln)[4],所以在合成培养基中采用谷氨酰胺来确定氨基酸添加的浓度。添加不同浓度谷氨酰胺,得到的PNPase总酶活见表1。

表1 添加不同浓度Gln的总酶活
由表1可知,随着Gln浓度的增加,总酶活相应上升。当Gln浓度为0.2 g·L-1时,总酶活为20.3 U·mL-1。由于此酶活升高与降低均有较大空间,故采用0.2 g·L-1作为各种氨基酸添加的最终浓度。
2.1.2 合成培养基中各种氨基酸对总酶活的影响[5]
在M9基础培养基内分别添加终浓度为0.2 g·L-1的14种氨基酸,重复3次,空白对照不添加氨基酸,各氨基酸对应的总酶活如表2所示。
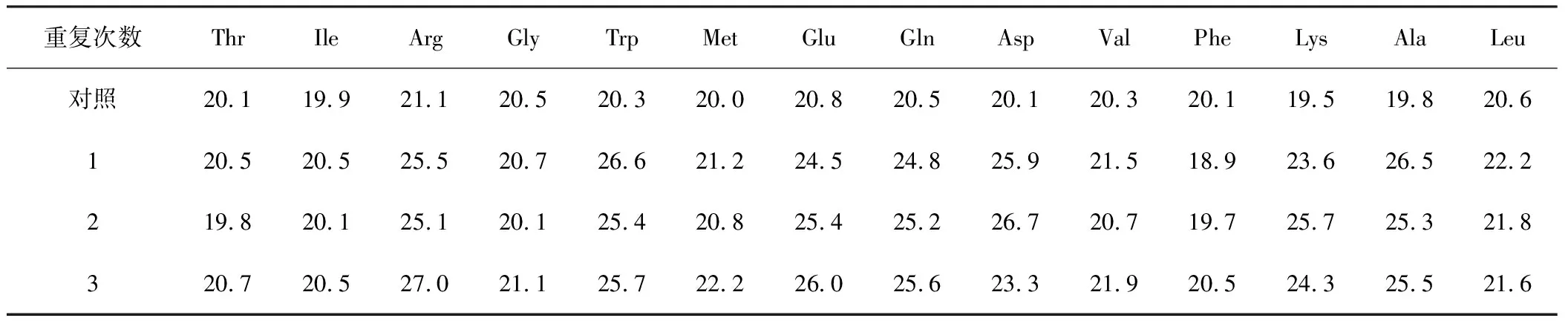
表2 合成培养基中不同氨基酸对应的总酶活/U·mL-1
采用SPSS 11.5软件对表2中各氨基酸的浓度进行聚类分析,然后将聚类后的结果与各氨基酸对应的总酶活进行单因素方差分析(One-way ANOVA),结果见表3。
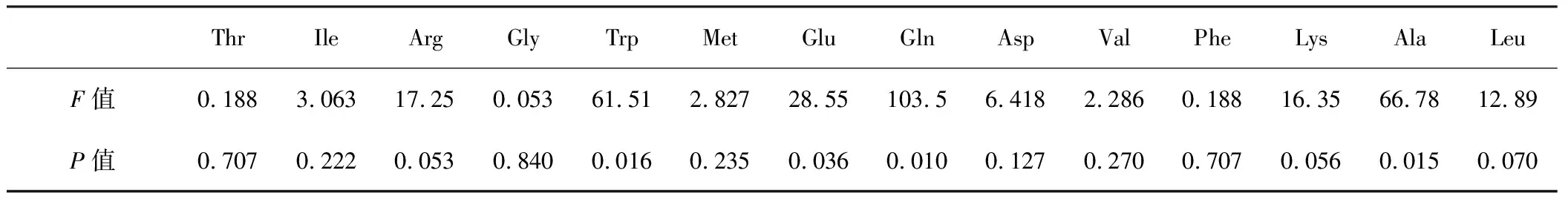
表3 单因素方差分析结果
由表3可知,PTrp=0.016、PGlu=0.036、PAla=0.015、PGln=0.010,均小于0.05,故在合成培养基中,Trp、Glu、Ala、Gln可能在重组大肠杆菌高密度高表达PNPase的过程中起关键性作用,Glu与Gln是微生物的氮的同化代谢中转氨的供体;Ala分解代谢途径较为广泛;Trp在分解代谢中能够生成非常丰富的碳架复合物[6],所以添加这几种氨基酸可能对于高效表达PNPase起着很重要的作用。
2.2 复合培养基中氨基酸对PNPase总酶活的影响
2.2.1 复合培养基中氨基酸浓度的确定及对总酶活的影响
固定总氮含量,设计了14种不同氨基酸含量的有机氮源培养基。采用凯氏定氮法测定不同厂家生产的蛋白胨、酵母粉的总氮含量,采用日立氨基酸自动分析仪测定各原料中各种氨基酸的浓度。由于采用酸水解法水解样本,因此最终不能检测出样本中Gln的浓度。除Gln外,复合培养基中其余13种氨基酸的浓度及其所对应的总酶活如表4所示。

表4 复合培养基中不同氨基酸浓度及对应的总酶活
2.2.2 氨基酸聚类分析及粗糙集分析
运用SPSS 11.5软件中的K-Means聚类分析法对表4数据按照数值大小进行分类,结果如表5所示。
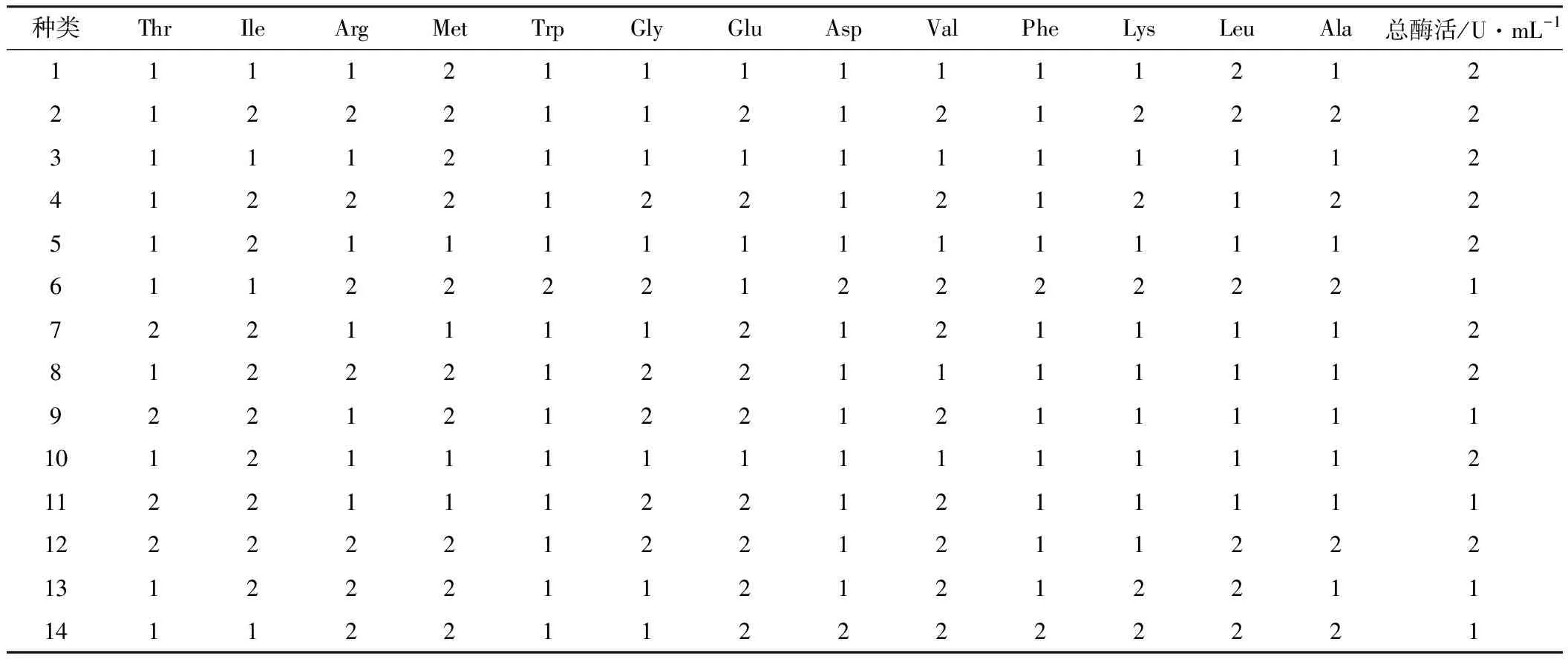
表5 各氨基酸及对应总酶活的聚类分析结果
由表5可知,粗糙集分析[7]得到Gly和Ala为核属性,即在复合培养基中,这两种氨基酸可能在大肠杆菌产PNPase的发酵过程中起着关键作用。
2.2.3 Gly和Ala对总酶活的影响
复配一种Gly和Ala含量相对都较低而其它氨基酸含量相对较高的复合氮源,然后分别添加不同浓度的Gly或Ala来确证两种氨基酸对总酶活的影响,结果如表6所示。
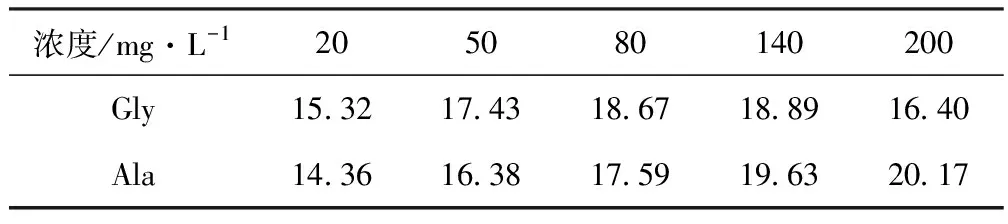
表6 添加不同浓度的Gly或Ala的总酶活/U·mL-1
从表6可以看出,Gly和Ala均对酶活有促进作用。当Gly浓度在80~140 mg·L-1时的总酶活较高,而Ala浓度为140~200 mg·L-1时的总酶活较高。因此同时添加两种氨基酸,两者的终浓度均为140 mg·L-1,对应总酶活为28 U·mL-1,比单独添加两种氨基酸的总酶活均有明显提高,说明Gly和Ala对酶活的影响存在交互作用。
2.3 验证实验
根据实验结果,设计了一种各种氨基酸含量均较低的复合培养基,通过单独添加Trp、Ala、Glu、Gln、Gly(终浓度均为0.2 g·L-1)或同时添加Ala、Gly(终浓度均为0.14 g·L-1),考察氨基酸对总酶活的影响,结果如图1所示。

图1 添加各种氨基酸与对照组的总酶活
从图1可以看出,和对照组相比,在复合培养基中单独添加Glu、Trp,总酶活没有提高;单独添加Gln、Ala、Gly,总酶活略有提高;共同添加Ala和Gly能明显提高总酶活。由此说明Ala和Gly能够共同促进PNPase在大肠杆菌BL21内大量表达,在PNPase的发酵生产中起着关键性作用。这可能是由于产气肠杆菌中PNPase的氨基酸序列中Ala和Gly的含量较高[8],在各种氨基酸都有一定含量的复合培养基中, 添加Ala和Gly能够促进PNPase的高效表达。同时也反映单因素方差分析得到合成培养基中的关键性氨基酸不能成为复合培养基中重组大肠杆菌高密度高表达PNPase的关键性氨基酸,但合成培养基的单独添加氨基酸的实验方法可能适合于PNPase的高效表达的机制研究。
3 结论
采用单因素方差分析,考察了合成培养基中各种氨基酸对大肠杆菌BL21产嘌呤核苷磷酸化酶总酶活的影响;同时采用聚类分析和粗糙集分析,考察了复合培养基中氨基酸对大肠杆菌BL21产嘌呤核苷磷酸化酶总酶活的影响。结果表明,在合成培养基和复合培养基中对总酶活影响显著的是不同的氨基酸。在复合培养基中,丙氨酸和甘氨酸对产酶有明显促进作用且存在交互作用,两者浓度分别控制在80~140 mg·L-1和140~200 mg·L-1之间能够很好地保证发酵产量。
参考文献:
[1] Tong K I,Yamamoto M,Tanaka T.A simple method for amino acid selective isotope labeling of recombinant proteins inE.coli[J].J Biomol NMR,2008,42(1):59-67.
[2] Lewkowicz E S,Martinez N,Rogert M C,et al.An improved microbial synthesis of purine nucleosides[J].Biotechnology Letters, 2000, 22(16): 1277-1280.
[3] 马泗庄,刘改香,赵洪宁,等.反相高效液相色谱法测定肌苷及其药物动力学的观察[J].国外分析仪器技术与应用,1998,(4):53-55.
[4] Leigh John A, Dodsworth Jeremy A. Nitrogen regulation in bacteria and archaea[J]. Annu Rev Microbiol,2007, 61:349-377.
[5] 刘刚,刘必成,付水林,等.培养基中无机盐对红霉素A含量的影响[J].化学与生物工程,2009,26(8):80-82.
[6] 王敬岩,朱圣庚,徐长法.生物化学(下册,第三版)[M].北京:高等教育出版社,2002:319-320.
[7] 宋云平,刘必成,于臻,等.粗糙集在红霉素培养基优化中的应用[J].化学与生物工程,2007,24(11):61-63.
[8] Agnieszka Bzowska, Ewa Kulikowska, David Shugar. Purine nucleoside phosphorylases: Properties, functions, and clinical aspects[J].Pharmacology & Therapeutics, 2000,88(3):349-425.
