α-细辛醚衍生物的合成研究
2010-06-04王旭东,赵静国,谢令德等
细辛醚 (Asarone,Asarum camphor),分子式为C12H16O3,有3个同分异构体,分别是α-细辛醚、β-细辛醚、γ-细辛醚。其中,α-细辛醚[1,2,4-Trimethoxy-5-(1-phenyl) benzene][1]的结构式见图1a。α-细辛醚是天南星科植物石菖蒲的主要有效成分之一,主要存在于石菖蒲等植物的挥发油中,具有止咳、祛痰、平喘、镇静、解痉以及抗惊厥作用,亦可用作杀虫剂[2]。查尔酮的(Chalcone)化学名称为1,3-二苯基丙烯酮,其结构式见图1b。以查尔酮为母体的天然化合物存在于甘草、红花等植物中, 如甘草中的异甘草素、红花中的红花苷元等,大多含有酚羟基,具有较大的柔性,能与不同的生物受体结合而表现出多种药理作用,如抗肿瘤、抗炎、镇痛、抗溃疡、抗病毒、抗菌、抗真菌、抗疟疾等[3]。


a b
作者从α-细辛醚和查尔酮的结构特点出发,设计并合成出10个这一类结构的化合物,其中3个由含酚羟基的芳酮在超声波作用下合成。合成路线见图2。

Ⅰ
图2标题化合物的合成路线
Fig.2Thesyntheticrouteoftitlecompounds
1 实验
1.1 试剂及仪器
所用试剂均为分析纯,反应中间体除邻硝基苯乙酮、对溴苯乙酮、间溴苯乙酮外均为自制。
熔点用毛细管法测定,温度计未校正;FI21730型红外光谱仪(KBr压片);Brucker AC2300型核磁共振仪( TMS为内标,CDCl3为溶剂)。
1.2 2,4,5-三甲氧基苯甲醛的制备
参照文献[4~6]制备2,4,5-三甲氧基苯甲醛。用水进行重结晶, 减压抽滤得白色针状结晶,真空干燥,测定熔点为112.5~113.5℃,收率72%。
1.3 α-细辛醚类衍生物Ia~Ig的合成[7,8]
向100 mL圆底烧瓶中加入3.23 g(58 mmol)KOH固体、20.0 mL无水乙醇,搅拌溶解,再加入5.89 g(30 mmol)2,4,5-三甲氧基苯甲醛,搅拌溶解,称取27 mmol芳香酮置于50 mL的小烧杯中,用30.0 mL无水乙醇与之充分混合,倒入恒压分液漏斗中,30 min滴加完毕,TLC监控终点,搅拌4 h,反应结束。取生成的沉淀真空抽滤,用95%的乙醇重结晶,烘干,得到固体,即α-细辛醚类衍生物Ia~Ig。
1.4 α-细辛醚类衍生物Ih~Ij的合成[9]
向装有搅拌装置的100 mL三口烧瓶中加入3.23 g(58 mmol)KOH固体、50.0 mL无水乙醇,搅拌溶解,再加入5.89 g(30 mmol)2,4,5-三甲氧基苯甲醛,同时加入27 mmol芳香酮。将以上装置置于间歇超声波清洗仪中,分别开启搅拌和间歇超声波清洗仪。TLC监控终点,搅拌反应12 h。用2 mmol·L-1盐酸酸化,然后用无水乙醚萃取3次。有机层用饱和的氯化钠溶液洗涤,再用无水MgSO4干燥,过滤,浓缩,用石油醚和乙酸乙酯重结晶,干燥,得到固体,即α-细辛醚类衍生物Ih~Ij。
2 结果与讨论
2.1 所合成化合物的物理性质和波谱数据
所合成α-细辛醚衍生物的物理性质见表1。
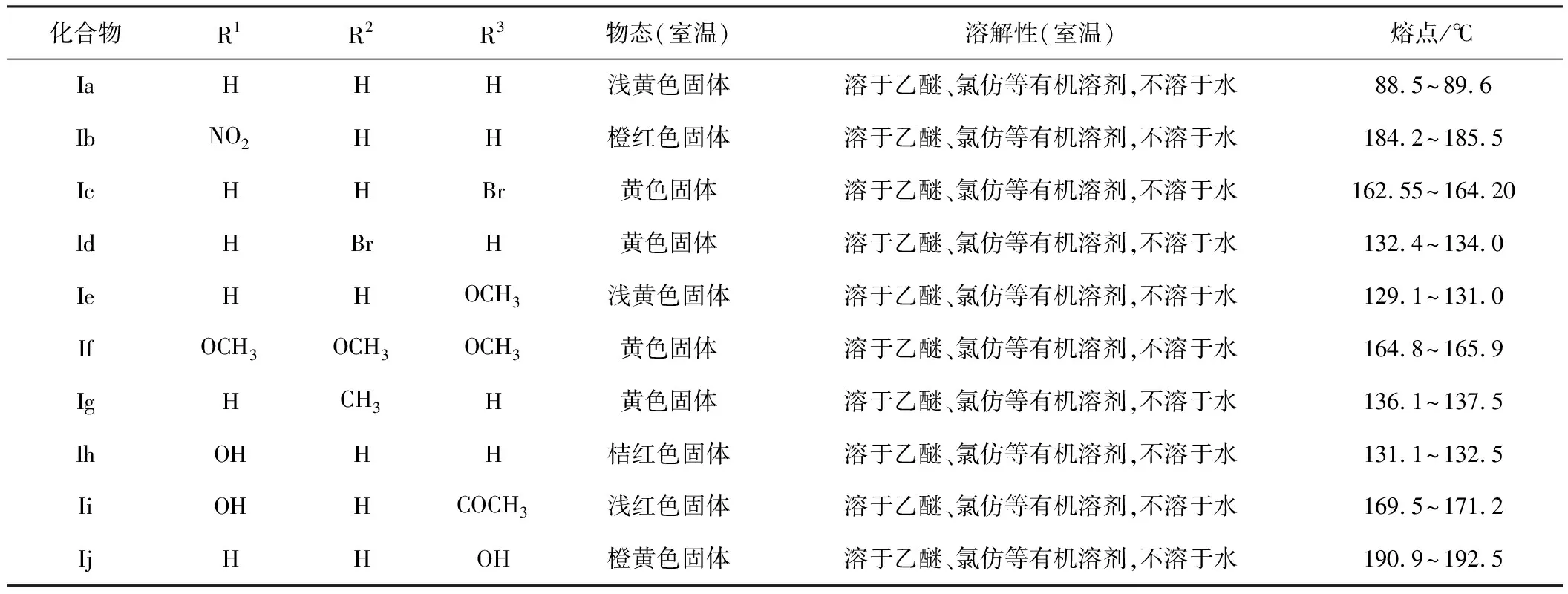
表1 α-细辛醚衍生物的物理性质
α-细辛醚类衍生物Ia~Ij的波谱数据如下:
化合物Ia:1HNMR(400 Hz,CDCl3),δ,ppm:3.953~3.909(s,9H,OCH3),6.529(s,1H,ArH),6.928(t,1H,ArH),7.001(d,1H,ArH),7.125(s,1H,ArH),7.471(m,1H,ArH),7.597(d,J=15.6 Hz,1H,ArCH=CH),7.911(d,1H,ArH),8.195(d,J=15.2 Hz,1H,ArCH=CH)。IR,ν,cm-1:1647。
化合物Ib:1HNMR(400 Hz,CDCl3),δ,ppm:3.801~3.929(s,9H,OCH3),6.456(s,1H,ArH),6.928(t,1H,ArH),7.001(d,1H,ArH),7.125(s,1H,ArH),7.471(m,1H,ArH),7.597(d,J=15.6 Hz,1H,ArCH=CH),7.911(d,1H,ArH),8.195(d,J=15.2 Hz,1H,ArCH=CH)。IR,ν,cm-1:1630。
化合物Ic:1HNMR(400 Hz,CDCl3),δ,ppm:3.900~3.948(s,9H,OCH3),6.518(s,1H,ArH),7.018(s,1H,ArH),7.373(d,J=15.6 Hz,1H,ArCH=CH),7.606~7.623(m,2H,ArH),7.848~7.875(m,2H,ArH),8.062(d,J=15.6 Hz,1H,ArCH=CH)。IR,ν,cm-1:1657。
化合物Id:1HNMR(400 Hz,CDCl3),δ,ppm:3.909~3.957(s,9H,OCH3),6.526(s,1H,ArH),7.122(s,1H,ArH),7.354(m,2H,ArH),7.673(d,J=15.6 Hz,1H,ArCH=CH),7.911(d,2H,ArH),7.925(d,J=15.2 Hz,1H,ArCH=CH),8.090(d,2H,ArH)。IR,ν,cm-1:1659。
化合物Ie:1HNMR(400 Hz,CDCl3),δ,ppm:3.578~3.951(m,12H,OCH3),6.531(s,1H,ArH),7.135(s,1H,ArH),6.972(m,2H,ArH),7.597(d,J=15.6 Hz,1H,ArCH=CH),7.462(d,J=16.0 Hz,1H,ArCH=CH),8.041(m,2H,ArH)。IR,ν,cm-1:1644。
化合物If:1HNMR(400 Hz,CDCl3),δ,ppm:3.888~3.965(s,18H,OCH3),6.518(d,2H,ArH),7.125(s,1H,ArH),7.357(s,1H,ArH),7.495(d,J=16.0 Hz,1H,ArCH=CH),7.988(d,J=16.0 Hz,1H,ArCH=CH)。IR,ν,cm-1:1639。
化合物Ig:1HNMR(400 Hz,CDCl3),δ,ppm:2.332(s,1H,ArCH3),3.906~3.949(d,9H,OCH3),6.526(s,1H,ArH),7.133(s,1H,ArH),7.264~7.304(t,2H,ArH),7.445(d,J=15.6 Hz,1H,ArCH=CH),7.917(d,2H,ArH),8.070(d,J=16.0 Hz,1H,ArCH=CH)。IR,ν,cm-1:1648。
化合物Ih:1HNMR(400 Hz,CDCl3),δ,ppm:3.916~3.955(s,9H,OCH3),6.527(s,1H,ArH),6.928(t,1H,ArH),7.001(d,1H,ArH),7.125(s,1H,ArH),7.471(m,1H,ArH),7.597(d,J=15.6 Hz,1H,ArCH=CH),7.911(d,1H,ArH),8.195(d,J=15.2 Hz,1H,ArCH=CH),13.069(s,1H,ArOH)。IR,ν,cm-1:3427,1628。
化合物Ii:1HNMR(400 Hz,CDCl3),δ,ppm:2.616(s,3H,COCH3),3.942(s,9H,OCH3),6.541(s,1H,ArH),7.053(d,1H,ArH),7.673(d,J=15.2 Hz,1H,ArCH=CH),8.044~8.072(m,1H,ArH),8.259(d,J=15.2 Hz,1H,ArCH=CH),8.642(d,1H,ArH),13.626(s,1H,ArOH)。IR,ν,cm-1:3439,1677。
化合物Ij:1HNMR(400 Hz,CDCl3),δ,ppm:3.906~3.951(s,9H,OCH3),6.527(s,1H,ArH),6.922~6.943(m,1H,ArH),7.127(s,1H,ArH),7.451(d,J=15.6 Hz,1H,ArCH=CH),7.984~7.989(d,1H,ArH),8.071(d,J=16.0 Hz,1H,ArCH=CH)。IR,ν,cm-1:3333,1640。
所合成的10个α-细辛醚衍生物的结构经IR和1HNMR已确证。化合物Ib、Id、If、Ii未见文献报道。
2.2 合成方法讨论
采用两种方法合成α-细辛醚衍生物,其中含酚羟基的酮采用超声波合成法,文献[9]报道,此类化合物的合成所需时间为144~200 h不等,反应时间过长;若采用羟基保护,分离提纯困难[3];而采用超声波法收率大幅提高,耗时大幅缩短,且较酚羟基保护法反应步骤短,易于分离和精制。10个新型的α-细辛醚类衍生物的杀虫活性实验正在进行中。
3 结论
以 2,4,5-三甲氧基苯甲醛为原料,经羟醛缩合反应合成了10个α-细辛醚衍生物,其中有3个由带酚羟基的酮在超声波作用下合成,有4个未见文献报道。所有化合物的结构经1HNMR和IR确证。
参考文献:
[1] The European Agency for the Evaluation of Medicinal Products.Evaluation of Medicines for Human Use.Final Position Paper on the Use of Herbal Medicinal Products Containing Asarone [R].2003.
[2] 张静,冯岗,马志卿,等.细辛醚对6种农业害虫的杀虫活性[J].西北农林科技大学学报(自然科学版),2008,36(4):166-170.
[3] 刘翔峰,史道华.查尔酮合成方法的研究进展[J].应用化工,2009,38(8):1210-1213.
[4] 刘博纯.α-细辛脑原料生产工艺[P].CN 1 511 817,2004-07-14.
[5] 王兴明,杨定明,王清成.顺-2,4,5-三甲基苯丙烯的合成[J].西南工学院学报,1999,14(1):64-66.
[6] 陈洪流,赵静国,谢令德,等.α-细辛醚的合成研究[J].化学与生物工程,2008,25(12):24-25.
[7] 党珊,刘锦贵,王国辉.室温下2′-羟基查尔酮的合成[J].合成化学,2008,16(4):460-463.
[8] 何文香,宁海峰,郑旭煦,等.合成查尔酮化合物新方法的研究进展[J].重庆工商大学学报(自然科学版),2009,26(3):305-310.
[9] Bennett Christopher J,Caldwell Stuart T,McPhail Donald B,et al.Potential therapeutic antioxidants that combine the radical scavenging ability of myricetin and the lipophilic chain of vitamin E to effectively inhibit microsomal lipid peroxidation[J].Bioorganic & Medicinal Chemistry,2004,12(9):2079-2098.
