艾滋病神经系统感染临床与影像学表现
2010-06-02李宏军
李宏军,齐 石
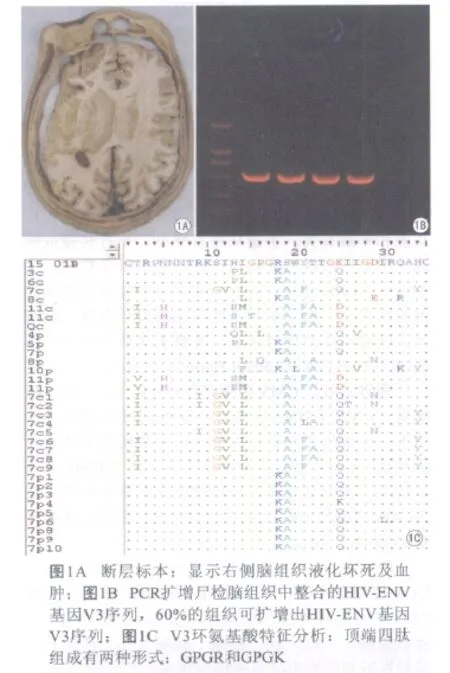
HIV是一种嗜神经病毒,可被巨噬细胞吞噬,通过血-脑屏障侵入脑组织并在脑脊液中增殖。从艾滋病患者的大脑、脊髓、周围神经及脑脊液中均已经分离出HIV,电镜、免疫组化及原位杂交技术都证实单核细胞和多核细胞中含有HIV[1]。我们用聚合酶链反应(PCR)技术在AIDS患者脑组织中检测出HIV-1 DNA序列,并证明HIV的拷贝数与病理改变显著相关(图1)。
神经系统感染是HIV相关合并症最主要的受累器官,也是导致AIDS死亡率上升的主要原因之一。HIV相关性神经系统感染的病原体主要包括寄生虫、真菌、分枝杆菌、病毒、细菌等[2]。在AIDS患者中,有10%~20%以神经系统损害为首发症状,70%~80%的儿童具有神经系统功能障碍的临床表现。国外报道,经尸检病理诊断的神经病理学异常多达80%。
AIDS相关的神经系统疾病可分为5个方面:①HIV相关性原发感染损害,如HIV性脑炎、无菌性脑膜炎等;②神经系统机会性感染,如弓形虫脑炎、巨细胞病毒性脑脊髓炎、疱疹性病毒性脑炎、进行性多灶性白质脑病、隐球菌脑膜炎、结核菌感染等;③神经系统肿瘤,主要是非霍奇金淋巴瘤,偶有卡波济氏肉瘤(Kaposi's sarcoma)造成损害等;④脑血管性疾病,如脑血管炎、脑出血、萎缩及梗死等;⑤周围神经病变。
1 HIV相关性原发感染损害
1.1 HIV性脑炎
HIV脑炎是由于HIV可以直接引起神经系统损害,并产生相应的神经精神症状,主要表现为痴呆,这种疾病称为HIV脑炎或HIV痴呆综合征。目前认为本病为HIV感染晚期并发症,发生在炎症免疫抑制者。
发病机制:①HIV感染神经系统内的血管内皮细胞,使血-脑脊液屏障系统受损,微血管的改变也可导致神经系统损害;②HIV嗜神经性;③HIV产生的gp120包膜蛋白对神经细胞有毒性作用;④HIV感染的小胶质细胞、巨噬细胞也具有毒性作用,间接地造成神经损伤;⑤HIV可诱发自身免疫反应;⑥儿童患者自身发育不完善,易遭HIV侵害。
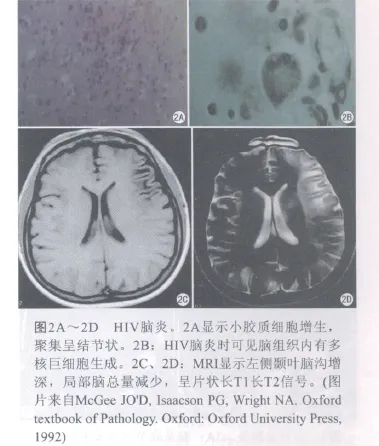
病理改变:HIV脑炎早期大脑形态无明显改变,以后出现不同程度的脑萎缩,多见局部萎缩表现,如额叶、颞叶比较明显,晚期可见脑室扩张,脑组织明显萎缩,重量减轻。HIV脑炎的病灶分布于大脑白质和灰质中,深部灰质(基底核、脑干核团)病变比较严重;也可见脑组织发生灶性或大片坏死。镜下检查,HIV脑炎以多核巨细胞形成于小胶质结节比较有一定特征性,故又有“多核巨细胞脑炎和结节性脑炎”之称。特征表现为广泛分布的小胶质结节浸润,即小胶质细胞增生,聚集成小结节。一般多核巨细胞和小胶质细胞结节可视为HIV脑炎的病理诊断依据(图2A、2B)。
临床表现:HIV脑炎主要临床特征为进行性痴呆,表现为智力减退,认知能力、运动及行为方面的功能障碍。反应迟钝,表情淡漠,记忆力下降。亦可由共济失调症状。诊断:①HIV感染的确切证据;②患者有进行性智力减退及运动障碍,持续数月;③脑脊液排除其他感染或肿瘤因素;④MR检查脑萎缩或正常表现。
影像表现:MRI表现为弥漫性或局灶性脑白质异常,脑沟增宽,脑室扩大,脑总量减少,呈片状长T1长T2信号(图2C、2D)。有研究显示,在MR DTI上,额叶、胼胝体、海马ADC值增高[3]。
1.2 无菌性脑膜炎
部分HIV患者HIV阳性时,可出现无菌性脑膜炎,表现为急性发作的头疼、畏光、发热、脑膜刺激征等。第7对脑神经受累,其次是第5对和第8对脑神经。也可有精神状态改变。因为本病临床及影像表现均无特异性及特征性,常采用排除法进行诊断。
2 神经系统机会性感染
2.1 弓形虫脑炎
在AIDS患者中,寄生虫感染以弓形虫脑炎最常见。在免疫功能正常情况下,弓形虫感染一般为亚临床性和自愈性疾病。在免疫功能受到损伤与被抑制时,急性弓形虫或隐匿性弓形虫感染复活,出现播散性感染,以脑、脊髓和心脏受累多见。尤其是发生在CD4细胞小于100 cells/μl时,弓形虫感染是AIDS的诊断定义性疾病,是导致死亡的重要原因。
发病机制:弓形虫是一种人畜共患的病原体,主要通过进食经消化道传染。弓形虫在胃肠道内进入血管淋巴管,引起虫血症,随血流进入脑、心、肺等器官,或经淋巴管流入局部淋巴结。弓形虫进入人体后寄生在各种有核细胞内。在宿主细胞内生长繁殖,导致细胞坏死与组织破坏,从细胞中释放出的可溶性抗原导致周围组织炎症反应。
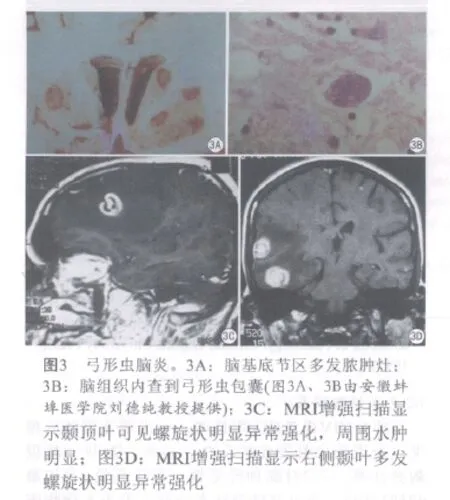
病理改变:弓形虫脑炎的病理特征为形成多发脓肿性疾病,最常累及大脑皮髓质交界处和大脑基底核部位,也可累及脑干、小脑,偶尔累及脊髓。主要是脑组织多灶性坏死,病灶中心神经细胞变性坏死消失,周围血管充血,伴淋巴细胞浸润和小胶质细胞增生,边缘部位较易查见弓形虫假囊和游离速殖子(滋养体)(图3A、3B)。
临床表现:发热、淋巴结肿大、肝脾肿大,累及神经系统时出现头痛、眩晕、精神错乱、记忆力丧失、昏迷等精神神经症状,肢体软弱、麻木、疼痛、抽搐、偏瘫、大小便失禁、共济失调等局限性症状,还可出现脑膜刺激症状。脑脊液的临床实验室检查对诊断及鉴别诊断有重要意义[4]。
影像表现:MR T1WI上病变为低强度信号,T2WI病灶为中等强度信号,周围水肿带为高强度信号,静脉内注射对比剂(Gd-DTPA)后,病灶本身呈高信号,而水肿带不增强(图3C、3D)。影像检查也用于弓形虫的疗效评估等[5]。
2.2 巨细胞病毒性脑脊髓炎
巨细胞病毒(CMV)脑炎可为先天性或后天性感染。成人中枢神经系统感染仅发生于细胞免疫缺陷者,是先天性畸形及婴儿智力障碍的重要原因。CMV感染的自然史很复杂,在原发性感染以后排毒,往往持续数周、数月甚至数年,然后感染转为潜伏。常有复发感染伴重新排毒。甚至在原发感染后很多年,潜伏病毒再激活,也可能有不同抗原性病毒株的再感染。CMV感染的临床表现与个体免疫功能和年龄有关。不论从垂直感染、平行传播或医源性感染所出现的症状与体征都是多种多样的。关于后天性CMV感染,在临床中常见于输血后的单核细胞增多症,由于免疫功能缺陷而发生血管、网膜炎、肺炎以及消化道感染,并且大多数患者合并格林-巴利氏综合征(Guillain-Barre syndrome)。
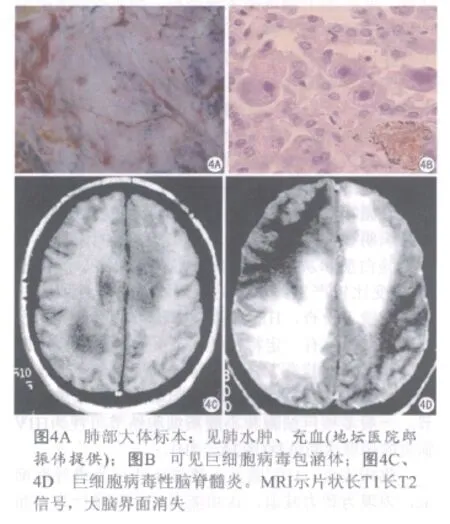
病理改变:CMV感染是由CMV引起的性传播疾病。CMV为DNA病毒。特征性病变为感染细胞增大,细胞核和细胞质内分别出现嗜酸性和嗜碱性包涵体。CMV感染在全世界分布,人是CMV的唯一宿主。不同国家及不同经济状况感染率不同。成人CMV感染和免疫功能有密切关系。多累及肺部及脑部(图4A、4B)。
临床表现:CMV脑炎多发生在HIV感染晚期,CD4+T细胞小于0.05×109/L,或更低情况下,脑CMV可引起精神状态的改变,如昏睡、精神错乱、意识模糊、失语、视力模糊、癫痫发作、伴发热,最后发展到中枢神经系统抑制状态。
发病机制:CMV感染可引起机体的免疫功能降低,特别是细胞免疫功能下降。CMV感染对胸腺发育及脾细胞、单核吞噬细胞、NK细胞及CTL细胞的功能有着显著的影响。
影像表现:MRI表现为脑室周围片状长T1长T2信号,也可呈脑白质弥漫小斑片状长T1长T2信号。增强室管膜可出现强化,脑实质无强化(图4C、4D)。影像诊断没有特异性,脑脊液的CMV DNA的检查对诊断更有帮助[6]。
2.3 疱疹性病毒性脑炎
单纯疱疹病毒(HSV)多引起皮肤黏膜感染,尤其引起单纯性病毒性脑炎比较少见。
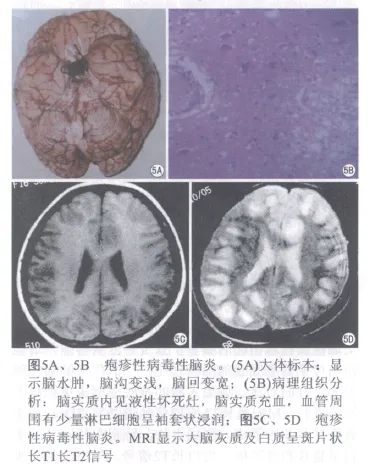
病理改变:在机体免疫功能损伤时,HSV复活并传播至脑内。其病变多呈不对称性分布,以颞叶中部、海马回、额叶眶面、顶叶和扣带回病变最显著,也可累及下丘脑、延髓、脑桥等处。肉眼可见双侧颞叶坏死,呈不对称性,可伴有出血。显微镜下见脑实质有出血、坏死、液化,形成急性出血性坏死性脑炎(图5A、5B)。
临床表现:头痛、发热和癫痫等神经精神症状,亦可有虚弱、嗜睡、共济失调、失语等症状。
影像表现:MRI表现为额叶、顶叶片状长T1信号,长T2信号,脑组织水肿明显,一般不累及壳核,有一定的特征性(图5C、5D)。也可引起脑膜脑炎,颅神经炎[7]。
2.4 进行性多灶性白质脑病
进行性多灶性白质脑病(PML)不常见,通常发生于AIDS晚期,在AIDS中的发生率为1%~10%,也有报告称PML约发生于四分之一的AIDS患者。PML以多灶性神经缺陷为主要特征,病情发展迅速,病人多在4个月内死亡,平均生存期不到1年。
发病机制:PML总是发生于细胞免疫反应缺陷的患者。对PML患者脑组织用电子显微镜研究,发现少数胶质细胞内存在由大量乳头多瘤空泡病毒颗粒组成的包涵体。从PML患者脑组织先后分离到的病毒绝大多数为JC病毒[8]。原发感染在儿童时期,病毒潜伏在肾或末梢血单核细胞中,在一定条件下经血流感染中枢神经系统(CNS),也有报道在PML及非PML患者脑组织中以PCR法可检出JCV-DNA,说明存在CNS的潜伏感染,但是如何促使其发生PML,尚待研究。
病理改变:PML病理表现为少突神经细胞受到乳多空病毒的选择性破坏,引起脱髓鞘。脑白质内有多灶性损害,形成脱髓鞘融合区,大脑半球比小脑易于受累,特别是皮质下灰、白质交界处。尸解见脑白质有颗粒状黄色软化灶,弥漫而不对称,融合的病灶可达数厘米。组织病理学所见在多灶性脱髓鞘区周围有深染的少突胶质细胞,具毛玻璃样外观,其核肿胀,内含嗜酸性无定型的病毒包涵体,透射电镜上病毒呈结晶状排列,大小为33~39 nm;见巨大畸形的星形细胞,具有多形性分叶状核(图6A),常呈怪形。有大量泡沫状巨噬细胞,以及组织坏死。
临床表现:为多灶性症状,不对称。有缓慢发展的记忆障碍、偏盲、偏瘫、语言障碍等。早期症状也可为记忆及语言障碍、个性改变等。从病理证实者看,36%有记忆障碍,35%有视野缩小,33%有单侧或半身轻瘫,6%有癫痫样发作。少数患者有思维不能集中,平衡不好,偶见小脑共济失调。80%患者在起病后6~12个月死亡,个别可见一度好转,存活稍长。整个病程中很少有发热及头痛。
影像表现:大脑白质有广泛多发脱髓鞘改变,呈散在不对称性分布,小脑、脑干与脊髓病变比较少见。白质内病灶为多发性,分布不对称,常见多灶性低密度区,呈圆形或椭圆形。注射对比剂后通常无增强反应及肿块影,有时轻度占位效应及强化反应,偶尔累及灰质并引起占位效应。MR T1WI为阴性,或显示低信号病灶,T2WI白质区出现均匀的高信号病灶(图6B),边界清楚,无占位效应,亦无特异性[9]。常为多发性和不对称性,一般无明显占位表现。MR波谱表现为Cr升高,NAA减低(图6C),复查时可见病变进行性加重,小病灶也可逐渐融合扩大,晚期出现脑萎缩改变。近来,有学者研究,MT MRI上,PML病灶磁化转移率低,而HIV相关的白质病变磁化转移率仅轻度降低,可以用来鉴别PML病灶与HIV相关的白质病变[10]。

2.5 隐球菌脑膜脑炎
新型隐球菌(cryptococcosis)是一种条件致病菌,艾滋病是重要易感因素。新型隐球菌性脑膜炎是由新型隐球菌感染脑膜和脑实质所致。成年AIDS患者中,隐球菌脑膜脑炎发生率6%~10%,在AIDS尸检病例中为11.3%~13.8%。预后很差。被美国CDC列入AIDS患者的定义性疾病,近年来随着广谱抗生素、激素、免疫抑制剂等药物的广泛或不适当应用,以及免疫缺陷性疾病及器官移植患者的增加,该病罹患率亦呈增长趋势。
发病机制:广泛存在于土壤、蔬菜、牛奶、草地、蜂巢及鸽粪中。新型隐球菌多由呼吸道吸入,可产生一种胞外磷脂酶B,破坏肺泡中的表面活性物质,进而改变肺组织的物理特性,使菌体较易在肺内形成病灶,数月内经血行播散至脑或脑膜,引起炎症反应。它主要通过介导对吞噬细胞的抑制,减少诱发特异性T淋巴细胞反应。研究发现荚膜厚度与其抗吞噬能力呈正相关,且主要与多糖荚的高分子量片断有关。此外多糖荚膜还通过激活补体、抑制吞噬细胞释放细胞因子IL-6和 IL-1β等,抑制机体免疫反应,使菌体逃避宿主防御系统的清除而致病,可导致脑膜、脉络丛和室管膜炎;而另一类病毒则倾向于感染神经元和胶质细胞,发生脑炎。常累及第7对,以及第5、8对脑神经。
病理改变:隐球菌在中枢神经系统主要累及脑膜组织及大脑的基底部。肉眼可见软组织肿胀,软脑膜浑浊,脑沟内有胶样组织聚集。内含单核细胞,淋巴细胞和大量的隐球菌包子;也可见巨噬细胞增生,小灶性肉芽肿形成。肉芽肿样病变导致动脉血栓形成和多灶性皮质梗死、出血,并可扩大为隐球菌脓肿,形成占位。镜下可见隐球菌包子(图7A、7B)。

临床表现:AIDS无菌性脑膜炎可见于AIDS各期(除AIDS晚期外),常累及每7对以及第5、8对脑神经。这种急性原发性神经系统损害,大多数可在1~4周内恢复,但亦有少数人会有持久性损害。AIDS无菌性脑膜炎多表现为急性脑膜炎,但部分患者(约10%)可发展为慢性。临床表现急速起病,一般几小时,表现为发热,体温可达38~40℃,头痛,其程度比其他原因发热伴随的头痛更为严重,可有轻度的神志障碍如嗜睡、昏睡或易激惹, 很少出现精神混乱;木僵或昏迷、颈项强直、畏光和眼球运动时疼痛和肌痛是常见的主诉。也可出现颈项强直和脑膜刺激征,但早期很容易被忽略。一般2~4周后可自行消失,发展为慢性的患者症状可反复出现。少数病例还有其他症状,如性格行为改变、精神思维障碍、视野缺损、二便失禁以及癫痫发作等。
影像表现:MR检查一般无特异性表现。仅见因交通性脑积水引起的脑室扩张及轻度脑萎缩,增强扫描可见脑基底底部脑膜强化,与低信号的脑组织形成良好的对比。如果大脑的基底部形成虫蚀样多发小囊肿,MRI呈长T1长T2信号(图7C、7D),如果有隐球菌脓肿形成,形成占位,特别在基底节区平扫呈囊状和蜂房状,长T1长T2信号,周围脑组织水肿也呈长T1长T2信号。较特异的表现为脑基底部V-R间隙增宽,但需排除其他V-R间隙增宽的疾病[11]。增强后显示环状和蜂窝状强化(图7C~7H)。血清及脑脊液中隐球菌荚膜多糖抗原的检测,能够诊断神经系统隐球菌感染[12]。

2.6 神经系统结核
HIV感染患者,估计每年1000人中有35~162人发生活动性结核,而非HIV人群每年1000人中有12.9人。结核可以发生在AIDS的任何阶段及CD4细胞计数的任何水平,HIV感染者的结核发病越晚,免疫缺陷越严重,临床及影像表现越不典型。当CD4细胞计数在350~400 cell/μl水平之上时,AIDS中枢神经系统结核的发病率约为5%~10%。HIV的流行使结核发病率呈上升趋势,原发和继发结核均可发生在HIV感染早期。细菌经血流播散至软脑膜,经软脑膜下或室管膜下的结核性肉芽肿破入蛛网膜下腔,炎性肉芽肿好发于基底池脑膜,发生黏稠的渗出,可引起交通性或梗阻性脑积水、基底池的动脉炎,脑实质内可形成肉芽肿和脓肿。
发病机制:中枢神经系统结核感染大多是结核分支杆菌,自原发肺结核感染灶经血液播散至脑脊膜或/和脑实质所致原发性结核发生血行播散停止后,在中枢神经系统内可有许多结核菌存留,一旦细胞介导的免疫发生变化,结核菌即可形成小结节,这些结节并不扩散破入蛛网膜下腔,故不形成脑膜炎,而是在脑实质内发展,形成外围有致密纤维的大小不等的结核球,一般直径小于1 cm。这些结核球呈黄白色或灰黄色,与周围脑组织分界清楚,中心为干酪样坏死组织或肉芽组织,机体防御能力强者可完全形成钙化,极少中心液化形成单纯性脓肿。脑膜上的结核结节可扩大形成扁平状结核球。
病理改变:结核病典型变现是结核结节与干酪坏死,结核结节有上皮细胞和郎罕氏细胞(Langhans cells)构成,中心可见干酪坏死,周围有纤维母细胞和淋巴细胞,多累及脑膜,也可累及脑实质,形成占位。脑脊液检查可查到结核菌(图8A)。

临床表现:①表现有低热、盗汗、消瘦、血沉快等结核征象;②颅内高压症状和局限性脑损害症状,表现为头痛、呕吐及视乳头水肿、偏瘫、失语,癫痫发作,小脑损害症状如眼震,肢体共济失调。
影像表现:如果累及脑膜,多发生脑基底部脑膜增厚渗出,MRI增强可见明显异常强化。如果累及脑实质,在脑内可形成多发的类圆形结节,MRI呈长T1长T2信号,周围水肿明显,也呈长T1长T2信号,也可见周围水肿不明显的结节灶[13](图8B~8D)。因AIDS免疫力低下,进展迅速,预后欠佳。

3 神经系统肿瘤
非霍奇金淋巴瘤:AIDS淋巴瘤发生率约5%~10%。AIDS淋巴瘤是AIDS的定义性肿瘤。
发病机制:多数学者认为CNS内没有淋巴组织,淋巴瘤可能来源于颅内血管的未分化的多潜能间叶细胞或干细胞,所以肿瘤与血管关系密切。近年来通过电镜和免疫研究发现,淋巴瘤属于免疫系统肿瘤,起源于人体中的间叶细胞。Simon认为,脑组织作为免疫的“特许部位”,潜伏的疱疹病毒能激活B细胞,使之逃避机体的免疫监视而发展为淋巴瘤。
病理改变:非霍奇金淋巴瘤多侵犯大脑基底部、额叶、颞叶、顶叶、侧脑室旁,一般为单发局限性肿块,少数也可发生多中心生长,累及双侧大脑,病灶血供丰富,常有出血、坏死。如果病灶累及脑膜和脑室,才形成广泛浸润性病变,如果发生在脑室之内,则形成占位。脑淋巴瘤的病理特征为:①瘤细胞聚集在血管周围,呈袖套样排列,类似血管炎表现;②瘤细胞形态较一致,核染色较深,瘤细胞向周围组织浸润;③瘤细胞间可有散在吞噬细胞,呈“满天星”图像,吞噬现象比较明显;④瘤周脑组织可有不同程度的充血水肿,出血变性坏死,伴格子细胞及胶质细胞增生(图9A)。
临床表现:头痛,呕吐,记忆力下降,意识不清,烦躁,大小便失禁,下肢瘫痪。CD4 15 cell/μl。
影像表现:当淋巴瘤表现为脑室周围浸润病变时,增强扫描脑膜及脑室,室管膜明显强化,如果淋巴瘤在脑内形成占位,MR T1WI呈低信号,T2WI呈高信号。增强后肿块呈不均匀增强。中心多坏死,无强化,边缘呈“地图样”明显异常强化(图9B~9D)。有报道称,脑脊液EB病毒DNA的PCR检查有助于淋巴瘤的诊断[14]。
4 脑血管性疾病
萎缩及梗死:AIDS患者中约12%~20%伴有脑血管并发症。其中,最多见的是单发或多发性局灶性脑梗死,也可表现为脑出血和短暂脑缺血发作[15]。血管性病变大致可分为:①非特异性脑组织充血、水肿和出血;②脑血栓形成、栓塞并引起脑梗死;③急性肉芽肿性脑血管炎;④某些机会性感染诱发的血管病变;⑤肿瘤性血管损害。
发病机制:HIV相关性脑梗死是由于HIV的嗜血管性导致血管内膜损伤引起的血管内膜炎、机遇性感染或滥用药物的并发症[16];结核、隐球菌性脑膜炎和脑膜血管梅毒为累及血管频率最高的机遇性感染;以血管损害为主者也可见于弓形体脑病、霉菌病、疱疹病毒等[17]。进而因多种因素使局部动脉狭窄加重或完全闭塞,导致脑组织缺血、缺氧、坏死,引起神经功能障碍的一种脑血管病。由于长期的低灌注引起灰质萎缩,进而导致认知障碍、痴呆[18]。
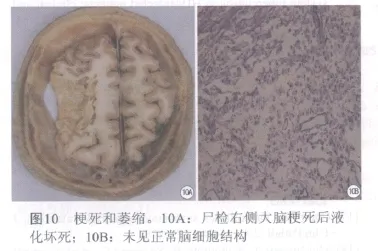
病理改变:①HIV相关性脑动脉闭塞6 h以内脑组织改变尚不明显,8~48 h缺血的中心部位软化、组织肿胀、坏死。灰白质界限不清,出现脑梗死。镜检见组织结构混浊,神经细胞及胶质细胞变性、坏死、毛细血管轻度扩张。周围可见液体或红细胞渗出。动脉阻塞2~3天后,周围水肿明显;7~14天,病变区明显变软,神经细胞消失,脑组织开始液化,吞噬细胞大量出现,星形细胞增生;21~28天胶质细胞及毛细血管增生,小病灶形成胶质瘢痕,大病灶形成软化灶。②HIV相关性分水岭脑梗死病变部位多位于相邻血管供血区之间的分水岭区或边缘带。一般认为分水岭梗死多由于血流动力学障碍所致。③HIV相关腔隙性脑梗死为病变血管多为直径100~400 pm的深穿支动脉,故病灶多位于壳核、尾状核、内囊、丘脑、桥脑基底部及辐射冠等,病灶直径一般为0.2~15 mm,由于软化坏死组织被吞噬而残留小空囊腔,多个囊腔存在即腔隙状态。发病率相当高。(图10A、10B)
临床表现:脑血管栓塞与梗死的部位及程度有关。患者可出现纯感觉性卒中(偏身感觉障碍),纯运动性卒中(共济失调性偏瘫,视物模糊或偏盲)。
影像表现:AIDS患者发生脑血管以外的因素很多,如HIV感染内皮细胞,使内皮细胞受损,可能诱发血栓形成,或免疫复合无聚集,使血管狭窄,在血管因子的作用下,使血管平滑肌和纤维母细胞增生,也可导致血管狭窄(图10C~10E)。

5 周围神经病变
周围神经系统是指运动神经元、感觉神经元和植物神经元的突起延伸于CNS即脑和脊髓以外的部分,脊髓及脑干下运动神经元、初级感觉神经元、周围植物神经元的病变统称为周围神经病变。艾滋病患者周围神经发生形态改变与功能障碍比较少见,约9%~16%。如优势感觉神经病、急性或慢性脱髓鞘性多神经病、多神经根病、植物神经病、神经节炎等。
病理改变:节段性脱髓鞘、轴索变性、神经外膜和神经内膜单核细胞炎症。
我们用原位杂交技术证实浸润血管的单核细胞内有HIV复制,因此可证明解释外周神经病变的病理机制。其他感染也可引起神经病,如CMV、梅毒、自身免疫介导性攻击、各种中毒性、代谢性和营养因素、神经和神经根的肿瘤浸润等,少部分患者发病在HIV感染发病之前出现症状。
6 总结
AIDS相关性神经系统感染和肿瘤在AIDS影像学疾病谱中占重要位置,MRI是诊断神经系统感染相关疾病的不可替代的检查手段,早期预防、早期诊断、正确诊断是改善患者生活质量和延长患者生命的关键,但随着病人生命延长,多病原体相继感染的机会增多,增加了AIDS相关神经系统感染的复杂性、多重性给我们在临床工作中提出了提出新的要求和挑战;笔者认为首先熟悉并做好AIDS各系统并发症分型,再根据各分型的疾病谱结合免疫指标进行逐一排除,进行诊断和鉴别诊断。HIV相关性神经系统感染的诊断应当结合临床病史的进展过程及实验室检查可以更进一步明确诊断,达到具有针对性,个性化诊断,更好地服务于临床。
[1]邵一鸣,译.艾滋病病毒与艾滋病的发病机制.北京:科学出版社,2000:171-185.Shao YM. HIV and the Pathogenesis of AIDS. 2ed.Beijing: Sci Press, 2000:171-185.
[2]The National Institutes of Health (NIH)the Centers for Disease Control and Prevention (CDC), and the HIV Medicine Association of the Infectious Diseases Society of America (HIVMA/IDSA). Guidelines for Prevention and Treatment of Opportunistic Infections in HIVInfected Adults and Adolescents[EB/OL]. MMWR, 2009.[Accessed 15 April 2009.]Available from URL: http://aidsinfo.nih.gov/contentf i les/Adult_OI_041009.pdf
[3]McMurtray A, Nakamoto B, Shikuma C, et al.Diffusion-tensor MR imaging of the brain in human immunodeficiency virus–positive patients. Am J Neuroradiol, 2005, 26(9): 2275-2281.
[4]Cingolani A, De Luca A, Ammassari A, et al. PCR detection of Toxoplasma gondii DNA in CSF for the differential diagnosis of AIDS-related focal brain lesions. J Med Microbiol, 1996, 45(6): 472-476.
[5]Beraud G, Pierre-François S, Foltzer A, et al.Cotrimoxazole for treatment of cerebral toxoplasmosis: An observational cohort study during 1994–2006. Am J Trop Med Hyg, 2009, 80(4): 583–587.
[6]Miller RF, Lucas SB, Hall-Craggs MA, et al. Comparison of magnetic resonance imaging with neuropathological fi ndings in the diagnosis of HIV and CMV associated CNS disease in AIDS. J Neurol Neorosurg Psychiatry, 1997,62(4): 346-351.
[7]Bert RJ, Samawareerwa R, Melhem ER. CNS MR and CT fi ndings associated with a clinical presentation of herpetic acute retinal necrosis and herpetic retrobulbar optic neuritis: Five HIV-infected and one non-infected patients.Am J Neuroradiol, 2004, 25(10): 1722–1729.
[8]Wüthrich C, Cheng YM, Joseph JT, et al. Frequent infection of cerebellar granule cell neurons by polyomavirus JC in progressive multifocal leukoencephalopathy. Neuropathol Exp Neurol, 2009,68(1): 15–25.
[9]Hurley RA, Ernst T, Khalili K, et al. Identif i cation of HIV-associated progressive multifocal leukoencephalopathy:magnetic resonance imaging and spectroscopy. J Neuropsychiatry Clin Neurosci, 2003, 15(1): 1-6.
[10]Ernst T, Chang L, Witt M, et al. Progressive multifocal leukoencephalopathy and human immunodeficiency virus–associated white matter lesions in AIDS:Magnetization Transfer MR imaging. Radiology, 1999,210(2): 539–543.
[11]Miszkiel KA, Hall-Craggs MA, Miller RF, et al. The spectrum of MRI findings in CNS cryptococcosis in AIDS. Clin Radiol, 1996, 51(12): 842-850.
[12]Lee SC, Casadevall A, Dickson DW. Immunohistochemical localization of capsular polysaccharide antigen in the central nervous system cells in cryptococcal meningoencephalitis. Am J Pathol, 1996, 148(4): 1267-1274.
[13]Whiteman M, Espinoza L, Post MJ, et al. Central nervous system tuberculosis in HIV-infected patients: clinical and radiographic findings. Am J Neuroradiol, 1995, 16(6):1319-1327.
[14]Bossolasco S, Cinque P, Ponzoni M, et al. Epstein-Barr virus DNA load in cerebrospinal fluid and plasma of patients with AIDS-related lymphoma. J Neurovirol,2002, 8(5): 432-438.
[15]Connor MD, Lammie GA, Bell JE, et al. Cerebral Infarction in Adult AIDS Patients Observations From the Edinburgh HIV Autopsy Cohort. Stroke, 2000, 31(9): 2117-2126.
[16]Gillams AR, Allen E, Hrieb K, et al. Cerebral infarction in patients with AIDS. Am J Neuroradiol, 1997, 18(8):1581-1585.
[17]Chetty R. Vasculitides associated with HIV infection. J Clin Pathol, 2001, 54(4): 275-278.
[18]McMurtray A, Nakamoto B, Shikuma C, et al. Cortical atrophy and white matter hyperintensities in HIV:The Hawaii aging with HIV cohort study. J Stroke Cerebrovasc Dis, 2008, 17(4): 212–217.
