功能磁共振成像无创性诊断前列腺癌的研究进展
2010-06-02综述审校
张 娜 综述,陈 敏,刘 新* 审校
磁共振成像(magnetic resonance imaging,MRI)以其较高的软组织分辨、任意平面和多参数成像、功能成像、无电离辐射等优点,已成为无创性早期诊断前列腺肿瘤的首选方法[1]。常规T2加权成像(T2 weighted imaging,T2WI)使得前列腺肿瘤的诊断总体上取得了显著进步,然而,其诊断的准确率、特异度和敏感度没有取得突破性进展[2],不能充分满足临床对前列腺肿瘤的诊断需求。此外,MRI对于前列腺中心区域的癌变检测率较低,以及前列腺癌治疗后,一些非癌变区域和癌变区域均呈现低信号,不利于术后追踪和评价[3]。
近年来,MR功能成像,包括扩散加权成像(diffusion weighted imaging,DWI)、动态对比增强MRI(dynamic contrast-enhanced MRI,DCE-MRI)和MR波谱成像(MR spectroscopy,MRS)已广泛应用于前列腺肿瘤的诊断[4,5],可对肿瘤进行定量分析、提供病理生理学等功能性信息以及对前列腺癌进行检测、定位、分期和疗效监测等,明显提高了诊断的准确性,在很大程度上解决了常规T2WI灵敏度和特异度均较低的问题。大量文献报道[4-7],应用MR功能成像较单独应用常规T2WI明显提高诊断的准确性,特别是对中央带前列腺癌的诊断更加有益。然而,各种功能成像方法也存在各自的局限性[8]。本文综述了DWI、DCE-MRI和MRS这三种功能成像用于前列腺癌诊断的原理、意义及存在的问题,为发展更好的诊断方法提供了参考信息,以期进一步提高前列腺癌诊断的准确性。
1 扩散加权成像
DWI是目前观察活体组织中水分子的微观扩散运动并定量测量和成像的方法,通过显示和定量测定组织内微观环境中水分子扩散特性,提供各部分组织的空间结构信息。
1.1 诊断基本原理
DWI反映了局部环境中水分子扩散程度。前列腺含有大量腺体组织,细胞间空间大,水分子扩散受约束小,扩散程度强;而癌变区域包膜密度大,水分子扩散受到约束,扩散程度小,这是DWI很好地区分正常腺体组织和癌变区域的机理[9]。
1.2 技术原理与定量指标计算
衡量水分子扩散大小的数值称为扩散系数,用D表示,即一个水分子单位时间内自由随机扩散运动的平均范围,单位是mm2/s。 D值越大,水分子扩散运动越强。可用如下公式描述:

其中,S和S0分别为施加和未施加扩散敏感梯度磁场的信号强度。b为扩散加权因子,b=γ2δ2G2(△-δ/3)。γ为旋磁比,δ、G、△分别为扩散敏感梯度脉冲的宽度、强度、间隔。b 值为常数,由施加的梯度场强的参数来控制。b值越大对水分子的扩散运动越敏感,可引起较大的信号衰减。
在人体生理环境中,D值受多种因素影响,所以常用表观扩散系数(apparent diffusion coeff i cient,ADC)来衡量水分子在人体组织环境中的扩散运动,即把影响水分子运动的所有因素(随机和非随机)都叠加成一个观察值,反映扩散敏感梯度方向上的水分子位移强度。根据Stejskal-Tanner公式,ADC表示为如下式:

式中,S2与S1是不同b值条件下的信号强度。DWI即利用ADC值分布成像。ADC值越高,组织内水分子扩散运动越强,在DWI图上表现为低信号,相反ADC值越低,DWI图上表现为高信号。
1.3 DWI临床诊断的优越性和存在的挑战
大量研究表明[10-13],比起传统的T2WI,DWI和T2WI的联合应用提高了对前列腺癌诊断的准确率、特异度和敏感度,有研究指出[8,12,13],联合应用的诊断准确率、特异度和敏感度分别为78%~88%、81%~88%和69%~78%。
然而,由于许多非癌变情况会减小扩散,例如良性前列腺增生(benign prostatic hyperplasia,BPH)和前列腺炎(prostatitis),特别是由BPH所引起的前列腺形态变化会极大地影响扩散特性,导致DWI的定量参数ADC值对于前列腺癌变组织与非癌变组织的估计存在很大的重叠[14]。此外,DWI的成像速度和图像信噪比也不能完全满足临床诊断的需求。虽然DWI不能单独用于对前列腺癌进行最终评估,但该技术在前列腺癌诊断方面显示出了潜在的优势,因此,DWI用于诊断前列腺癌的技术有待进一步提高。
2 动态对比增强MRI
DCE-MRI是一种反映组织微循环血流灌注情况的MR检查方法,它基于顺磁性对比剂注入血管导致组织T1缩短这一事实,使用重复成像记录组织信号强度的变化以跟踪对比剂随时间扩散到周围组织中的情况,是研究肿瘤微血管渗漏特征的定量MRI技术。
2.1 诊断基本原理
在肿瘤生长过程中,微血管内皮生长因子(vascular endothelial growth factor,VEGF)的分泌,使得肿瘤新血管生成调控紊乱。与正常血管相比,肿瘤内新生血管不成熟、基底膜不完整以及内皮细胞间隙增宽等,导致其通透性增高。多数研究表明,微血管通透性是与新生血管生成速率密切相关的重要指标[15,16]。DCE-MRI技术可获得微血管通透性的定量指标,从而实现了对前列腺癌的活体无创性诊断。
2.2 技术原理与定量指标计算
对比剂从血管(血浆)空间渗漏到血管外细胞外空间(extravascular extracellular space,EES)的体积转运常数可用Ktrans表示,它可定量地表述微血管通透性。当团注对比剂充足(即对比剂渗漏到周围组织的提取速率小于对比剂的灌注补给速率),Ktrans等于每单位体积的微血管壁通透率(permeability)与其表面积(surface)的乘积(PSρ),PS(ml·g-1·min-1)为每单位质量组织的微血管壁通透率和其表面积的乘积,ρ(g/ml)为组织密度;当团注对比剂不足,对比剂在血管(血浆)空间和EES之间转运的动力学过程主要由血流灌注决定,Ktrans=Fρ(1-Hct)。
根据Tofts理论[17],对比剂浓度在血管(血浆)空间和EES之间的转移可用如下微分方程表示:

式中,Ce(t)和Cp(t)分别为EES和血管(血浆)空间中随时间变化的对比剂浓度,Ve为EES分数容积。
对比剂的渗漏造成局部组织弛豫率的增加,见下式:
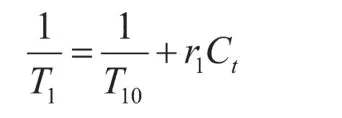
而增强的弛豫率表现为T1加权信号的增强,利用DCE-MRI技术重复采集的一系列记录T1加权信号变化的动态图像,根据Tofts数据分析模型可测得Ktrans、Ve等定量参数。
Ktrans值量化了微血管通透性的程度,Ktrans值越高,微血管通透性越大,相应的肿瘤恶性程度也越高。
2.3 DCE-MRI临床诊断的优越性和存在的挑战
有研究表明[18-20],利用DCE-MRI技术获得的参数,如Ktrans、Ve、Kep、时间-信号强度曲线的初始增强率、曲线下面积以及曲线的峰值均可用于区分前列腺癌变组织与非癌变组织。有学者测得这些参数用于诊断前列腺癌的准确率、特异度和灵敏度分别为87%~95%、87%~88%和87%~90%,均明显高于常规T2WI诊断方法的结果[18]。
然而,DCE-MRI目前还存在一定的缺陷,其数据分析模型会造成对Ktrans值估计过高或过低[21],导致Ktrans值在癌变区域和过渡带组织上有很大的重叠,使得检测特异性大大降低,特别是因为BPH所引起的血管增生[20]。此外,MRI-DCE参数众多,使得医生难以从图像中提取直接信息[22],因此,MRIDCE的数据处理模型需要进一步研究优化,以进一步提高各参数测量值的准确性,从而进一步提高前列腺癌诊断的准确性、特异性和敏感性。
3 磁共振波谱成像
MRS作为一种无创性研究活体器官组织代谢、生化变化及化合物定量分析的方法,以分子水平了解人体生理上的变化,从而对疾病的早期诊断、预后及鉴别诊断、疗效追踪等方面作出更明确的结论,在临床上的应用日益广泛。
3.1 诊断基本原理
MRS反映局部组织代谢物成分和代谢速率。在正常组织中,代谢物在物质中以特定的浓度存在,当组织发生病变时,代谢物浓度会发生改变。枸橼酸盐(Citrate,Cit)、胆碱(Choline,Cho)和肌酸(Creatine,Cre)是前列腺MRS检查中最易观察到的代谢物。正常前列腺代谢物以Cit为主,而癌变区域的代谢物则以氧化枸橼酸盐为主;Cho与细胞膜的合成与降解有关,前列腺癌组织的细胞增殖速度快,细胞膜合成与降解活跃,因此癌变区域的Cho水平明显增高。Cho/Cit比例与前列腺癌体积相关,是检测前列腺癌的重要特征,目前多用水脂抑制的氢谱分析[23]。
3.2 技术原理与定量指标计算
MRS利用化学位移的作用来确定代谢物的种类和含量。研究某种样品物质的磁共振频谱时,常选用一种物质做参考基准,以它的共振频率作为频谱图横坐标的原点,将不同种原子基团中的核的共振频率相对于坐标原点的频率之差作为该基团的化学位移。
利用波谱峰的高度和峰的宽度计算峰下面积,该面积反映一个原子基团中参与磁共振的核的数量,代谢物的峰下面积与所测的代谢产物的含量成正比。直接测峰下面积可对代谢物做半定量分析;比较频谱中各个峰的面积能确定出不同分子或原子基团中产生共振的核的相对数量,对代谢物做相对定量分析;将各共振峰的相对面积与参考标准进行比较可以推算样品分子或化学基团中共振核的绝对数目,计算出代谢产物含量的绝对值。
由于Cit、Cho、Cre等代谢物的浓度显著低于水和脂肪,产生的信号几乎是正常MR成像中水信号的万分之一,需要重复多次采集才能得到信号,所以需要更多的扫描时间,限制了MRS测定代谢物浓度变化的时间分辨率。
3.3 MRS临床诊断的优越性和存在的挑战
MRS已广泛应用于前列腺癌的良恶性诊断、肿瘤体积测量、侵袭性评价以及放疗方案设计和放疗后随访中,通常MRS和常规T2WI一起使用,以提高检测率和显示效果[24]。最近,Albers等人[25]提出了一种使用超极化13C标记的丙酮酸盐的杰出新技术,该技术基于前列腺癌组织的糖酵解增加这一事实对前列腺癌进行诊断,提高了磁共振成像用于前列腺癌检测与特性评价的准确性。与常规MRS相比,该技术不但增加了诊断前列腺癌的敏感性,同时也提高了对肿瘤进行病理分级的准确性。该研究指出,通过注入超极化13C丙酮酸盐后测得的超极化乳酸盐可作为一种新的生物标记物,用于对大鼠前列腺癌进行无创性分级,从而为人体前列腺癌的进一步研究提供了重要参考信息。
然而,作为一种新兴技术,MRS在前列腺中的应用尚处于起步阶段,还存在一些问题,如数据采集时间长、数据处理主观性强、对较小病灶的敏感性不高以及缺乏对前列腺周边组织的直观显示能力等。但随着MRS技术(如成像序列等)的发展、装置的不断改进、相应软件的研发以及临床研究的不断深入,这些问题将逐步被解决,为临床前列腺癌的诊断、鉴别、分期、治疗和预后提供更多有重要价值的信息。
4 3 T高场强下MR功能成像技术的应用
3 T高场强MR具有更高的图像信噪比、更高的空间分辨率、更快的扫描速度等优点,是神经系统、骨骼系统、体部(前列腺)等诊断的最重要的工具。3 T MR一个无可比拟的优势就在于它具有更强大的功能成像手段,具有无创、更准确、更高的特异度和敏感度。因此,发展3 T功能MRI技术是临床诊断前列腺肿瘤的必然趋势。由于欧美国家前列腺疾病十分普遍,因此较早地开展了许多相关工作,3 T MRI已经在临床上广泛应用[25-29],国内多数报道的是1.5 T MRI用于前列腺诊断的研究,而3 T MRI的临床应用才刚刚起步。
3 T功能MRI技术(包括DWI、DCE-MRI和MRS)提高了前列腺肿瘤的诊断准确率,但三种方法的单独使用都还存在各自的局限性,诊断的特异度还不够高。目前,一些研究提出了许多改进常规T2WI、DWI、DCE-MRI和MRS的检测率的方法,其中多数以上述四种方式的两两组合作为诊断依据[3,4,14,18,23,24,30],检测率大大提高。然而,仅有少量的文献报道了DWI序列优化和为了得到更好的对比度噪声比(contrast noise ratio,CNR)时的b值选取、各种功能MRI技术的比较和结合,尚缺乏建立优化的DCE-MRI数据处理模型、MRS成像序列等方面的研究,因此,优化快速成像序列以提高DWI的成像速度和空间分辨率,优化数据分析模型以更加准确地评估DCE-MRI的定量参数,从而提高前列腺肿瘤测量值的准确性与鲁棒性,是目前的热点研究问题。
5 总结
DWI、DCE-MRI和MRS这三种功能MRI技术用于前列腺癌的诊断,大大提高了对前列腺癌检测和定位的准确性。各种参数用于前列腺肿瘤的定量分析,可对其进行良恶性诊断、体积测量、疗效评估以及用于放疗剂量的确定等。通过提高各种技术的图像获取与处理的准确性,可提高各参数的精确性和可重复性,从而可进一步提高诊断的特异性与敏感性,为临床诊断提供更加有用的参考信息。
[1]Morakkabati-Spitz N, Bastian PJ, Gieseke J, et al. MR imaging of the prostate at 3.0T with external phased array coil-preliminary results. Eur J Med Res, 2008, 13(6): 287-291.
[2]Shimizu T, Nishie A, Ro T, et al. Prostate cancer detection:the value of performing an MRI before a biopsy. Acta Radiol, 2009, 50(9):1080-1088.
[3]Hricak H, Choyke PL, Eberhardt SC, et al. Imaging prostate cancer: a multidisciplinary perspective. Radiology,2007, 243(1): 28-53.
[4]Kitajima K, Kaji Y, Fukabori Y, et al. Prostate cancer detection with 3 T MRI: Comparison of diffusionweighted imaging and dynamic contrast-enhanced MRI in combination with T2-weighted imaging. J Magn Reson Imaging, 2010, 31(3):625-631.
[5]Langer DL, van der Kwast TH, Evans AJ, et al. Prostate cancer detection with multi-parametric MRI: logistic regression analysis of quantitative T2, diffusion-weighted imaging, and dynamic contrast-enhanced MRI. J Magn Reson Imaging, 2009, 30(2):327-334.
[6]Choi YJ, Kim JK, Kim N, et al. Functional MR imaging of prostate cancer. Radiographics, 2007, 27(1):63-75.
[7]Jacobs MA, Ouwerkerk R, Petrowski K, et al. Diffusionweighted imaging with apparent diffusion coefficient mapping and spectroscopy in prostate cancer. Top Magn Reson Imaging, 2008, 19(6):261-272.
[8]Kim JK, Jang YJ, Cho G, Multidisciplinary functional MR imaging for prostate cancer. Korean J Radiol, 2009,10(6):535-551.
[9]DeSouza NM, Riches SF, Vanas NJ, et al. Diffusionweighted magnetic resonance imaging: a potential noninvasive marker of tumour aggressiveness in localized prostate cancer. Clin Radiol, 2008, 63(7):774-782.
[10]Ren J, Huan Y, Li F, et al. Combined T2-Weighted and Diffusion-Weighted MRI for Diagnosis of Urinary Bladder Invasion in Patients with Prostate Carcinoma. J Magn Reson Imaging, 2009, 30(2):351-356.
[11]Ren J, Huan Y, Wang H, et al. Seminal vesicle invasion in prostate cancer: prediction with combined T2-weighted and diffusion-weighted MR imaging. Eur Radiol, 2009,19(10):2481-2486.
[12]Lim HK, Kim JK, Kim KA, et al. Prostate cancer:apparent diffusion coefficient map with T2-weighted images for detection-a multireader study. Radiology,2009, 250(1):145-151.
[13]Morgan VA, Kyriazi S, Ashley SE, et al. Evaluation of the potential of diffusion-weighted imaging in prostate cancer detection. Acta Radiol, 2007, 48(6):695-703.
[14]Haider MA, van der Kwast TH, Tanguay J, et al.Combined T2-weighted and diffusion-weighted MRI for localization of prostate cancer. AJR Am J Roentgenol,2007, 189(2): 323-328.
[15]Kim JK, Hong SS, Choi YJ, et al. Wash-in rate on the basis of dynamic contrast-enhanced MRI: usefulness for prostate cancer detection and localization. J Magn Reson Imaging, 2005, 22(5):639-646.
[16]Jackson MW, Bentel JM, Tilley WD. Vascular endothelial growth factor (VEGF)expression in prostate cancer and benign prostatic hyperplasia. J Urol, 1997, 157(6):2323-2328.
[17]Tofts PS, Brix G, Buckley DL, et al. Estimating Kinetic Parameters From Dynamic Contrast-Enhanced T1-Weighted MRI of a Diffusable Tracer: Standardized Quantities and Symbols. J Magn Reson Imaging, 1999,10(3):223-232.
[18]Futterer JJ, Heijmink SW, Scheenen TW, et al. Prostate cancer localization with dynamic contrast-enhanced MR imaging and proton MR spectroscopic imaging.Radiology, 2006, 241(2):449-458.
[19]Buckley DL, Roberts C, Parker GJ, et al. Prostate cancer:evaluation of vascular characteristics with dynamic contrast-enhanced T1-weighted MR imaging – initial experience. Radiology, 2004, 233(3):709-715.
[20]Engelbrecht MR, Huisman HJ, Laheij RJ, et al.Discrimination of prostate cancer from normal peripheral zone and central gland tissue by using dynamic contrastenhanced MR imaging. Radiology, 2003, 229(1):248-254.
[21]Buckley DL. Uncertainty in the analysis of tracer kinetics using dynamic contrast-enhanced T1-weighted MRI.Magn Reson Med, 2002, 47(3):601–606.
[22]Vos PC, Hambrock T, Hulsbergen-van DKC, et al.Computerized analysis of prostate lesions in the peripheral zone using dynamic contrast enhanced MRI.Med Phys, 2008, 35(3):888-899.
[23]Zakian KL, Sircar K, Hricak H, et al. Correlation of proton MR spectroscopic imaging with gleason score based on step-section pathologic analysis after radical prostatectomy. Radiology, 2005, 234(3):804-814.
[24]Shukla-Dave A, Hricak H, Kattan MW, et al. The utility of magnetic resonance imaging and spectroscopy for predicting insignif i cant prostate cancer: an initial analysis.BJU Int, 2007, 99(4):786-793.
[25]Mark J. Albers, Robert Bok, Albert P. Chen, et al.Hyperpolarized 13C Lactate, Pyruvate, and Alanine:Noninvasive Biomarkers for Prostate Cancer Detection and Grading. Cancer Res, 2008, 68(20):8607-8615.
[26]Kim CK, Park BK, Kim B. Localization of prostate cancer using 3T MRI: comparison of T2-weighted and dynamic contrastenhanced imaging. J Comput Assist Tomogr, 2006, 30(1):7-11.
[27]Kim CK, Park BK, Kim B. High-b-value diffusionweighted imaging at 3 T to detect prostate cancer:comparisons between b values of 1,000 and 2,000 s/mm2.AJR Am J Roentgenol, 2010, 194(1):W33-7.
[28]Kim CK, Park BK, Park W, et al. Prostate MR imaging at 3T using a phased-arrayed coil in predicting locally recurrent prostate cancer after radiation therapy: preliminary experience. Abdom Imaging, 2010, 35(2):246-252.
[29]Kim CK, Park BK, Lee HM. Prediction of locally recurrent prostate cancer after radiation therapy:incremental value of 3T diffusion-weighted MRI. J Magn Reson Imaging, 2009, 29(2):391-397.
[30]Cirillo S, Petracchini M, Della MP, et al. Value of endorectal MRI and MRS in patients with elevated prostate-specific antigen levels and previous negative biopsies to localize peripheral zone tumours. Clin Radiol,2008, 63(8):871-879.
