香菇总黄酮抗油脂氧化作用研究1)
2010-06-02缪成贵韩飞园钟敏
缪成贵,韩飞园,钟敏
(安徽科技学院,安徽 凤阳 233100)
食品中常用的抗氧化剂丁基羟基茴香醚,二丁基羟基甲苯,叔丁基对苯二酚,没食子酸丙酯等,由于毒性和致癌作用等原因,许多国家已停止或严格限制其使用。寻找和开发天然、无毒的天然抗氧化剂已成为人们关心的焦点。黄酮类化合物[1-4]广泛存在于植物体内,无不良反应,同时还有显著的清除人体内自由基、抗老化、抗突变、调血脂、降血压等药理保健功能[5],是一类极具开发前景的天然有机抗氧化剂[6]。香菇在我国种植广泛,资源极其丰富,是人们十分喜爱的一种食用真菌。目前食用真菌的活性成分研究主要集中在多糖类成分,黄酮类成分的研究较少,本文以香菇总黄酮为研究对象,考察了香菇总黄酮的提取工艺和抗油脂氧化作用。为香菇的采后深加工和从食用真菌中制备黄酮类天然抗氧化剂提供参考。
1 材料与方法
1.1 实验材料
香菇,安徽科技学院食用菌研究所提供;芦丁标准样品,上海嘉韦化学试剂有限公司;756MC紫外光分光光度计,上海精密科学仪器有限公司;所用试剂均为分析纯。
1.2 方法
1.2.1 正交试验设计。以香菇总黄酮含量为考察指标,选择乙醇浓度、加醇量、提取时间作为考察的三个影响,按3因素3水平进行L9(34)正交试验设计[7-8],香菇因素水平见表1。
1.2.2 样品溶液的制备。称取香菇15.3g,置500mL圆底烧瓶配套的索氏提取器中,圆底烧瓶上接索氏提取器,用石油醚脱脂1.5h,按因素水平表分别用不同浓度的乙醇回流提取,回收乙醇,用蒸馏水定容至500 mL[9-11]。
1.2.3 对照品溶液的制备[12]。精密称取120℃度干燥至恒重的芦丁200mg置100mL容量瓶中,加甲醇适量,超声波水浴上微热并振荡约1h使其溶解,冷却,加甲醇至刻度,摇匀,精密量取上述试液 10.0mL,置100mL容量瓶中,用蒸馏水稀释至刻度,摇匀即得芦丁标准液(每1mL含无水芦丁0.2mg)。

表1 香菇正交试验因素水平表
1.2.4 油脂抗氧化作用的测定。采用烘箱储藏法测定[13]。将纯猪油及添加一定量的香菇提取物溶液的猪油置于65℃烘箱,按照国家标准GB/55438-85,每隔一定时间测定并计算其过氧化值(POV)。即精密称取2~3 g混匀的样品,置于250mL碘量瓶中,加入氯仿-冰醋酸(2∶3)混合液30mL,使样品完全溶解加饱和碘化钾溶液1mL,加塞、摇匀,在暗处放置3min,加水50mL,摇匀后立即用0.02mol/L硫代硫酸钠标准溶液滴定至淡黄色时,加0.5%淀粉指示剂1mL,继续滴定至蓝色消失为止。同时以空白试剂滴定为参比。
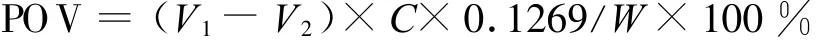
其中,V1和V2分别为样品和空白试剂消耗Na2S2O3标准溶液的体积(mL);C为硫代硫酸钠溶液的浓度(mol/L),W为样品质量(g);0.1269为1mg硫代硫酸钠相当碘的质量数(g)。
2 结果与分析
2.1 测定波长的确定
精密量取芦丁标准液4mL置25mL容量瓶。加5%亚硝酸钠溶液1.0mL使混匀。放置6min。加10%硝酸铝溶液1.0mL,摇匀,放置6min。加1%氢氧化钠溶液10.0mL,再加水至刻度,摇匀。放15min。置比色皿中。在波长400~700nm范围内进行扫描,从而选择最大吸收处为测定波长。通过扫描图可以确定:芦丁标准液在约510nm波长处吸收最大。因此实验中黄酮类物质分析吸收波长确定为510nm。
2.2 标准曲线的绘制
精密量取标准品溶液 1 、2、3、4 、5、6mL,分别置于25mL容量瓶,各加蒸馏水至6mL,加5%NaNO2溶液1mL,摇匀。放置 6min,加 10%Al(NO3)3溶液 1mL,摇匀,放置6 min,加4%NaOH 溶液10mL。再加水至刻度,摇匀,放置15 min,以相应试剂为空白对照,照紫外分光光度法,在510nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得方程:y=8.8214x,R2=0.9998。

图1 芦丁标准液吸收波长扫描图
2.3 精密度试验
精密吸取芦丁对照品溶液3.0mL于25mL量瓶中,共3份,按上述方法显色后于510 nm处测定吸收度。每份测定4次,记录吸光度值。这些吸光度值的RSD为1.764%。表明本方法有较高的精密度。
2.4 回收率试验
精密称定香菇总黄酮提取液样品约30mL左右,共3份,加入一定量的芦丁对照品,计算回收率。结果见表2。

表2 香菇的回收率试验
2.5 黄酮的测定
用吸量管精密吸取3mL提取液,置于25mL容量瓶中,加蒸馏水至6.0mL,加5%NaNO2溶液1mL摇匀,放置6 min,加 10%Al(NO3)3溶液 1mL,摇匀,放置6 min,加4%NaOH 溶液10mL,再加水至刻度,摇匀,放置15min,以相应试剂为空白,在756MC紫外分光光度计510nm波长处测定吸光度。
2.6 正交试验结果
香菇总黄酮提取正交试验中各因素和水平之间的9种组合方式及每组结果见表3。方差分析结果见表4。由表3、4结果可知,在乙醇提取香菇总黄酮的影响因素中,乙醇浓度的影响最显著,加醇量和提取时间影响较小,理论条件为A1B1C1,但考虑到提取时间和乙醇量的极差很小,更为经济的条件为A1B3C3,即15.3g的香菇提取黄酮的最合理条件为200mL 95%的乙醇提取1h。
2.7 香菇总黄酮对猪油的抗氧化活性
将纯猪油及添加0.20%、0.40%、0.60%香菇总黄酮提取液的猪油样品置于65℃恒温烘箱中,间隔3天测定,计算其POV值,结果见表5。可见,香菇总黄酮对猪油的氧化具有明显的抑制作用,且随着质量分数的增大其抗氧化能力增强。

表3 香菇正交试验结果
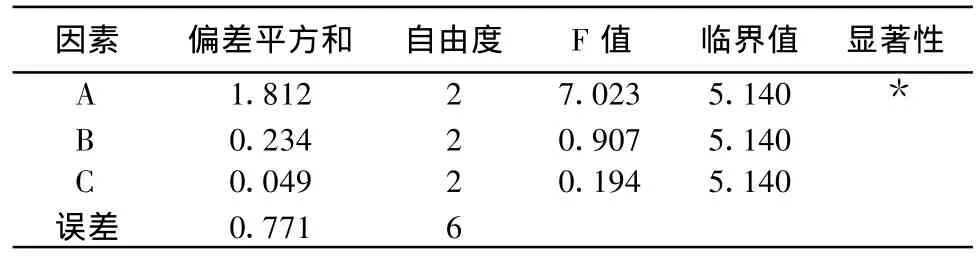
表4 香菇方差分析结果
3 结论与讨论
本实验以香菇总黄酮含量为考察指标,选择乙醇浓度、加醇量、提取时间作为考察的3个影响,按3因素3水平进行L9(34)正交试验设计,并设计了误差列,考察乙醇浓度、加醇量、提取时间3个因素对其总黄酮提取的影响。理论条件为A1B1C1,但考虑到提取时间和乙醇量的极差很小,更为经济的条件为A1B3C3,即15g的香菇提取黄酮的最合理条件为200mL95%的乙醇提取1h。方差分析中[14],加醇量、提取时间的偏差平方和与误差列的偏差平方和相差不大或其值很小而无太大的统计学意义,因此在F检验时将加醇量、提取时间的偏差平方和误差列的偏差平方和累加,其自由度也相应的累加计算F值。采用烘箱储藏法测定香菇总黄酮抗油脂氧化作用,结果表明,香菇总黄酮对猪油的氧化具有明显的抑制作用,且随着质量分数的增大其抗氧化能力增强。

表5 香菇总黄酮对猪油的抗氧化作用
[1]唐传核,彭志英.大豆异黄酮的生理功能概述[J].粮油食品科技,2000,4(8):15-17.
[2]马晓丽.生物类黄酮的研究进展[J].山西职工医学院学报,2005,15(5):70-73.
[3]杨建雄.连翘叶黄酮的体外抗氧化作用[J].天然产物研究与开发,2007,19:97-99.
[4]荆文静.竹叶中黄酮类化合物研究进展[J].科技情报开发与经济,2009,19(20):110-112.
[5]华辉,郭勇.黄酮类化合物药理研究进展[J].广东药学,1999,9(4):9-12.
[6]Zhu Z F,Zhu S M,Shen X H.Studies on the extraction method of flavones antioxidant from fruiter leaf and antioxidant p roperties[J].China West Cereals Oils Technol(西部粮油科技),2002(4):48-50.
[7]王峰,蔡光明,刘军,等.正交试验法优选白术挥发油提取工艺[J].解放军药学学报,2009,25(4):311-315.
[8]崔援军,蔡中琴,臧文华.正交设计优选怀菊花总黄酮提取工艺[J].河南中医学院学报,2006,3:33-34.
[9]卫修来,陈镇,夏泉,等.索氏提取法提取白术内酯Ⅰ的工艺研究[J].时珍国医国药,2009,20(6):1427-1430.
[10]周玉新,于绪平,陈玮,等.索氏提取法提取韭菜籽油的工艺研究[J].科研与开发,2007,10(6):1-4.
[11]康军民,任卫琼.正交试验法优选烧伤膏中醇提部分的提取工艺[J].制剂技术,2009,18(5):31-35.
[12]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:17,173.
[13]孔 琪,吴 春.菊花黄酮的提取及抗氧化活性研究[J].中草药,2004,9(35):1001-1002.
[14]薛香,梁云娟,郜庆炉.农业科研中应用Excel进行方差分析的方法[J].现代化农业,2009,8:48-50.
