猪戊型肝炎病毒ORF2蛋白C端主要抗原表位区的原核表达*
2010-05-31冉旭华闻晓波李冬野侯喜林
冉旭华,闻晓波,王 密,李冬野,侯喜林
(黑龙江八一农垦大学动物科技学院预防兽医学省重点实验室,黑龙江大庆 163319)
猪戊型肝炎病毒ORF2蛋白C端主要抗原表位区的原核表达*
冉旭华,闻晓波*,王 密,李冬野,侯喜林
(黑龙江八一农垦大学动物科技学院预防兽医学省重点实验室,黑龙江大庆 163319)
利用分子生物学软件分析GenBank公布的猪戊型肝炎病毒DQ1株ORF2的氨基酸序列,确定了其C端抗原性较高的区域,针对此区域设计并合成了一对特异性引物,RT-PCR扩增该区域,并将此片段克隆到原核表达载体pET30a(+)上,命名为pET30a-ORF2C,然后转化大肠埃希菌 BL21感受态细胞,1.0 mmol/L IPTG 37℃诱导表达。结果表明,RT-PCR扩增得到301 bp的片段,重组蛋白大小约为18 ku,与预期大小相符。Western blot分析表明,该蛋白与阳性血清发生特异性反应,为进一步利用其建立诊断方法奠定了基础。
猪戊型肝炎病毒;ORF2;主要抗原表位区;表达
戊型肝炎(Hepatitis E,HE)是由戊型肝炎病毒(Hepatitis E virus,HEV)引起的、经消化道传播的急性病毒性肝炎,其临床表现为发热、食欲不振、恶心、呕吐、尿色深黄、常见黄疸,病程可持续1周,但具有自限性[1]。该病主要发生于卫生条件较差的发展中国家。HEV可在多种动物体内分离到,1997年美国发现了猪戊型肝炎病毒,且与人HEV具有较高的同源性,随后证实其为一种人畜共患病病原,因其具有重要的公共卫生意义而备受重视[2]。
猪戊型肝炎病毒(Swine hepatitis E virus,SHEV)属杯状病毒科,为无囊膜的单股正链 RNA病毒,直径 27 nm~32 nm,表面粗糙,呈不规则球形。基因组全长约为7.2 kb~7.6 kb,5′端有27 bp的非编码区,基因组编码3个开放阅读框架ORF1、ORF2和 ORF3[3]。ORF1编码与病毒复制有关RNA依赖性RNA聚合酶;ORF2编码病毒的衣壳蛋白,富含重要的抗原表位;ORF3编码磷蛋白,可能为型特异性抗原表位,与特异性免疫反应有关。SHEV目前尚不能进行细胞培养,所以其诊断与检测多使用重组抗原或合成肽抗原,相关研究多是围绕ORF2和ORF3开展的,尤其是其结构蛋白ORF2[4]。
本试验从大庆地区采集的粪便病料中用特异性引物扩增得到SHEV ORF2 C端的主要抗原表位区,使用原核表达系统高效表达,为利用此重组蛋白作为诊断抗原建立检测方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 病料、阳性血清和载体 病料采自大庆地区的1月龄~3月龄仔猪粪便;阳性血清、pMD18-T载体、pET30a(+)载体、大肠埃希菌 TG1、BL21由黑龙江八一农垦大学动物科技学院预防兽医学省重点实验室保存供用;BL21(DE3)pLysS购自Novagen公司。
1.1.2 酶和试剂 ExTaqDNA聚合酶、BamHⅠ、HindⅢ、DNA Marker(DL 2 000)购自宝生物工程(大连)有限公司;鼠源反转录酶购自MBI Fermentas;RNA酶抑制剂、Trizol RNA提取试剂盒购自Invitrogen公司;特异性引物由上海生工生物工程技术服务有限公司合成;胶回收试剂盒购自上海生工生物工程技术服务有限公司;HRP购自Jackson公司;其余试剂为国产分析纯。
1.2 方法
1.2.1 引物 根据GenBank上已发表的SHEV DQ1株序列(DQ279091)[5]设计ORF2 C端主要抗原表位区的特异性引物,委托上海生工生物工程技术服务有限公司合成。引物序列如下(酶切位点下划线):
Upper:5′-AAGGATCCGGCGAGCCGACTGTGAAACTT T-3′(BamH Ⅰ)
Lower:5′-GCGAAGCTTCGGTAGCCACGTTAACAAATGTCAC-3′(Hind Ⅲ)
1.2.2 病毒基因组RNA的提取 粪便用灭菌PBS制成100 mL/L悬液,10 000 r/min离心15 min取上清,置-20℃备用。按照T rizol RNA提取试剂盒使用说明书提取病毒基因组RNA。
1.2.3 PCR扩增 取RNA,参照 MBI Fermentas的使用说明书进行反转录。取上述cDNA进行PCR扩增,反应体系如下:10×PCR buffer 5 μ L,2.5 mmol/L dNT P 4 μ L,引物 1 μ L(上下游引物各0.5 μ L),cDNA 1 μ L,ExTaqDNA 聚合酶 2 U,补水至50 μ L。反应条件为95℃变性5 min;94℃30 s,56℃30 s,72℃30 s,30个循环;72℃延伸10 min。
1.2.4 重组表达载体的构建 回收上述PCR产物连接pMD18-T载体,转化大肠埃希菌TG1感受态细胞,碱裂解法提取质粒,经PCR和酶切鉴定,筛选阳性克隆测序。目的片段酶切后连接到pET30a(+)载体上,转化大肠埃希菌BL21(DE3)pLysS感受态细胞,阳性质粒命名为pET30a-ORF2C。
1.2.5 重组蛋白表达 对重组菌的培养温度和诱导条件进行优化。试验中采用最佳的培养温度和诱导条件进行诱导表达。阳性菌于37℃振荡培养至OD600达0.6~0.8,用终浓度 1.0 mmol/L IPTG于37℃诱导表达5 h,而后取样进行SDS-PAGE电泳分析。
1.2.6 Western blot 经SDS-PAGE电泳后,将凝胶上的蛋白转印至PVDF膜(0.22 μ m)上,50 g/L脱脂奶粉4℃封闭过夜,1∶50倍稀释的SHEV阳性血清室温孵育1 h,PBST洗涤。1∶500倍稀释的辣根过氧化物酶标记的羊抗猪IgG室温孵育1 h,PBST洗涤,DAB显色,进行Western blot分析。
2 结果
2.1 RT-PCR扩增
RT-PCR扩增出1条301 bp的特异性片段,与预期相符(图1),测序结果表明为SHEV ORF2 C端序列。
2.2 重组蛋白的表达
用1.0 mmol/L IPTG,37℃诱导5 h。SDSPAGE电泳检测,结果表明目的蛋白得到了高效表达,重组蛋白分子质量约为18 ku(图2)。
2.3 Western blot分析
表达的重组蛋白经电转移至PVDF膜后,可与SHEV阳性血清发生特异性反应,显色后出现单一且特异的清晰条带(图3)。
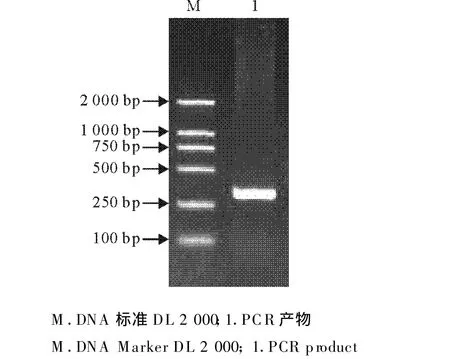
图1 PCR扩增结果Fig.1 Agarose gel electrophoresis of the PCR product
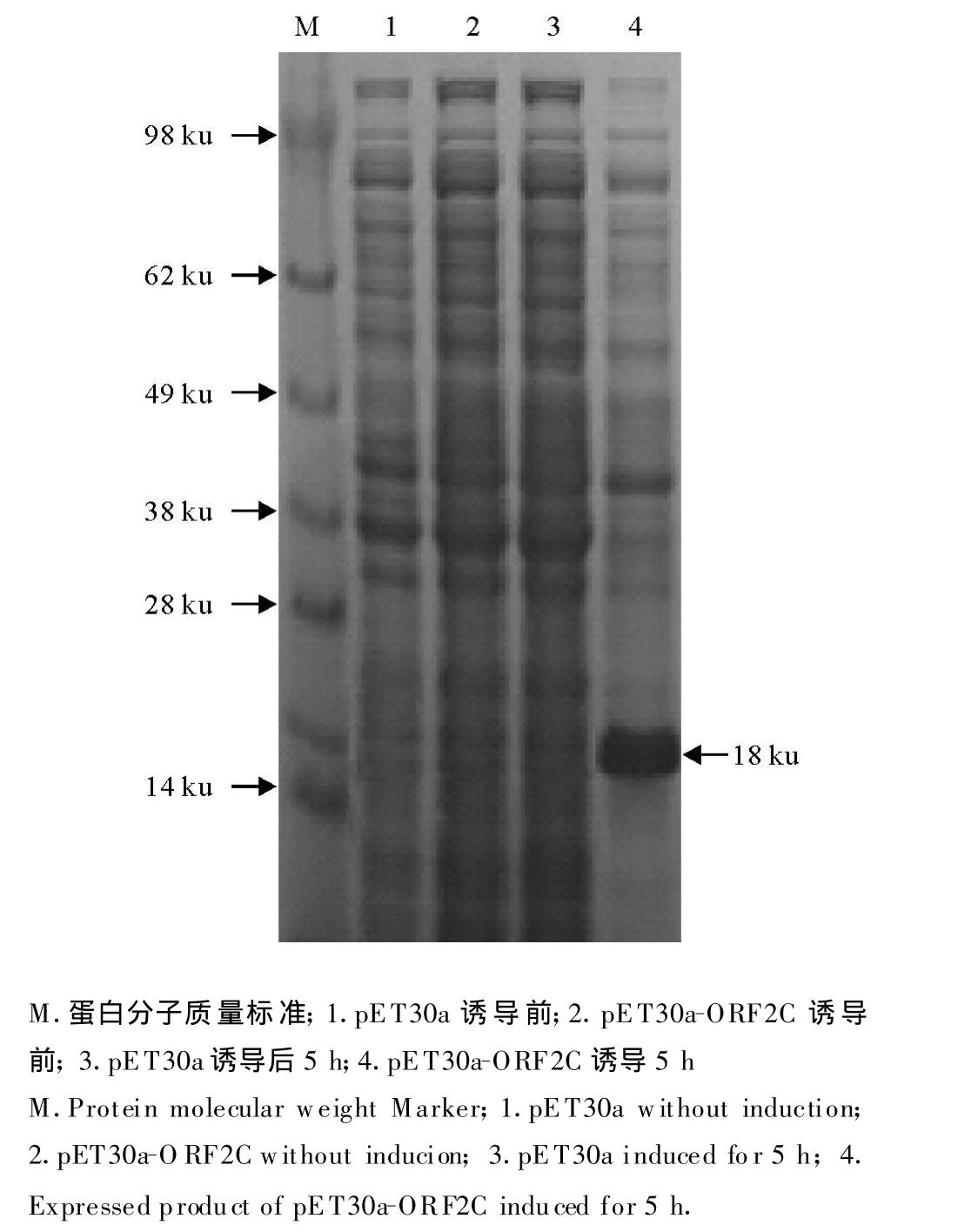
图2 表达蛋白的SDS-PAGE电泳分析Fig.2 SDS-PAGE analy sis of the expressed proteins
3 讨论
戊型肝炎是由戊型肝炎病毒引起的人畜共患病,呈世界性分布,既有散发也有流行,但主要分布在卫生条件较差的发展中国家,在亚洲等发展中国家存在的主要是基因Ⅳ型。最近几年从猪体内也检测到了戊型肝炎病毒,并证实猪戊型肝炎具有重要的公共卫生意义。我国有关SHEV的研究才刚刚开展,流行病学调查表明,在多个省市及地区普遍存在,感染率较高,以基因Ⅳ型为主。

图3 Western blot分析Fig.3 Western blot analy sis
SHEV病毒对体外环境敏感,抵抗力弱,且目前还没有成熟的体外培养系统,这使其诊断和疫苗的研发较为困难。目前该病毒的检测方法主要有ELISA、RT-PCR、血清中和试验、免疫印迹、免疫电镜、免疫荧光等。各种方法各由利弊,ELISA法因其可用于大规模的临床检测而被广泛应用。而由于该病毒培养困难,所以其包被抗原主要采用合成抗原。
SHEV基因组编码的3个ORF中ORF1编码非结构蛋白,抗原性较弱,不适合作为诊断抗原。而ORF2和ORF3编码的蛋白具有较好的抗原活性,是研制SHEV ELISA诊断试剂的主要分子靶标[6]。国内外已有报道利用不同的表达系统(大肠埃希菌、昆虫细胞、杆状病毒和酵母)研究不同区域的免疫原性,用于制备SHEV诊断试剂[7]。研究结果表明,表达抗原对SHEV抗体的敏感性和特异性的次序依次为:含有ORF2和ORF3表达抗原的重组蛋白>ORF2表达抗原>ORF3表达抗原[8]。ORF2编码的衣壳蛋白抗原表位数量较多,特别是其富含疏水区的C端2/3部分,存在多个能诱导免疫保护的免疫优势B细胞抗原表位,是人工制备SHEV诊断抗原的首选区域。
国内学者对SHEV进行了流行病学调查,证实黑龙江省大庆地区有SHEV,且以基因Ⅳ型为主[9],并针对大庆分离的SHEV进行了抗原表位的初步探索与研究[10-11]。本研究在此国内外研究背景下,通过使用DNA Star软件分析已公布的SHEV大庆分离株DQ1株的ORF2氨基酸序列,针对其C端抗原性高的区域设计特异性引物,通过RT-PCR从粪便中扩增得到目的片段,构建了原核表达载体pET30a-ORF2C,经诱导在大肠埃希菌中高效表达。纯化后的蛋白经Western blot鉴定具有良好的生物活性。本研究为下一步利用该重组蛋白作为诊断抗原对大庆地区SHEV进行检测奠定了基础,同时为该病毒结构蛋白抗原表位的筛选提供依据。
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:519-523.
[2]M eng X J,Purcell R H,Halbur P G,et al.A novel virus in swine is closely related to the human hepatitis E virus[J].Proc Natl Acad Sci U S A,1997,94(18):9860-9865.
[3]周锦萍,曾荣誉,孙泉云,等.猪戊型肝炎研究进展[J].动物医学进展,2006,27(8):52-55.
[4]Surjit M,Jameel S,Lal S K.Cy toplasmic localization of the O RF2 protein of hepatitis E virus is dependent on its ability to undergo retrotranslocation from the endoplasmic reticulum[J].J Virol,2007,81(7):3339-3345.
[5]于 敏,曲娟娟,郭 巍,等.猪戊型肝炎病毒大庆株DQ1全基因序列分析[J].中国预防兽医学报,2006,28(5):507-509.
[6]张明程,伊 瑶,刘崇柏,等.用杆状病毒系统表达戊型肝炎病毒全长结构基因的研究[J].中华实验和临床病毒学杂志,2002,16(4):354-356.
[7]屈勇刚,朱光泽,金宁一,等.重组猪源戊型肝炎病毒衣壳蛋白的原核表达及鉴定[J].中国生物制品学杂志,2008,21(3):3181-3184.
[8]张可心.猪戊型肝炎病毒基因 AG02的融合表达及间接ELISA诊断的初步建立[D].黑龙江哈尔滨:东北林业大学,2006.
[9]宋 卓,杨 颖,于 敏,等.大庆市猪戊型肝炎病原基因型分析[J].畜牧兽医科技信息,2006(5):14-15.
[10]于 敏.猪戊型肝炎病毒全基因组序列分析及感染性克隆的构建[D].黑龙江哈尔滨:东北农业大学,2007.
[11]赵宇军,许冬梅,朱远茂,等.猪戊型肝炎病毒结构蛋白片段的表达及其在ELISA中的初步应用[J].畜牧兽医学报,2006,37(11):1198-1201.
Expression of C-terminal Major Epitope Domain of ORF2 of SHEV inE.coli
RAN Xu-hua,WEN Xiao-bo,WANG Mi,LI Dong-ye,HOU Xi-lin
(Provincial K ey Laboratory of Preventive Veterinary Medicine,College of Animal Science and Technology,Heilongjiang Bayi Agricultral University,Daqing,Heilongjiang,163319,China)
To express C-terminal major epitope domain of ORF2 of swine hepatitis E virus(SHEV)inE.coli,C-terminal major epitope domain in ORF2 was primarily mapped upon analysis of Bioinformatic software,according to the amino acid sequence of SHEV DQ1 strain in GenBank.A pair of specific primers were designed to amplify the fragment encoding the major epitope domain.This fragment was cloned into the multiple cloning site of pET30a(+)vector after subjecting to restriction endonuclease digestion.The recombinant plasmid was designated as pET30a-ORF2C,and was transformed intoE.coliBL21 competent cells.Expression of recombinant protein was induced by addition of final concentration of 1.0 mmol/L IPTG under 37℃condition.Results showed that the length of RT-PCR product of interest is 301 base pairs,the size of recombinant protein is 18 ku.The result of Western blot showed that the recombinant protein specifically reacted with serum against SHEV,suggesting the recombinant protein had wonderful specificity,and can be used as antigen in diagnostic assay for measuring antibodies against SHEV in clinical practice.
Swine hepatitis E virus;ORF2;major epitope domain;expression
Q786;S852.659.6
A
1007-5038(2010)01-0024-04
2009-08-21
黑龙江省教育厅科学技术研究面上项目(11521201)
冉旭华(1978-),女,黑龙江人,副教授,博士,主要从事动物病毒分子生物学研究。*通讯作者
