鸟分支杆菌鸟亚种泛酸激酶原核表达及纯化*
2010-05-31陈鸿军刘佩红王水明
陈鸿军,王 伟,刘佩红,王水明,丁 铲*
(1.中国农业科学院上海兽医研究所,上海 200241;2.上海市动物疫病预防控制中心,上海 200102;3.江苏省出入境检验检疫局,江苏南京 211000)
鸟分支杆菌鸟亚种泛酸激酶原核表达及纯化*
陈鸿军1,王 伟1,刘佩红2,王水明3,丁 铲1*
(1.中国农业科学院上海兽医研究所,上海 200241;2.上海市动物疫病预防控制中心,上海 200102;3.江苏省出入境检验检疫局,江苏南京 211000)
为了寻找分支杆菌耐药菌的新药靶点,根据GenBank的相应序列,利用特异性引物经PCR扩增获得了鸟分支杆菌鸟亚种的泛酸激酶基因,将该基因亚克隆入pET32a(+)载体中,经IPTG诱导和SDSPAGE检测。结果表明,该基因成功获得表达,并以可溶性蛋白形式存在,利用His纯化试剂盒获得了纯化产物,为下一步进行酶活性测定、酶活性位点的突变及合成酶类似物等研究奠定了基础。
鸟分支杆菌鸟亚种;泛酸激酶;可溶性表达
结核病(Tuberculosis)已成为仅次于艾滋病的第二大致死性疾病,而且常与艾滋病共感染,患者体内出现播散性鸟分支杆菌(Mycobacterium avium)感染,这些分离株对抗结核药物具有广谱耐受性。这使得结核病成为人类及动物的重大威胁,而研制新的抗结核药物已成为当前最重要的课题之一[1-2]。
泛酸激酶(Pantothenate kinase,PanK)在分支杆菌中由coaA编码。该酶是辅酶A(CoA)合成的关键性限速酶,在能量代谢和细胞壁的生物合成过程中,发挥至关重要的作用[2]。泛酸激酶功能保守,但在进化上高度分化。因此,这使得泛酸激酶成为药物研发的潜在靶点,如一些泛酸类似物可被泛酸激酶磷酸化,进入CoA的合成途径,生成无活性的CoA类似物,阻断下游代谢途径,从而发挥疗效[4-5]。
鸟分支杆菌病是由鸟胞内分支杆菌复合体(M.aviumcomplex或M.aviumintracellulare complex,MAC)引起的重要人畜共患病[1]。MAC感染后可侵害多种组织器官包括肺、骨髓和淋巴结等。鉴于鸟分支杆菌的coaA基因编码相同功能的泛酸激酶,亦可考虑作为抗结核药物潜在的靶点。而目前国内外有关鸟分支杆菌coaA基因体外表达及相关功能的研究报道很少[2-3]。因此,本研究拟对鸟分支杆菌鸟亚种的泛酸激酶进行克隆和表达,旨在为寻找抗鸟分支杆菌新的药物靶标奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 鸟分支杆菌鸟亚种(M.aviumsubsp.avium)ATCC15769株购自上海市肺科医院检验科;大肠埃希菌工程菌DH5α、大肠埃希菌表达菌BL21(DE3)购于天根公司;pET-32a(+)载体购自Merck公司。
1.1.2 主要试剂TaqDNA聚合酶、dNTP、限制性内切酶BamHⅠ、HindⅢ、EcoRⅠ、pGEM-T easy载体为宝生物工程(大连)有限公司产品;His◦Bind?kits购自Novagen公司;ECL显色试剂盒购自Pierce公司;彩色预染蛋白质分子质量Marker和6×His抗体购自碧云天生物技术研究所。
1.2 方法
1.2.1 基因组DNA的提取 吸取500 μ L细菌培养物,经高压灭活,12 000 r/min离心5 min,弃上清,沉淀物中加1 mL 50 g/L NaOH 并振荡混合,室温静置10 min,然后以12 000 r/min离心5 min,弃上清,沉淀物用1 mL TE溶液悬浮,离心重新收集菌体;用 400 μ L TE 溶液 悬 浮,加 20 μ L 溶菌酶(50 mg/mL),RNase 10 μ L(10 mg/mL),60 ℃水浴60 min;加入 10 μ L 蛋白酶 K(10 mg/mL)和50 μ L 100 g/L SDS溶液,60℃水浴60 min;冰上冷却后取出,按常规酚-氯仿抽提法提取DNA。
1.2.2 扩增结核杆菌coaA基因序列 根据Gen-Bank中M.avium coaA基因(登录号:NC-002944)序 列 设 计 引 物,上 游 为:5′-CGGGATCCATGTCGCGGCTTAGCGAG-3′, 下 游 为 5′-CGGAATTCTTACAGCT TGCGCA GCCGCAG-3′,两端带有BamHⅠ、EcoRⅠ酶切位点,由上海英骏公司合成。反应参数为:95℃熔解1 min,53℃退火30 s,72℃延伸30 s,上述步骤设定30个循环,72℃延伸10 min,4℃保存。产物经10 g/L琼脂糖凝胶电泳切胶回收(具体操作步骤参照DNA凝胶回收试剂盒说明书),得到目的基因。
1.2.3 重组载体的构建 将目的基因和 pET-32a(+)载体用BamHⅠ、EcoRⅠ双酶切,37℃孵育3 h,2倍体积无水乙醇置-20℃沉淀20 min以上,12 000 r/min离心 5 min,弃去上清,待乙醇挥发完全后,沉淀用相应体积水溶解。酶切后的目的基因与载体连接,4℃过夜。将连接产物转化DH5α感受态细胞。
1.2.4 重组载体的鉴定 挑选平板上的单菌落,摇菌后用质粒小提试剂盒提质粒,BamHⅠ、EcoRⅠ酶切鉴定、PCR及电泳进行初步鉴定,选取目的片段鉴定,正确的一个质粒进行序列测定,由上海英骏公司测序。重组质粒分别命名为pAcoaA。
1.2.5 重组蛋白的诱导表达 将鉴定正确的重组质粒转化于大肠埃希菌BL21中,转化、重组质粒的鉴定。分别挑取单个重组表达质粒转化大肠埃希菌的单菌落,按1∶100接种于新鲜的含Amp的2×YT液体培养基中,振荡培养至OD600达0.6~0.8;诱导组加入IPTG至浓度为0.2 mmol/L诱导表达4 h,12 000 r/min离心 5 min,去上清,沉淀用 PBS悬浮洗涤3次备用。同时对pET-32a(+)空载体转化菌进行同样的平行处理作为载体对照。
将上述菌体沉淀用适量的PBS重悬,加等体积的2×SDS上样缓冲液(0.1 mol/L T ris-Cl pH 6.8,40 g/L SDS,0.2 mol/L二硫苏糖醇,2 g/L溴酚兰,200 mL/L甘油),混匀,煮沸 10 min,12 000 r/min离心5 min,各取 10 μ L进行SDS-PAGE电泳(浓缩胶50 g/L,分离胶 120 g/L),恒压90 V,150 min。考马斯亮兰R250(含500 mL/L甲醇,100 mL/L乙酸、2 g/L考马斯亮兰R250)染色2 h后脱色过夜。
1.2.6 融合蛋白可溶性分析 按1%的接种量接种于新鲜的含Amp的20 mL 2×YT液体培养基中,振荡培养至OD600达 0.6~0.8,加入 IPTG 至终浓度为0.2 mmol/L,37℃摇床继续培养4 h后离心,弃去上清,全部菌体离心后的沉淀用5 mL PBS(pH7.2)重悬,超声波裂解菌体,工作时间2 s,间歇时间2 s,400 W破碎(冰浴)90次离心后将上清转移至另一容器中,沉淀用500 μ L PBS(pH 7.4)重悬,各取20 μ L上清及沉淀悬液加入等体积的2×SDS上样缓冲液,混匀,煮沸10 min,12 000 r/min离心5 min,各取10 μ L 进行SDS-PAGE 电泳 。
1.2.7 融合蛋白的纯化 大量制备可溶性重组蛋白,收集菌体后用试剂盒中的1×binding buffer悬浮,超声波裂解,12 000 r/min离心5 min,收集上清。参照试剂盒(His◦Bind?kits)说明书纯化融合蛋白。
1.2.8 Western blot鉴定 将处理过的样品,10 μ L/孔样品上样,做两面胶,待电泳结束后,一面胶用于考马斯亮蓝染色,另一面胶用于转印浓缩胶电泳电压80 V左右,分离胶电泳电压90 V~120 V,待溴酚蓝泳动至距胶下缘1 cm以上结束电泳。湿转NC膜,按0.625 mA/cm2设定电流,转印120 min。100 g/L脱脂乳4℃封闭过夜。
在NC膜上加待检抗体:稀释液1∶1 000稀释6×his抗体,以覆盖膜为适,室温摇床振荡孵育1 h~2 h。PBST洗涤 3次;加入 100 g/L脱脂乳1∶10 000稀释的HRP标记鼠源二抗,以覆盖膜为适,室温摇床振荡孵育1 h~2 h。PBST洗涤3次;ECL显色按1∶1比例混匀A液、B液,覆盖在NC膜上显影。
2 结果
2.1 重组质粒的构建
以提取的基因组为模板,PCR扩增目的基因。PCR产物进行10 g/L琼脂糖凝胶电泳,结果表明,所扩增出的基因coaA与预期的大小(939 bp)相吻合。用BamHⅠ、EcoRⅠ双酶切pAcoaA(鸟型)重组质粒,获得阳性克隆。
2.2 重组蛋白的原核表达
将pAcoaA质粒 DNA转化 BL21(DE3),经37℃培养达到生长对数期,0.2 mmol/L IPTG诱导4 h收集菌体,超声波裂解;SDS-PAGE电泳分析,pAcoaA重组蛋白在沉淀及上清中均存在,部分以可溶性蛋白形式表达,融合蛋白大小约为 47 ku(图1)。
2.3 重组蛋白的纯化
原核表达的重组蛋白鸟分支杆菌coaA经His◦Bind?Resin kits(Novagen)纯化后,SDSPAGE电泳结果(图2)显示,得到纯化的蛋白。
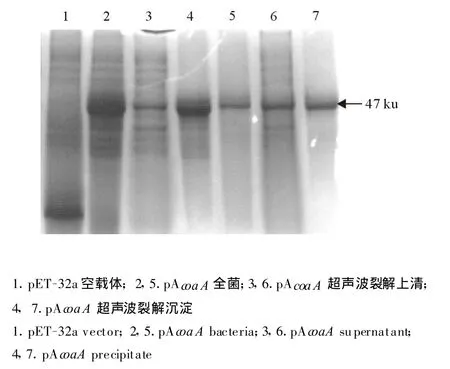
图1 pAcoaA原核表达Fig.1 Prokaryotic expression of AcoaA
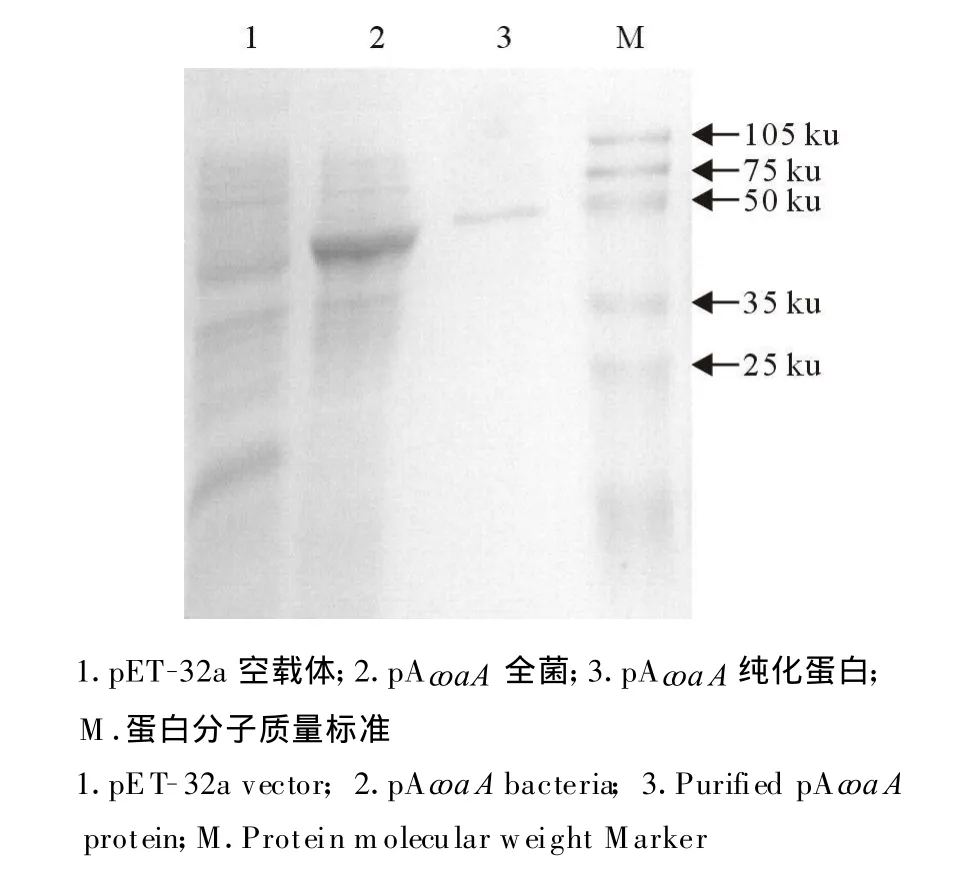
图2 pAc oaA纯化蛋白电泳结果Fig.2 SDS-PAGE of purified pAcoaA protein
2.4 重组蛋白活性的鉴定
采用 Western blot方法,用 His抗体检测pAcoaA纯化的重组蛋白活性,试验结果显示,纯化蛋白具有免疫活性(图3)。

图3 Western blot鉴定Fig.3 Western blot analysis
3 讨论
Thorel M F等[2]根据表型和核酸序列分析提出鸟分支杆菌有4个亚种,即鸟分支杆菌鸟亚种(Maa),鸟分支杆菌副结核亚种(Map),鸟分支杆菌森林亚种(Mas)和鸟分支杆菌土壤亚种(Mah)。导致MAC感染的主要是Maa。目前,用于治疗MAC感染的药物包括注射阿米卡星、口服氯法齐明、异烟肼、乙胺丁醇、利福平、环丙沙星、利福布丁、克拉霉素和阿奇霉素等。随着这些药物的使用,鸟分支杆菌的耐药性也随之增强[1]。因此,为了更好地防治该病,新药靶点的研究迫在眉睫。
coaA基因业已被证实为结合分支杆菌生长所必须的基因,它是体内CoA生物合成起始的关键酶。不同类型的细菌有特有的泛酸激酶,大致分为3大类型。大肠埃希菌产生类型Ⅰ的泛酸激酶,由coaA基因编码;金黄色葡萄球菌产生类型Ⅱ,与4种真核亚型 PanK1α、PanK1β、PanK2、PanK3 相似,而且不受反馈抑制的调控;铜绿假单胞菌产生类型Ⅲ,由coaX编码,不被CoA及其类似物抑制,广泛存在于多种细菌中。类型Ⅰ、Ⅱ、Ⅲ都包括两个相同的单体,它们彼此结合,形成全酶[5-9]。
分支杆菌coaA基因编码的coaA已被证实为结核分支杆菌生长所必需的基因,它是体内CoA生物合成起始的关键酶[10]。结核分支杆菌的coaA基因同原核、真核生物(尤其是人类)的同类基因的差异较大,可以做为抗结核药物潜在的靶点[1,10]。
理论上,能够以泛酸激酶为靶点而作为抑制药物的化合物有2类,即一类是抗代谢药物,如N5-Pan;另一类是泛酸激酶抑制剂。一些泛酸类似物可以被泛酸激酶磷酸化,以此进入辅酶A的合成途径,生成没有活性的辅酶A的类似物,从而阻断下游代谢途径。在细菌中,CoA及其硫酯都可反馈抑制PanK的活性。研究其结构发现,是因为CoA及其衍生物可与ATP竞争性地结合到PanK的ATP结合位点上[8]。
目前,鸟分支杆菌的泛酸激酶研究尚未开展,已有的一些报道主要针对的是结核分支杆菌和其他病原体[2-3,11]。本试验成功表达了鸟分支杆菌鸟亚种的泛酸激酶,并以可溶性蛋白形式表达,通过试剂盒纯化获得了纯化蛋白。这为下一步进行酶活性测定,酶活性位点的突变、合成类似物等研究奠定了基础。
[1]朱艳伶,万康林,沈国顺.鸟分枝杆菌病[J].中国人兽共患病学报,2007,23(5):507-511.
[2]Thorel M F,M Krichevsky V V,Frebault L.Numerical tax onomy of mycobactin dependent my cobacteria,amended description ofMycobacterium avium,and description ofMycobacterium aviumsubsp.aviumnov,Mycobacteriumaviumsubsp.paratuberculosisnov,andMycobacteriumaviumsubsp .silvaticum nov[J].Int J Syst Bacteriol,1990,40:254-260.
[3]Parimal K,Manmohan C,Avadhesha S.How pantothenol intervenes in coenzyme-A biosy nthesis ofMycobacterium tuberculosis[J].Biochem Biophys Res Commu,2007,361:903-909.
[4]Sassetti C M,Boyd D H,Rubin E J,et al.Genes required for mycobacterial growth defined by high density mutagenesis[J].M ol Micro,2003,48(1):77-84.
[5]Yang K,Eyobo Y,Brand L A,et al.Crystal structure of a type III panto thenate kinase:Insight into the mechanism of an essential coenzy me A bio synthetic enzyme universally distributed in bacteria[J].J Bacteriol,2006,188:5532-5540.
[6]Leonardi R,Chohnan S,Zhang Y M,et al.A pantothenate kinase fromStaphy lococcus aureusrefractory to feedback regulation by coenzy me A[J].Biol Chem,2005,280:3314-3322.
[7]Vallari D S,Jackowski S,Rock C O.Regulation of pantothenate kinase by coenzyme A and its thioesters[J].J Biol Chem,1987,262:2468-2471.
[8]Choudhry A E,Mandichak T L,Broskey J P,et al.Inhibitors of pantothenate kinase:Novel antibiotics for staphylococcal infections[J].Antimicrob Agents Chem Other,2003,47:2051-2055.
[9]Ivey R A,Zhang Y M.The Structure of the pantothenate kinase pantothenate ternary complex reveals the relationship between the binding sites for substrate,allosteric rregulator,and antimetabolites[J].Biol Chem,2004,279:5622-35629.
[10]Satyabrata D,Parimal K,Vikrant B,et al.Invariance and variability in bacterial PanK:a study based on the crystal structure ofMycobacterium tuberculosisPanK[J].Acta Cry st,2006,D62:628-638.
[11]张 鹭,王庆忠,徐 颖.结核分枝杆菌泛酸激酶的克隆表达及酶学性质[J].第四军医大学学报,2006,27(23):2135-2138.
Protokaryonic Expression and Purification ofcoaAinM.aviumsubsp.avium
CHEN Hong-jun1,WANG Wei1,LIU Pei-hong2,WANG Shui-ming3,DING Chan1
(1.Shanghai Veterinary Research Institute,CAAS,Shanghai,200241,China;2.Shanghai Municipal Center f or Disease Control and Prevention,Shanghai,200102,China;3.J ingsu Provin Entry-Ex it Inspection and Quarantine Bureaue,N anjing,J iangsu,211000,China)
Mycobacteriosis avium is an important zoonosis caused byM.aviumcomplex,especially byM.aviumsubsp.avium(Maa).With the development of strains of high drug resistance,research on new targets of drugs should be extremely urgent.Pantothenate kinase(orcoaA)might be a potential target for new drugs.In current study,coaAgene of Maa was amplified and subcloned into pET32a(+)vector.With the transfected BL21(DE3)bacteria induced by IPTG,the gene was successfully expressed.And the product was soluble inE.coli,and purified by His-band Resin kit.The produced peptide will be carried out to research on determination of enzymatic activity and inhibiting analog design.
Mycobacterium aviumsubsp.avium;coaA;soluble expression
Q786;S852.618
A
1007-5038(2010)01-0013-04
2009-08-21
上海市科技兴农重点项目[沪农科攻字(2006)第5-4号]
陈鸿军(1979-),男,江苏南京人,副研究员,博士,主要从事动物结核病检测研究。*通讯作者
book=16,ebook=191
