沙门菌肠毒素基因克隆及序列分析
2010-05-31熊惠军王培园董剑辉孙跃辉
陈 瑞,熊惠军,王培园,董剑辉,孙跃辉,宋 立
(1.华南农业大学,广东广州 510642;2.中国兽医药品监察所,北京 100081;3.天津大学,天津 300072)
沙门菌肠毒素基因克隆及序列分析
陈 瑞1,2,熊惠军1,王培园1,董剑辉1,2,孙跃辉3,宋 立2*
(1.华南农业大学,广东广州 510642;2.中国兽医药品监察所,北京 100081;3.天津大学,天津 300072)
研究常见的不同血清型沙门菌肠毒素(stn)基因核苷酸序列之间的差异及其分布情况。根据沙门菌的stn核苷酸序列设计一对引物,应用PCR技术,分别对肠炎沙门菌、鼠伤寒沙门菌和鸡白痢沙门菌进行PCR扩增,对扩增产物进行克隆及序列分析,并用所设计的引物检测7种血清型沙门菌(42株)。结果显示,3种沙门菌经PCR均扩增出749 bp的特异条带,DNA序列分析证实,沙门菌的stn核苷酸序列比较保守,42株沙门菌stn的检出率为100%。本试验成功克隆出沙门菌的stn,调查其在不同血清型沙门菌中的分布及序列分析,为进一步研究stn致病机理及研制减毒沙门菌活菌疫苗奠定了基础。
沙门菌;肠毒素基因;序列分析
*通讯作者
沙门菌(Salmonella)是肠杆菌科中一大类致病菌,是一种重要的人兽共患病病原[1],其血清型有2 500个以上[2]。沙门菌感染畜禽后可引起一系列的肠道疾病,成为畜禽肉胴体、畜禽产品污染的重要来源,并可通过各种途经传染给人,引起人的食源性疾病,严重威胁着消费者的身体健康和畜牧业的健康发展[3]。在世界各地的食物中毒中,沙门菌引起的中毒病例占首位[4]。有资料统计,在我国70%~80%细菌性食物中毒事件是由沙门菌引起,而引起沙门菌中毒的食品中,约90%是肉、蛋、奶等畜产品[5]。
有学者研究发现,肠毒素基因(enterotoxin gene)stn是沙门菌致病机制中一个较为重要的毒力因子[6],沙门菌 stn的检测在动物卫生及食品安全方面显得较为重要。本研究对沙门菌stn进行克隆、序列分析,并检测其在一些血清型中的分布,为下一步的分子致病机理的研究和弱毒疫苗的研制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 试验所用沙门菌株由中国兽医药品监察所检测技术研究室保存,7个血清型,共42株,分别为鼠伤寒沙门菌(S.ty phimurium)、肠炎沙门菌(S.enterica)、鸡白痢沙门菌(S.pullorum)、纽波特沙门菌(S.newport)、亚拉巴马沙门菌(S.alabama)、哈瓦那沙门菌(S.havana)、阿姆斯特丹沙门菌(S.amsterdam)各6株。
1.1.2 主要试剂及仪器 限制性内切酶BamHⅠ、XhoⅠ、TaqDNA聚合酶均为NEB公司产品;琼脂糖凝胶DNA回收试剂盒、T4 DNA连接酶、pGEM-T Easy载体质粒系统均为Promega公司产品;TOP10感受态细胞为北京天根公司产品;IPTG和X-gal均为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 引物设计及合成 根据己报道的沙门菌stn基因核苷酸序列,用Premier 5.0设计了1对引物,两端含有限制性内切酶BamHⅠ、XhoⅠ的酶切点 :stn-F:5′-T TGGATCCATGT TAATCCTGTTGTCTCGC-3′;stn-R:5′-CGCTCGAGTTGGCAACGT TACTG-3′。该引物由 Invitrogen公司合成。
1.2.2 沙门菌的培养及DNA的提取 将冻存的沙门菌接种在营养琼脂上,37℃培养过夜。挑取单菌落接种至装有营养肉汤的小试管中,37℃振荡培养过夜。取新鲜培养的菌液,用煮沸法提取DNA。
1.2.3 stn基因的扩增及纯化 扩增体系为50 μL:无 菌 水 34 μL,10 ×buffer 5 μL,dNTPs 4 μL,上下游引物各 2 μL,TaqDNA 聚合酶 1 μL,DNA样品2 μL。PCR反应条件为94℃5 min;94℃30 s,55℃30 s,72℃45 s,30个循环;最后72℃10 min。将PCR产物用10 g/L琼脂糖凝胶在1×TAE电泳液中电泳,按试剂盒说明回收纯化目的基因。
1.2.4 stn的克隆与序列测定 将纯化的PCR产物克隆到pGEM-T Easy载体上,构建pGEM-T-stn重组质粒,将其转化TOP10感受态细胞,用含氨苄青霉素的LB平板筛选阳性克隆,并进行PCR、酶切和测序鉴定。用DNA Star软件对测序结果进行分析和比较。
1.2.5 stn的检测 用本试验所设计的引物,对受试的7个血清型共42株沙门菌进行检测,以研究其在不同血清型沙门菌中的分布情况。
2 结果
2.1 目的基因的克隆和鉴定
用提取的3株沙门菌基因组DNA为模板,经PCR扩增出现1条与预期片段(749 bp)大小一致的条带(图1)。
2.2 沙门菌的stn克隆及鉴定
将扩增的目的基因纯化与克隆载体连接,构建重组质粒pGEM-T-stn。经氨苄青霉素筛选出的阳性克隆,再经PCR扩增及BamHⅠ、XhoⅠ双酶切鉴定得到750 bp左右的片段(图2)。

图1 沙门菌stn PCR扩增结果Fig.1 PCR amplification results of Salmonella stn

图2 重组质粒pGEM-T-stn的酶切鉴定Fig.2 Identification of recombinant plasmid pGEM-T-stn by restriction enzymes
2.3 沙门菌stn的序列分析
本试验选取了3株重组质粒进行测序分析,这3株重组质粒的stn基因分别来自3个血清型:鼠伤寒沙门菌、肠炎沙门菌和鸡白痢沙门菌,分别标记为S.typhimurium、S.enterica、S.pullorum。将测定的核苷酸序列进行BLAST检索,结果显示,与Gen-Bank公布的鼠伤寒沙门菌stn核酸序列(登录号L16014.1)相比,试验中鼠伤寒沙门菌stn基因核酸序列同源性高达100%,而肠炎沙门菌和鸡白痢沙门菌均为98.9%,其中有8个碱基发生突变。其stn序列同源关系如图3所示。

图3 沙门菌stn序列同源性Fig.3 Sequence homology of stn genes from 3 salmonella strains comparing with S.typhimurium/L16014.1
2.4 stn的检测结果
用本试验所设计引物对42株受试沙门菌的stn进行检测,检出率为100%,7个血清型的检测结果见图4。
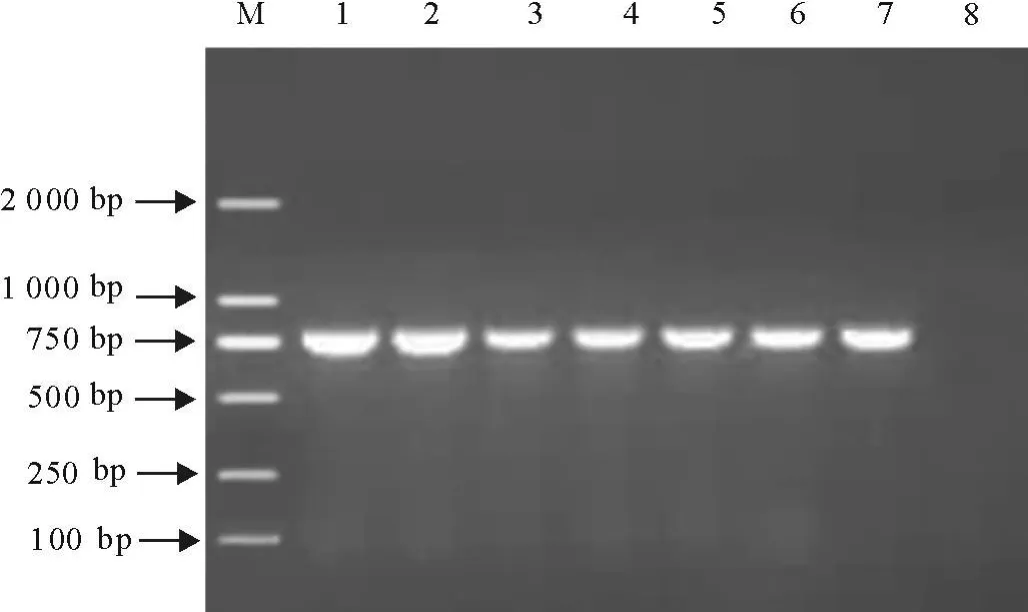
图4 7个血清型沙门菌stn PCR扩增结果Fig.4 PCR amplification results of 7 serotypes of Salmonella stn
3 讨论
细菌感染宿主的过程通常是先黏附到宿主组织上,进而通过细菌的毒力因子侵袭宿主细胞,导致宿主患病及死亡[7]。随着分子细菌学研究的开展,人们对细菌的毒素、侵袭素与毒力岛等毒力因子的认识也在不断的深入[8-10]。Chopra A K等[11]首次从鼠伤寒沙门菌中成功克隆出stn的全序列。黄建华[6]在研究中证实stn是沙门菌的一个重要毒力因子。此后,关于沙门菌stn的报道比较少。
本试验按GenBank报道的stn核苷酸序列,设计特异性引物,通过PCR方法对常见的7种血清型沙门菌共计42株进行检测,检出率为100%。因此,推断在常见血清型的沙门菌中stn可能普遍存在。由于本试验所涉及的受试菌株量比较少,至于其是否一定在不同血清型中普遍存在,还有待进行一步深入研究。
沙门菌病在兽医临床上比较常见,从免疫学角度来讲,对易感动物注射疫苗是预防该病最有效的措施,而且,国际上有专家在倡导用疫苗控制沙门菌病[12]。目前,常用的疫苗有两大类,一类为灭活疫苗,另一类为弱毒活疫苗。由于灭活苗具有容易引起全身及局部反应、只能激发体液免疫、需多次加强免疫等缺点,此类疫苗的应用受到限制[13]。弱毒沙门菌在诱导体液和细胞免疫反应方面比灭活苗或亚单位苗更为有效[14]。stn是沙门菌的一个重要毒力因子,因此,可以运用分子生物学技术构建沙门菌stn突变菌株,通过对stn的突变而降低该菌的致病性,从而研制减毒活菌疫苗。本研究通过对stn的成功克隆并测序,为进一步开发减毒活菌疫苗奠定了基础。
本研究还选择了我国常见且与公共卫生有密切关系的肠炎沙门菌、鼠伤寒沙门菌和鸡白痢沙门菌的stn测序、分析,结果表明,3种常见的不同血清型沙门菌株的 stn核苷酸序列同源性较高,为在98.9%~100%之间。通过GenBank上的Blast检索,该序列与其他生物无同源关系,说明所克隆的序列在沙门菌不同血清型沙门菌中具有高度保守性。如果通过进一步深入研究,有望将stn作为检测沙门菌继invA基因、16 S RNA基因、sefA基因、hin/H2区域、arfA基因、fimA基因[15-16]之后的又一个新的靶基因。
[1]陆承平.兽医微生物学[M].北京:中国农业出版社,2001.
[2]F rancois X W,Francoise G.Multidrug resistance inSalmonellaenterica serotype typhimuium from humans in France[J].J Clin Microbiol,2006,44(3):700-708.
[3]陈伯祥.沙门菌病防治概况[J].动物医学进展,2007,28(3):102-103.
[4]张艳红,吴延功,杜元钊,等.沙门氏菌快速检测方法研究进展[J].动物医学进展,2001,22(2):39-41.
[5]曾晓芳.畜产品中沙门氏菌污染的检测与控制[J].四川畜牧兽医,2003,30(4):28-29.
[6]黄建华,徐心晶.鼠伤寒沙门氏菌stn基因突变株的构建与毒力检测[J].解放军医学杂志,2001,26(3):219-221.
[7]Kingsley R A,Humphries A D,Weening E H,et al.Molecular and phenotypic analysis of the CS54 island ofSalmonella entericserotypety phimurium:identification of intestinal colonization and persistence determinants[J].Infect Immun,2003,71(2):629-640.
[8]Zhao S,Qaiymi S.Characterization ofSalmonella entericaserotypenewportisolated from humans and food animals[J].J Clin Microbiol,2003,41(12):5366-5371.
[9]Zaporojets D,French S,Squires C L.Products transcribed from rearranged genes ofEscherichia colican assemble to fo rm functional ribosomes[J].J Bacteriol,2003,185(23):6921-6927.
[10]Althouse C,Patterson S,Fedorka-Cray,et al.T ype I fimbriae ofSalmonella entericaserovartyphimuriumbind to enterocy tes and contribute to colonization of swinein vivo[J].Infect Immun,2003,71(11):6446-6452.
[11]Chopra A K,Peterson J W,Chary P,et al.Molecular characterization of an enterotoxin fromSalmonella typhimurium[J].Microbial Path,1994,16:85-98.
[12]刘 曼,杨桂连,王春凤,等.鸡白痢沙门氏菌外膜蛋白C基因(OmpC)的克隆与表达[J].中国预防兽医学报,2009,31(2):110-113.
[13]徐引弟,郭爱珍,陈焕春.减毒沙门菌疫苗研究进展[J].动物医学进展,2008,29(8):52-56.
[14]徐引弟,郭爱珍,陈焕春.减毒猪霍乱沙门氏菌作为疫苗及载体的研究进展[J].猪与禽,2007,27(6):71-74.
[15]汪 琦,张 昕,张惠媛,等.利用PCR方法快速检测食品中的沙门氏菌[J].检验检疫科学,2005(6):26-28.
[16]盘宝进,罗兆飞,韦梅良,等.沙门菌和志贺菌二重 PCR检测方法的建立及应用[J].动物医学进展,2009,30(5):19-23.
Cloning and DNA Sequence Analysis of Enterotoxin Gene fromSalmonella
CHEN Rui1,2,XIONG Hui-jun1,WANG Pei-yuan1,DONG Jian-hui1,2,SUN Yue-hui3,SONG Li2
(1.South China Agricultural University,Guangzhou,Guangdong,510642,China;
2.China Institute of Veterinary Drug Control,Beijing100081,China;3.Tianjin University,Tianjin,300072,China)
In this article,we investigated the diversity in DNA sequence of enterotoxin gene(stn)from differentSalmonellaserotypes and its distribution inSalmonella.A pair of oligonucleotide primers were designed according to the stn gene nucleotide sequence ofSalmonella,and the stn genes were amplified fromS.typhimurium,S.enterica,S.pullorum.The specific PCR products were cloned and sequenced.7 serotypesSalmonella(42 strains)were detected by PCR,an expected 749 bp band was successfully amplified,and the DNA sequences of stn genes fromSalmonellawere conservative.The detection rate of stn genes from 42Salmonellastrains is 100%.The stn genes were cloned successfully in this experiment,distribution and sequence analysis of stn genes from differentSalmonellaserotypes were investigated,and it provides a new insight for studying on the pathogenesis and attenuated live vaccine ofSalmonella.
Salmonella;enterotoxin gene;sequence analysis
S852.612
A
1007-5038(2010)09-0025-04
2010-03-15
国家“十一五”科技支撑子课题(2006BAK02A03-1)
陈 瑞(1984-),男,河南南阳人,硕士研究生,主要从事动物源细菌耐药性研究。
