胃癌组织 PTEN基因的表达及其与 MMP-9的相关性
2010-05-31覃月秋黄赞松何守搞周喜汉
覃月秋 黄赞松 何守搞 周喜汉
(右江民族医学院附属医院消化内科,广西 百色 533000)
与细胞支架蛋白 tensin同源在 10号染色体有缺失的磷酸酯酶(PTEN)是近年发现的第 1个具有磷酸酶活性的抑癌基因〔1〕。它能通过对酪氨酸、丝氨酸/苏氨酸脱磷酸化作用调控细胞内多种信号传导通路,从而调节细胞的生长、发育,诱导细胞凋亡,调控细胞周期以及抑制肿瘤细胞黏附、转移。研究发现,PTEN基因突变、缺失及异常表达与人类多种恶性肿瘤的发生、发展及预后密切相关〔1~3〕。基质金属蛋白酶-9(MMP-9)能降解基膜和细胞外基质中的Ⅳ型胶原成分,为恶性肿瘤的浸润、转移及肿瘤间质血管的新生提供有利条件〔4〕。关于PTEN基因对转移相关酶 MMP-9的调节机制国外已有少量文献报道。本研究通过检测抑癌基因PTEN在胃癌中的表达,观察其与胃癌临床病理因素的关系及与 MMP-9蛋白表达的相关性,探讨 PTEN基因在胃癌发生、发展过程中的作用。
1 材料与方法
1.1 材料 57例原发性胃癌及癌旁正常组织取自本院 1999至 2002年经病理证实的手术切除标本蜡块或活检组织,患者术前均未经放疗和化疗。57例癌组织中,男性 39例,女性 18例,年龄 30~75岁,平均(49±5.35岁)。按分化程度:低分化癌 39例,高分化、中分化癌 18例。癌转移情况:有淋巴结转移32例,无淋巴结转移 25例;远处转移 7例,无远处转移 50例。胃癌浸润深度:浸润未超过浆膜层(T1+T2)22例,浸润超过浆膜层(T3+T4)35例。TNM分期:Ⅰ期 13例,Ⅱ期 11例,Ⅲ期24例,Ⅳ期 9例。
1.2 方法 每例取原发灶癌组织、切缘正常组织及转移淋巴结,组织经 10%甲醛固定,石蜡包埋,4μm连续切片,分别进行HE染色和免疫组化S-P法染色(操作按试剂盒说明书进行)。鼠抗人 PTEN单克隆抗体及鼠抗人 MMP-9单克隆抗体均为Santa Cruz公司产品。S-P试剂盒购自福州迈新生物公司。以PBS代替一抗作阴性对照。
1.3 结果判断 PTEN和MMP-9蛋白染色阳性反应信号呈棕黄色细小颗粒,定位于胞浆。在高倍镜(×400)下每张切片至少 5个随机视野中计数 500个细胞,计算阳性细胞数的百分比。按切片中阳性细胞率及染色反应强度分为 4级:阴性(-):细胞内不着色或阳性细胞率 <10%;弱阳性(+):细胞内出现浅棕色颗粒和(或)阳性细胞率为 10%~29%;阳性(⧺):细胞内出现棕黄色颗粒和(或)阳性细胞率为 30% ~60%;强阳性(⧺):细胞内出现深棕黄色颗粒和(或)阳性细胞率 >60%。
1.4 统计学处理 采用SPSS10.0统计软件对数据进行χ2检验及 Spearman等级相关分析。
2 结 果
2.1 胃癌组织及癌旁正常组织中 PTEN蛋白和 MMP-9蛋白的表达 PTEN蛋白染色阳性反应信号呈棕黄色细小颗粒,位于细胞质。胃癌组织中PTEN蛋白表达的阳性率 61.4%(35/57)显著低于癌旁正常胃黏膜 100%(57/57)(P<0.01)。MMP-9蛋白染色阳性反应信号呈棕黄色细小颗粒,位于细胞浆。癌组织 MMP-9蛋白表达的阳性率 73.7%(42/57)明显高于相应正常组织 19.3%(11/57)(P<0.01)。
2.2 胃癌中 PTEN和 MMP-9蛋白表达的相关性 胃癌中PTEN蛋白的表达强度与 MMP-9蛋白的表达强度呈负相关(rs=-0.462,P<0.01),随着 PTEN蛋白表达强度的增加,MMP-9蛋白表达强度减弱,反之亦然。见表 1。
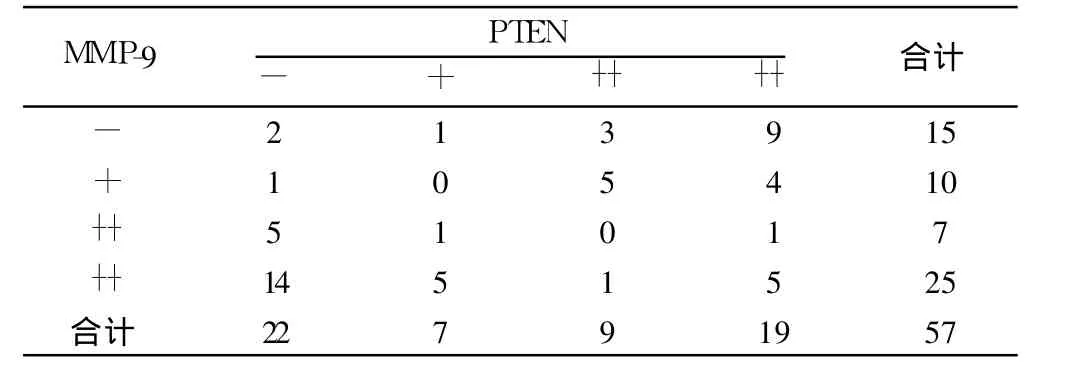
表1 胃癌组织PTEN和MMP-9蛋白表达的相关性
2.3 胃癌组织PTEN蛋白和 MMP-9蛋白表达与临床病理特征的关系 TNM分期Ⅲ、Ⅳ期胃癌组织 PTEN蛋白表达水平低于Ⅰ、Ⅱ期胃癌组织(P<0.01);低分化癌组织PTEN蛋白的表达低于高分化、中分化癌组织(P<0.01);有淋巴结转移的胃癌组织PTEN蛋白表达低于无淋巴结转移的胃癌组织(P<0.05),胃壁浸润程度越深表达越低。而 MMP-9蛋白表达水平则随胃壁浸润深度增加、淋巴结转移及 TNM分期的进展而增高。见表 2。

表2 胃癌及癌旁正常组织PTEN和MMP-9蛋白的表达
3 讨 论
PTEN基因〔1~3〕(又称 MMAC1或 TEP1)由 3个研究小组于1997年发现并命名,因该基因在人类多种肿瘤中存在突变、缺失及异常表达,被认为是继p53基因之后发现的又一重要抑癌基因。PTEN基因定位于 10q23.3,全长约 200 kb,由 9个外显子和 8个内含子组成。其氨基端(N端)磷酸酶区域为主要功能区,该区第 122~133位氨基酸序列内有双特异性磷酸酶(DSP)催化区的核心基序 HCXXGXXTS/T,对酪氨酸、丝氨酸/苏氨酸有脱磷酸化作用,既可通过脂质磷酸酶活性调节细胞生长和凋亡,也可利用蛋白磷酸酶活性抑制细胞黏附和转移。
最近的研究证明消化道肿瘤中存在该基因的缺失、突变或异常表达。Tachibana等〔5〕用免疫组化法检测 97例食管癌,其中 PTEN蛋白阳性表达率 49.5%,阴性表达率 50.5%,且 PTEN表达与肿瘤 TNM分期、患者存活率明显相关。Yang等〔6〕检测了胃癌组织及邻近正常胃黏膜组织、肠化生、不典型增生组织中 PTEN蛋白表达的情况,结果正常胃黏膜组织及肠化生组织中 PTEN蛋白表达的阳性率(分别为 100%、98.5%)明显高于不典型增生(66.7%)及胃癌组织(47.8%)(P<0.01)。本研究结果提示,①PTEN蛋白失表达促进了胃癌的发生、发展,检测 PTEN蛋白的表达可作为胃癌发生的监测指标之一。②PTEN蛋白的表达与胃癌的组织分化程度呈正相关:组织分化程度高、恶性程度低者,PTEN蛋白表达的阳性率高;而 PTEN蛋白失表达或弱阳性表达则多见于组织分化程度低、恶性程度高者。③PTEN蛋白的表达随胃壁浸润深度增加、淋巴结转移及TNM分期的进展而降低,说明 PTEN蛋白失表达在胃癌的增殖、浸润、转移等过程中起到了促进作用,PTEN蛋白的检测,有可能为判断胃癌的恶性程度及患者的预后提供线索。
基质金属蛋白酶(MMPs)是一种重要的蛋白水解酶。能降解细胞外基质,参与胎儿发育过程中的组织重构和伤口愈合过程中的胶原重构等生理过程。在病理情况下,MMPs一方面通过降解基底膜和包绕肿瘤的基质,突破基质屏障,促进肿瘤浸润、转移,另一方面则通过毛细血管增生,新生血管生成等促进肿瘤生长、扩散〔7〕。MMP-9是基质金属蛋白酶家族成员之一,可降解细胞外多种基质成分,如Ⅳ型胶原、蛋白多糖、层黏蛋白及纤维连接蛋白等,在肿瘤浸润、转移过程中发挥极其重要的作用〔8,9〕。 Torii等〔10〕检测了 70例胃癌患者和 130例正常人MMP-9的表达,结果发现胃癌组织 MMP-9高于正常组织,且与肿瘤大小、淋巴结转移、浸润深度及 TNM分期有关。本研究结果提示胃癌组织中存在 MMP-9的过度激活。与 Torii等〔10〕的研究结果一致。表明胃癌组织分泌MMP-9降解了基底膜和细胞外基质,促进了肿瘤细胞向周围组织浸润,是反映胃癌恶性进展的一个比较可靠的指标。
抑制肿瘤细胞的浸润、转移是 PTEN基因的重要生物学功能之一,关于 PTEN基因对转移相关酶MMP-9的调节机制国外已有少量文献报道。Moon等〔11〕研究发现,转录因子 NF-kappaB和活化蛋白-1(AP-1)能调节 MMP-9启动子的转录,而PTEN基因通过抑制 NF-kappaB和 AP-1的作用,使 MMP-9启动子的转录活性显著降低,MMP-9蛋白合成及表达减少。Park等〔12〕发现,在成胶质瘤细胞系 U87MG、U251MG和 U373MG中,PTEN基因的失活促进透明质酸酶诱导的 MMP-9分泌;而野生型 PTEN表达的成胶质瘤细胞系 LN229、LN18和 LN428中并无类似现象。此外,把野生型 PTEN导入U87MG细胞系后,透明质酸酶诱导的MMP-9分泌显著减少。这说明,通过阻断透明质酸酶诱导的 MMP-9分泌而抑制肿瘤细胞的浸润、转移是PTEN基因的作用机制之一。本研究结果说明 PTEN基因低表达或失表达可能导致了 MMP-9的过度激活,促进肿瘤浸润、转移。研究两者的关系有助于阐明PTEN基因的作用机制及胃癌转移的分子机制,为开辟肿瘤治疗新途径打下理论基础。
用免疫组化法检测胃黏膜组织 PTEN基因及 MMP-9的表达简便、快速,既可为胃癌早期诊断提供线索,又有助于判断预后。在治疗上,对患者给予化学干预治疗,促进 PTEN基因表达,抑制MMP-9表达,有可能阻断或逆转癌前病变,抑制胃癌转移,降低患者死亡率,这将为胃癌治疗提供极富吸引力的前景。
1 Li J,Yen C,Liaw D,et al.PTEN,a putative protein tyrosine phosphatase gene mutated in human brain,breast,and prostate cancer〔J〕.Science,1997;275(5308):1943-7.
2 Steck PA,Pershouse MA,Jasser SA,et al.Identification of a candidate tumour suppressor geng,MMAC1,at chromosome 10q23.3 that is mutated in multiple advanced cancers〔J〕.Nat Genet,1997;15:356-2.
3 Li DM,Sun H.TEP1,encoded by a candidate tumor suppressor locus,is a novel protein tyrosine phosphatase regulated by transforming growth factor β〔J〕.Cancer Res,1997;57:2124-9.
4 Cornelius LA,Nehring LC,Roby JD,et al.Human dermal microvascular endothelial cells produce matrix metalloproteinases in response to angiogenic factors and migration〔J〕.J Invest Dermatol,1995;105(2):170-6.
5 Tachibana M,Shibakita M,Ohno S,et al.Expression and prognostic significance of PTEN product protein in patients with esophageal squamous cell carcinoma〔J〕.Cancer,2002;94(7):1955-60.
6 Yang L,Kuang LG,Zheng HC,et al.PTENencoding product:a marker for tumorigenesis and progression of gastric carcinoma〔J〕.World J Gastroenterol,2003;9(1):35-9.
7 Kleiner DE,Stetler-Stevenson WG.Matrix metalloproteinases and metastasis〔J〕.Cancer Chemother Pharmacol,1999;43(suppl):S42.
8 Aznavoorian S,Murphy AN,Stetler-Stevenson WG,et al.Molecular aspects of tumor cell invasion and metastasis〔J〕.Cancer,1993;71(4):1368-83.
9 Ramos-DeSimone N,Hahn-Dantona E,Sipley J,et al.Activation of matrix metal lipoproteinase-9(MMP-9)via a converging plasmin/stromelysin-1 cascade enhances tumor cell invasion〔J〕.J Biol Chem,1999;274(19):13066-76.
10 Torii A,Kodera Y,Uesaka K,et al.Plasma concentration of matrix metallipoproteinase 9 in gastric cancer〔J〕.Br J Surg,1997;84(1):133-6.
11 Moon SK,Kim HM,Kim CH.PTEN induces G1 cell cycle arrest and inhibits MMP-9 expression via the regulation of NF-kappaB and AP-1 in vascular smooth muscle cells〔J〕.Arch Biochem Biophys,2004;421(2):267-76.
12 Park MJ,Kim MS,Park IC,et al.PTEN suppresses hyaluronic acid-induced matrix metalloproteinase-9 expression in U87MG glioblastoma cells through focal adhesion kinase dephosphorylation〔J〕.Cancer Res,2002;62(21):6318-22.
