流式细胞术快速检测杆状病毒滴度
2010-05-29张佑红彭继明靖志强
徐 鹏,张佑红,杨 益,彭继明,陈 龙,靖志强,危 威,马 静,秦 琴
(武汉工程大学化工与制药学院,湖北 武汉 430074)
0 引 言
杆状病毒表达载体系统(Baculovirus expression vector system, BEVS)由于其表达的高效性、安全性等诸多优点,在重组蛋白生产、疫苗的研制以及生物杀虫剂等方面具有很高的应用前景[1].为了提高重组蛋白或病毒的产量,必须准确测定杆状病毒与细胞的浓度比,即感染复数(multiplicity of infection,MOI)[2-3].目前病毒滴度的测定方法主要是蚀斑法和终点稀释法(EPDA)[4-5],两种方法都是利用病毒去感染细胞而间接得到病毒的滴度,测量过程繁琐,耗时长,且不同实验者之间测得的结果相差较大.
随着近年来流式细胞术(FCM)的不断发展,其检测范围不再局限于细胞,它已广泛应用于生物医学的各个领域.Marie和Brussaard[6-7]等采用流式细胞仪通过特异性核酸荧光染料SYBR Green I染色成功地检测并计数海洋病毒.在此基础上,Shen[8]首次利用流式细胞术计数杆状病毒,但染色效果不好.本实验针对染色过程中的主要影响因素进行优化,验证了改进后方法的重复性和线性性,并对流式细胞术与终点稀释法的计数结果进行比较.
1 实验部分
1.1 病毒
野生型的苜蓿银纹夜蛾核型多角体病毒(wide type AcNPV)由武汉大学友好提供.
1.2 试剂及仪器
SYBR Green I(10 000×)和黄绿荧光微球(1μm)均购于Molecular Probes公司;多聚甲醛购于生工生物工程有限公司;Triton X-100购于Amresco公司;FACSCalibur流式细胞仪,BD公司生产.
1.3 样品制备
病毒样品制备的主要步骤可分为固定、破膜和染色.待测病毒经磷酸盐缓冲液(PBS,pH=8.0)稀释后,加入一定量的多聚甲醛4 ℃下固定30 min,再放入-80 ℃超低温冰箱15 min,然后置于室温水浴中5 min,加入一定量的Triton X-100室温放置5 min,最后加入SYBR Green I进行染色,具体的影响因素及水平如表1所示.在上机检测之前,加入已知浓度的黄绿荧光微球作为内参.
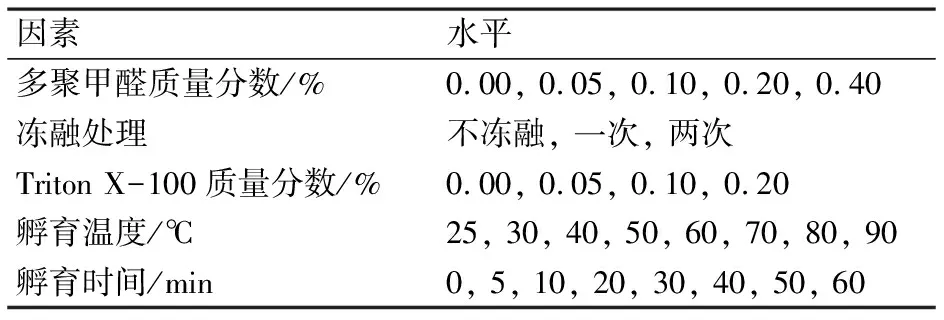
表1 病毒染色过程的影响因素及水平
1.4 流式细胞仪分析
采用BD公司FACSCalibur流式细胞仪检测病毒样品.前向散射光(FSC-H)、侧向散射光(SSC-H)和绿色荧光(FL1-H)均以对数模式获取.以FL1-H设定阈值,减少背景干扰.CellQuest软件分析数据,在SSC-H和FL1-H的双参数散点图上确定病毒和微球的位置(图1).
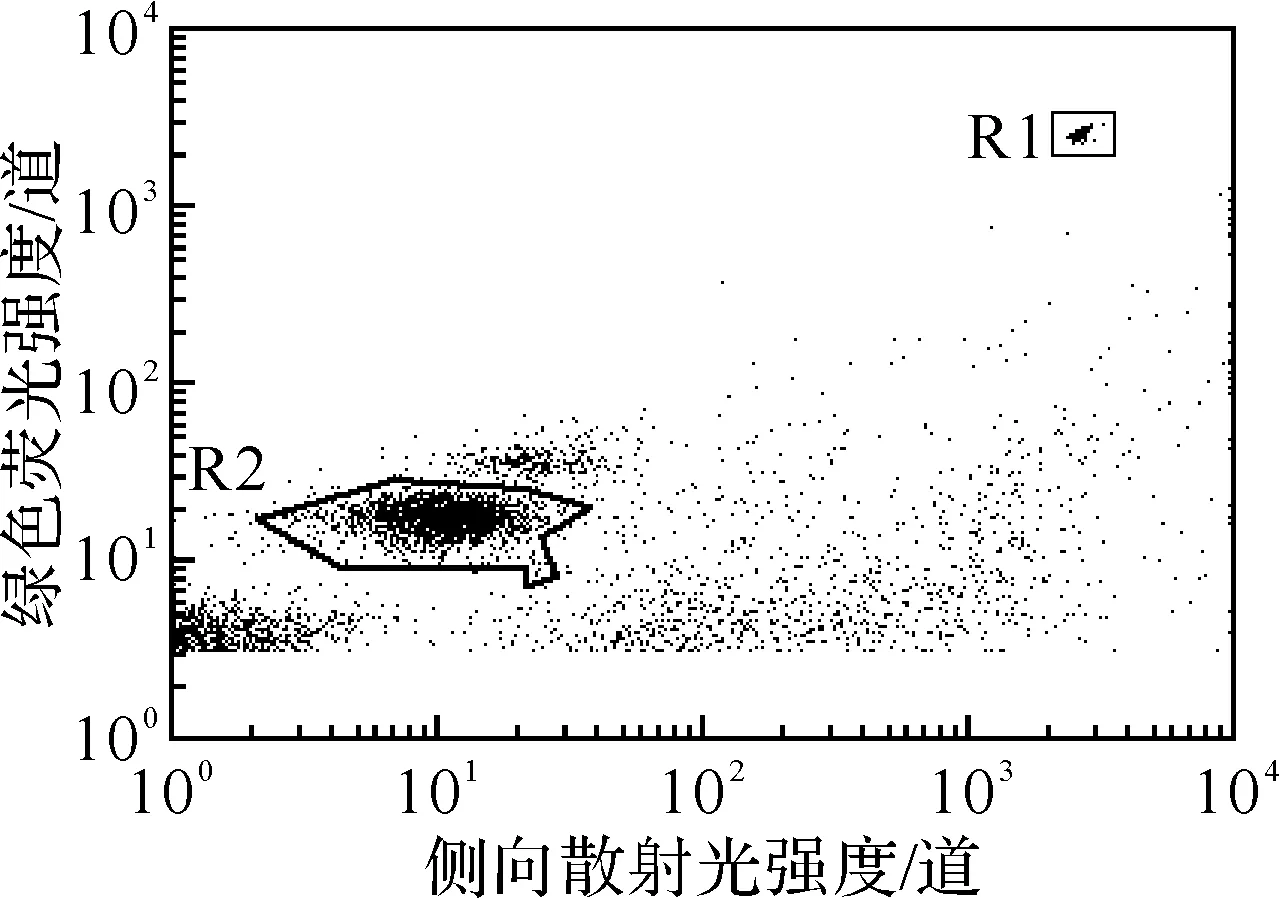
图1 SSC-H vs. FL1-H双参数散点图
“门”R1内为加入的微球,“门”R2内为待测的病毒.根据R1/R2可以推算出样品病毒的滴度(1).
(1)
将得到的样品病毒滴度乘以稀释倍数便是原病毒样本中的病毒滴度.
1.5 重复性和线性性检测
线性性:PBS缓冲液稀释杆状病毒1000倍,取稀释后不同体积(5~640 μL)的病毒测定其滴度,做3个重复,计算相关系数R2.重复性:对同一个病毒样本计数8次,计算变异系数CV.
1.6 流式细胞术与终点稀释法的计数结果比较
为了比较改进后的流式测量方法与传统的病毒测定方法的准确性,采用终点稀释法[4]对同一病毒样本进行检测,具体如下:a.将处于对数生长期的Sf9细胞接种于96孔板中(100 μL/孔),27 ℃下孵育24 h.b.以新鲜培养基连续10倍稀释杆状病毒(10-4~10-10).c.96孔板去上清,于每孔加入不同稀释度的病毒100 μL,每稀释度重复12孔,对照孔加入100 μL的新鲜培养基代替病毒液,27 ℃下孵育5~7 d.d.按Spearman-Karber法[9]计算病毒样本的TCID50值.重复测量5次,计算变异系数CV.
2 结果与讨论
2.1 固定的影响
图2显示了不同质量分数的多聚甲醛固定对杆状病毒计数的影响.采用多聚甲醛固定能够维持病毒的原有形态,提高病毒的计数,但当其质量分数大于0.1%后病毒的计数随之减少.这主要是由于甲醛与DNA的相互作用,削弱了染料SYBR Green I与DNA的结合.病毒颗粒的荧光强度也会随着多聚甲醛质量分数的增加而降低.
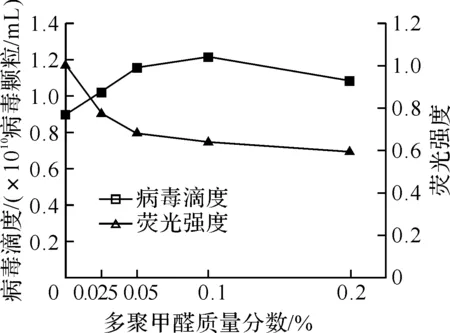
图2 多聚甲醛固定的影响
注: 规定未经固定处理的样本荧光强度为1.
2.2 破膜处理
破膜的主要原理是利用骤冷骤热或破膜剂的溶脂作用增强病毒颗粒的通透性,以便于染料的进入.从图3(a)可知,病毒样本经过冻融处理后,荧光强度逐渐增强,但病毒计数却随之而减少,这可能是由于冻融导致一部分病毒的DNA与染料不能有效地结合.图3(b)是Triton X-100终质量分数为0.2%的直方图,与图1相比较可知:经破膜剂处理后,病毒的荧光信号分散,背景噪音增强,导致两峰交叠,不利于病毒的准确计数.
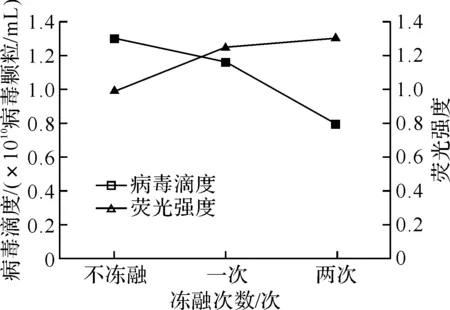
(a)冻融处理的影响
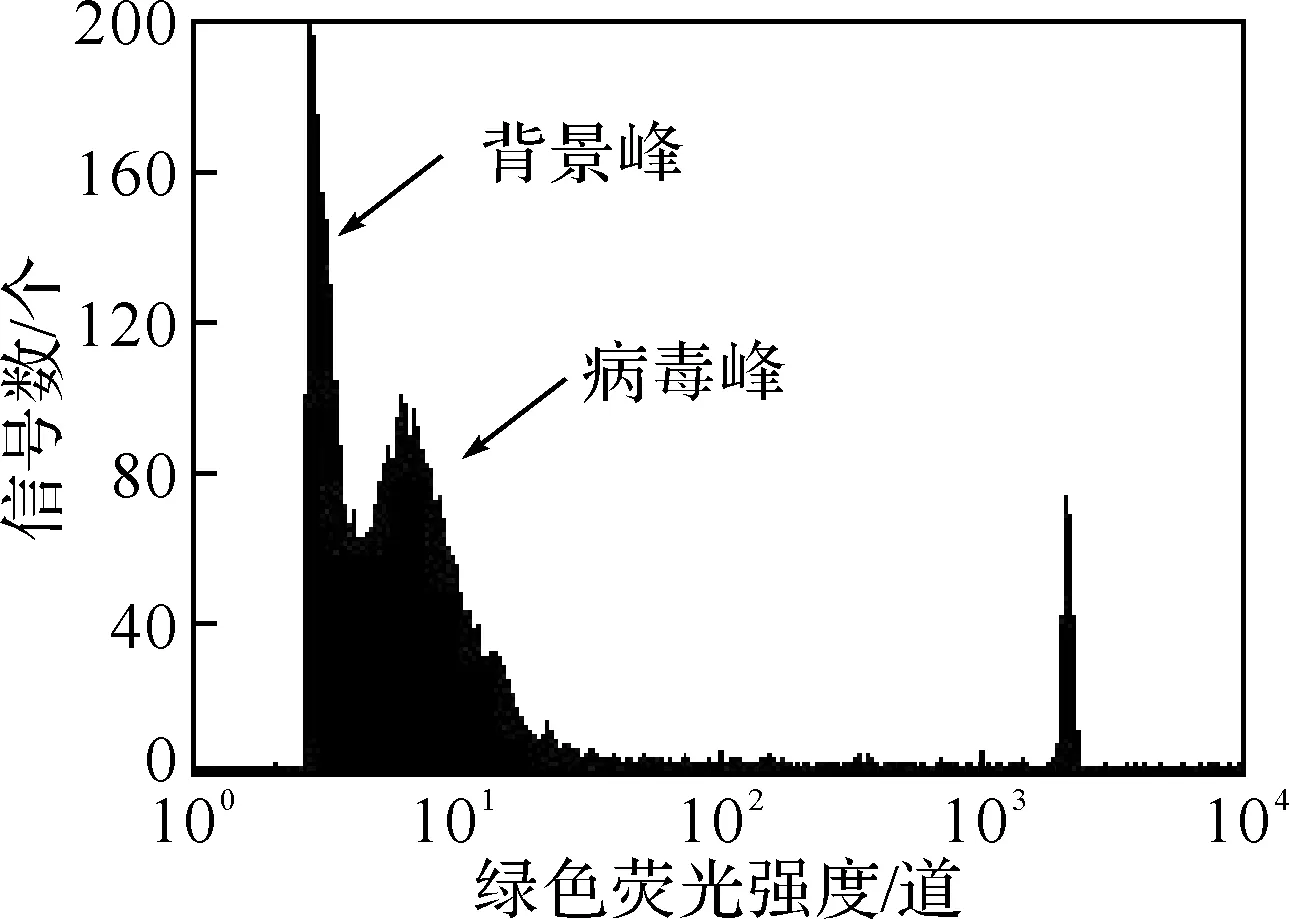
(b)破膜剂处理的影响
Fig.3 Effects of permeabilization on baculovirus counts
注: 规定未经冻融处理的样本荧光强度为1.
2.3 染色温度和时间的影响
孵育过程对病毒计数的影响显著(图4).孵育温度的提高,一方面可以使病毒外壳失活,增强其通透性,另一方可以增强染料的活性,增加计数结果(图4a),但温度过高对染色结果也不利.孵育时间不足,将导致染色不充分,病毒峰与背景峰交叠,不能准确计数,当孵育时间大于10 min后,计数结果保持稳定(图4b).
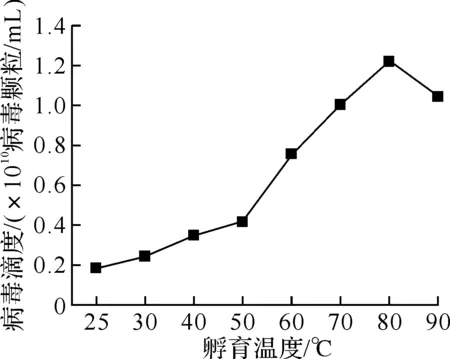
(a)孵育温度的影响
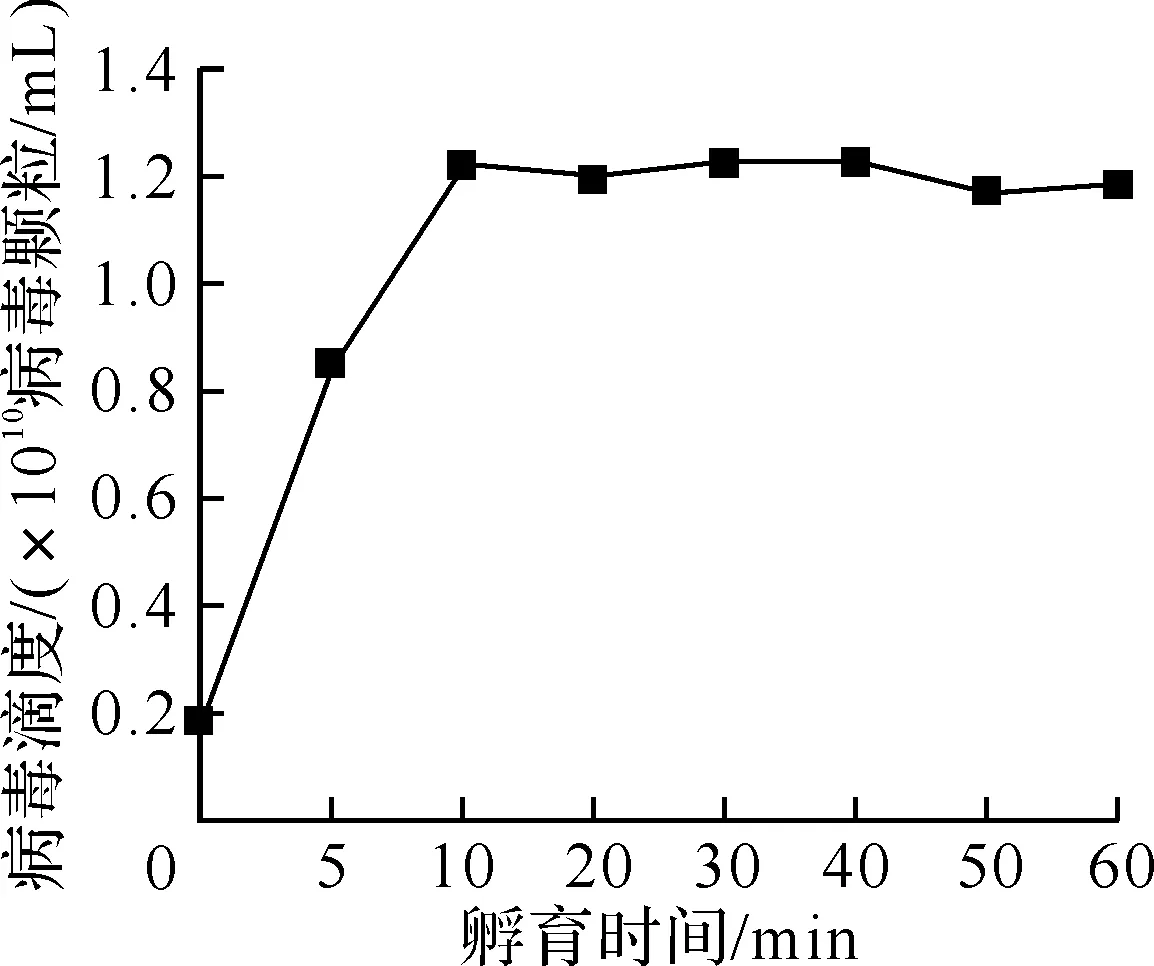
(b)孵育时间的影响
Fig.4 Effects of incubation process on baculovirus counts
2.4 重复性和线性性检测
对于重复性,8次实验结果的平均值为1.22×1010病毒颗粒/mL,最大值为1.43×1010病毒颗粒/mL,最小值为1.01×1010病毒颗粒/mL,CV值为2.4%,这表明该方法的重复性较好.对于线性性,从图5可知,病毒滴度在106~107病毒颗粒/mL范围内,线性性较好(R2=0.999 8).

图5 不同加入体积的病毒计数
注:固定前所有样本均加入PBS缓冲液稀释至960 μL终体积.
2.5 流式细胞术与终点稀释法的计数结果比较
分别采取流式细胞术和终点稀释法测定同一批病毒的滴度,测量结果如表2所示.从表2可知,流式细胞术的重复性(CV=2.4%)明显优于终点稀释法(CV=25.7%).表中流式细胞术的测量结果是终点稀释法的13.7倍,这是因为流式细胞术是直接计数病毒,而终点稀释法测量的是感染单位.一个感染单位对应多个病毒颗粒,所以流式测量结果大于终点稀释法.

表2 终点稀释法与流式细胞术测量结果的比较
3 结 语
病毒最佳染色条件:4 ℃下,0.1%的多聚甲醛固定病毒样本30 min,然后加入SYBR Green I在80 ℃下避光染色10 min.经改进后的流式细胞术测定杆状病毒的方法能够快速而准确的测定杆状病毒的滴度.
参考文献:
[1]Thomas A K, Condreay J P, Donald L J. Baculovirus as versatile vectors for protein expression in insect and mammalian cells[J]. Nat Biotechnol, 2005, 23(5): 567-575.
[2]Radford K M, Cavegn C, Bertrand M, et al. The indirect effects of multiplicity of infection on baculovirus expressed proteins in insect cells secreted and non-secreted products[J]. Cytotechnology, 1997, 24: 73-81.
[3]Zhang Y H, Enden G, Merchuk J C. Insect cells-Baculovirus system: Factors affecting growth and low MOI infection[J]. Biochem Eng J, 2005, 27(1): 8-16.
[4]O'Reilly D R, Miller L K, Luckow V A. Baculovirus Expression Vectors: A Laboratory Manual[M]. New York: Oxford University Press, 1994: 132-134.
[5]Hink W F, Vail P V. A plaque assay for titration of Alfalfa looper nuclear polyhedrosis virus in cabbage looper (TN-368) cell line[J]. J Invertebr Pathol, 1973, 22: 168-174.
[6]Marie D, Brussaard C P D, Thyrhaug R, et al. Enumeration of marine viruses in culture and natural samples by flow cytometry[J]. Appl Environ Microbiol, 1999, 65(1): 45-52.
[7]Brussaard C P D. Optimization of procedures for counting viruses by flow cytometry[J]. Appl Environ Microbiol, 2004, 70(3): 1506-1513.
[8]Shen C F, Meghrous J, Kamen A. Quantitation of baculovirus particles by flow cytometry[J]. J Virol Methods, 2002, 105(2): 321-330.
[9]Fineey D J. Statistical Method in Biological Assay[M]. 3rd ed. London: Charles Griffin & Co., 1978: 394-401.
