沼气常温氧化铁脱硫催化剂的研制
2010-05-29王继科陈金芳
王继科,王 巧,陈金芳,高 路
(1.武汉工程大学科学技术处,湖北 武汉 430074;2.武汉工程大学化工与制药学院,湖北 武汉 430074;3.武汉工程大学绿色化工过程省部共建教育部重点实验室,湖北 武汉 430074;4.武汉工程大学湖北省新型反应器与绿色工艺重点实验室,湖北 武汉 430074)
0 引 言
沼气是农村一种常见的可再生能源,但农村沼气作为可再生能源的清洁环保利用问题一直困扰着中国农村沼气的利用与沼气的发展,主要表现在沼气中的硫化氢气体是一种剧毒的有害气体,在空气中及在潮湿环境条件下,对管道、燃烧器及其它燃烧设备、计量仪表等有强烈的腐蚀作用,硫化氢燃烧后生成二氧化硫(SO2),遇水生成亚硫酸分子,又会腐蚀金属设备、污染环境,并直接危害人的身体健康.沼气作为一种能源使用,其中硫化氢气体含量不得超过20 mg/Nm3,这就是沼气在使用前的脱硫指标.
工业脱硫技术已十分成熟,但简单地将一般工业脱硫技术应用于农村沼气脱硫问题,从上世纪八十年代到今天的农村沼气技术推广的实践过程证明是困难的.如何让中国农村中还不太富裕的广大农民安全、方便、经济地使用脱硫技术,是解决农村沼气发展与清洁、环保利用的关键.
沼气是一种可燃性混合气体,内含甲烷(CH4)质量分数为60%~70%,二氧化碳(CO2) 质量分数为25%~40% 以及少量的氨(NH3)、氢(H2)和一氧化碳(CO)等.不同原料制成的沼气中还含有硫化氢 (H2S),其含量一般约在1~11 g/m3.
沼气脱硫方法,一般分为直接脱硫法和间接脱硫法两大类.所谓直接脱硫法是将沼气中已产生的硫化氢气体加以脱除,而间接脱硫法是指通过某些方法,减少或抑制硫化氢气体的产生,从而达到脱硫的目的,目前沼气脱硫还是以直接脱硫法为主.
沼气直接脱硫法,其原理可参照煤气的脱硫方法,为湿式法和干式法两类.湿式法主要有水洗法、ADA法(蒽醌二磺酸钠法)、改良ADA法、砷碱法、烷基醇胺法、碱性盐液法等;干式法主要有氧化铁法、活性炭法等.
对于农村沼气的脱硫来说,较适合脱硫的方法是干式法中的常温氧化铁法.干式常温氧化铁法脱硫原理:当硫化氢(H2S)与活性氧化铁接触时,经化学反应生成硫化铁.在常温下起脱硫作用的物质,邢同春[1]认为主要是α-FeOOH和β-FeOOH两种水合氧化铁及含水的γ-Fe2O3其中α-FeOOH活性最高.
成型的脱硫剂国内在1984年由太原工学院研制了TG-1型、TG-2型、TG-3型系列脱硫剂产品,(市场上称ST-801型常温氧化铁脱硫剂).其主要成分除Fe2O3、水、炭外,还有MgO、CaO和A12O3等原料.
TTL-1型脱硫剂也是一种成型脱硫剂.它是以活化处理后的赤泥为主要原料,再加入一定数量的添加剂,经混合、揉和、成型和烘干等加工而成.
2000年任爱玲[2]报道了硫酸烧渣、转炉赤泥、平顶炉尘中Fe2O3质量分数均大于50%,且活性好,是制备脱硫剂理想的原料,再配以粘结剂、制孔剂、活性助催化剂、水分等,可制备出不同的成型脱硫剂.脱硫剂最佳配方为粘合剂质量分数为5%~8% 、制孔剂质量分数为0.08%~0.1%、木屑质量分数为8%~l2% 、工业废渣质量分数为78%~88%,成型的最佳温度为 150 ℃ .
呼德龙等研究氧化铁的活性问题[3]指出,在氧化铁几种形态中,只有α-Fe2O3、γ-Fe2O3活性较高;他们还比较了各种氧化铁脱硫剂的活性,认为用赤泥作为脱硫剂,活性铁含量很高,寿命比沼铁矿和人工氧化铁长得多,如果其活性铁含量少,可通过人工氧化进行提高.李彦旭[4]用动态热重天平研究了赤泥制备的高温煤气脱硫剂还原和硫化的动力学行为,两个过程初期均为化学动力学控制,进而转入内扩散控制,采用等效粒子模型,给出了不同的控制段的动力学参数.
NT705型脱硫剂[5]为中石化南化集团研究院和中石化安庆公司研究院共同开发的新型脱硫剂,它以氧化铁为主,氧化锌为辅,并添加少量助剂经压片成型制得.
太原理工大学的高志华等[6]进行的纳米α-FeOOH催化剂一段法脱除COS和H2S性能的研究为常温氧化铁精脱硫开辟了新领域.该研究已初步表明:以纳米α-FeOOH为活性组分制备的催化剂在催化COS水解的同时也可以有效地脱除H2S.
巩志坚[7]等提出:在FeCl2-NH4OH体系,采用不同碱比(n=1,0.8)、不同通气量(1.25 L/min和1.5 L/min)和不同氧化方法制备了多个FeOOH样品,对样品进行TEM、XRD、TG表征说明,氧化速率降低易生成低脱硫活性的Fe3O4或γ-FeOOH、α-FeOOH和Fe3O4的混合相,提高空气流量,或添加氧化剂加快氧化速率,可生成脱硫活性较高的FeOOH.
(1)随着药学专业教育教学改革纵深发展,我们必须加强与国内知名医药行业企业的技术合作。因此,聘请或引进医药学专家作为我校药学专业客座教授或兼职教授势在必行,刻不容缓。
刘振义等[8]介绍了以硫酸亚铁和氢氧化钠为主要原料,采用沉淀方法,经过滤、洗涤、烘干得到一种无定型羟基氧化铁,用无氧H2S标准气测量其穿透硫容大于50,是一种高硫容脱硫剂的活性组分,用于脱除气体或液体物料中的H2S.
兰昌云[9]介绍了:脱硫剂的主要成分为Fe2O3·H2O,为了发挥主成分作用,加入助剂和制孔剂.一般助催化剂本身有较好的脱硫作用,加入到Fe2O3·H2O中起协同作用,有利于提高脱硫效果.制孔剂是用来增大脱硫剂的孔隙率、比表面积的,以增加H2S与Fe2O3·H2O接触机遇,提高Fe2O3·H2O脱硫效率.通过对多种助剂和制孔剂进行的试验比较,选出了有助于提高脱硫效果的助催化剂和制孔剂.结果表明,选择以锌盐为助剂、NH4HCO3为制孔剂,同时加入一种碱助剂按一定比例所制得的脱硫剂的脱硫效果会更好.
1 脱硫原理
沼气经过氧化铁催化剂颗粒堆积的固定床层时,沼气中的硫化氢被固定床层中的氧化铁吸收,并发生下列化学反应:

Fe2S3+4H2O+21.7 kJ/mol
(1)
反应的结果是氧化铁与硫化氢反应生成了硫化铁,先前浅黄色的催化剂颗粒被转化成黑色的催化剂颗粒.
氧化铁脱硫催化剂为条状多孔结构固体,对硫化氢能进行快速的不可逆化学吸附,在M酸助催化作用下,数秒内可将硫化氢脱除到1 mg/Nm3以下.氧化铁在该过程中转化为硫化铁.当硫化铁与氧接触时,硫化铁被氧化为单体硫及氧化铁,此为脱硫催化剂的再生.脱硫再生可循环多次,直到脱硫催化剂中毛孔被硫堵塞而失活.好的常温氧化铁脱硫催化剂的累计硫容量可达30%~40%以上,脱硫效率均在99%以上.为了保证脱硫催化剂脱硫能力的充分发挥,按其机理正确使用脱硫催化剂犹为重要,其机理影响因素主要为:a. 使用环境温度. 室温条件下均可使用,最佳温度为4~40 ℃,一般用户都可达到,但冬季室外使用要注意保温.b. 使用寿命. 再生是保证脱硫催化剂使用寿命的重要性能.再生温度应低于70 ℃,对于塑料脱硫罐,笔者建议不采用连续再生的方法,主要因为氧含量不易控制,一旦超温对脱硫罐和脱硫催化剂本身都会造成不良后果.需要再生时,应首先将脱硫罐拆离沼气系统,迅速打开脱硫罐,将脱硫催化剂平铺于干燥阴凉处,以防止局部过热.再生反应过程维持24~48 h为宜.

2FeOOH+6S+196.8 kJ/mol
(2)
2 脱硫催化剂的制备
在氧化铁脱硫催化剂中,FeOOH是脱硫催化剂的主体.其反应如下所示:

Fe2S3+4H2O+21.7 kJ/mol
(3)
了解脱硫催化剂脱硫能力的极限是设计过程必须考虑的问题.
2.1 理论硫容
按式(1)计算,理论上每100 g FeOOH可吸收脱除57.5 g H2S气体.但纯净的FeOOH用于制备脱硫催化剂,一方面成本较高;另一方面难以实现将催化剂中的Fe2O3·H2O全部利用.为了充分利用价格较高的Fe2O3·H2O,需要用价格低廉的物质作赋形剂和成核剂.
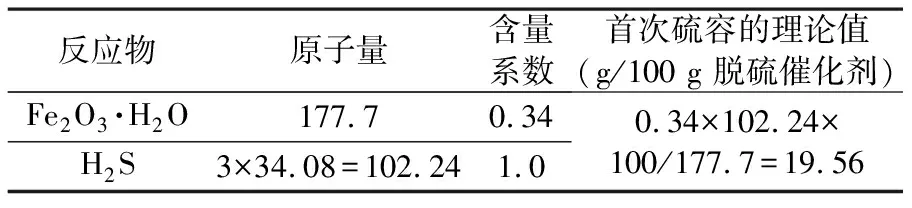
表1 氧化铁催化剂理论硫容的计算
2.2 赋形剂和成核剂的选定
价格较低,满足产品性能的需要是赋形剂和成核剂的选定的基本原则.硫酸钙常以3种不同的水合物结晶析出.根据生产条件的不同,可生成二水硫酸钙、半水硫酸钙和无水硫酸钙3种晶须物,而二水硫酸钙晶体热力学性质最为稳定.生产中主要形成二水硫酸钙即CaSO4·2H2O的晶须状形态.
二水硫酸钙结晶的实质是反映结晶过程,其中包含反应和结晶2种过程.在反应结晶过程中,通常还伴随着粒子的老化、聚结和破裂等二次过程.结晶过程又包括晶核形成和晶体生长2个阶段,其中晶核的形成有初级成核和二次成核2种模式.实验表明,在较低过饱和度下,二水硫酸钙晶体生长过程主要为表面反应控制.
典型的二水硫酸钙结晶为斜方晶体,其长宽比为2~3.在氧化铁脱硫催化剂的生产过程中硫酸钙,不是以单一结晶形态出现而是以硫酸钙的非定型的混合晶系为核心,以含水氧化铁为表面的多孔固体物质.细微的晶须状硫酸钙在氧化铁脱硫催化剂中立体穿织,使得疏松的氧化铁脱硫催化剂成长为抗压强度较高的固体物.硫酸钙晶须含量越高,最终产品的强度就越大.随着硫酸钙晶须质量的增加,会降低主体有效物质Fe2O3·H2O的质量含量,降低最终产品的首次脱硫硫容.硫酸钙在氧化铁脱硫催化剂中的用量的太少,会降低主体有效物质FeOOH的利用率.因此,选择合理的用量能获得较大的技术经济效果.
2.3 助催化剂的选定
虽然Fe2S3是一种性能较稳定的物质,但在空气中会发生氧反应:

(4)
这个过程实现了使脱硫催化剂获得了再生.Fe2S3是在脱硫过程中形成的,如式(1).在没有其他助催化剂的条件下,很容易附着在脱硫催化剂的微孔上,随着Fe2S3的积累,微孔逐渐堵塞.这种堵塞,一方面降低了脱硫硫容(简称,硫容);另一方面影响了脱硫催化剂的再生.为了提高首次硫容和再生效率,在配方中引入一种助催化剂是必要的.
在沼气脱硫时,体系处于H2S的酸性介质中.这要求在弱酸性环境下,加入的助催化剂有助于脱硫过程.在离开了沼气脱硫的过程后,助催化剂的作用应该是促进硫化铁在空气中的自动氧化.满足这一特性并与脱硫、再生环境形成一种正偶合关系.在配方中引入M酸有助于提高硫容,方便再生.
碳酸钙与硫酸亚铁都是固体物质,固—固相化学反应比较困难,引入M酸后有助于活性氧化铁的生成,缩短化学反应时间.M酸自身也具有脱硫能力.
2.4 原料的配方范围
在脱硫催化剂中,对于质量分数在20%以上的M酸加入量质量分数为1%~8%就可反映明显的助催化效果.当要制备高硫容的脱硫催化剂时,可考虑将M酸的用量提高到质量分数为20%.水的用量受温度的约制,加水的目的仅仅是为了方便造粒成型.因此,水的用量能减则减,这是节能降耗的需要.
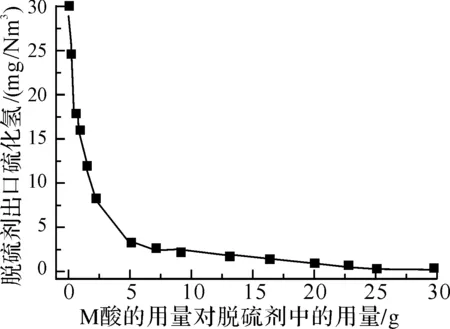
图1 M酸的用量对脱硫效果的影响
理论上每100 g活性氧化铁(Fe2O3·H2O或FeOOH)一次可吸收脱除57.5 g H2S气体.但纯净的活性氧化铁用于制备脱硫催化剂:一方面难以成型;另一方面,当活性氧化铁的质量分数大于20%以后利用效率在下降.如图2所示,活性氧化铁反应的加入上限在73.5%.

图2 脱硫剂中活性氧化铁的含量与脱硫剂硫容的关系
表2氧化铁脱硫催化剂的生产配方范围(质量分数/%)
Table 2 Scope of production ratio for Components of desulfurization (mass%)

原料名称活性氧化铁1M酸2其他物质3水配方比例范围10~73.50.5~2220~600~10
2.5 生产工艺
以上几种原料经搅拌混合后在氧气的作用下能够发生固相反应,得到的混合产物经过处理后即为脱硫剂.工艺流程见下图:

图3 脱硫剂制备工艺流程图
首先将白色2号原料与黑色3号原料混合搅拌5 min,随后取足量1号原料使之与2、3号的混合料进行充分混合,不断搅拌25 min使三种固体原料均匀分散以便于充分反应.混合后的物料在空气中发生反应,反应时间持续8 h,若将物料经常翻动则有利于反应的进行.然后向该物料表面添加一定量(按混合料总质量的5%计)的自来水,搅拌使均匀混合,由传送机输送至加料机,造粒好的物料送至带式干燥机进行干燥,最后将成品包装储存待销售.
2.6 产品硫容分析
造粒、干燥好的脱硫催化剂是一种长3~8 mm,直径3~5 mm的柱状颗粒.经分析[10]一次硫容达13.0%,累计硫容达54.2%.在湖北省松滋市农户现场首次使用硫容测试结果为13.4%.脱硫器出口沼气中硫化氢的含量按醋酸铅比色法[11]和亚甲基蓝分光光度法[12]在0.2 mg/m3以下.
3 结 语
当脱硫剂工作一定时间后,脱硫剂的活性逐渐下降,脱硫效果逐渐变差.一般用常规型氧化铁脱硫剂时,当脱硫装置出口沼气中硫化氢含量超过20 mg/m3,而脱硫剂硫容量未达到30%时,脱硫剂可进行再生,脱硫剂硫容量超过30%以上时,就要更换新脱硫剂.
经实验证明,加有M酸的常温氧化铁脱硫剂,一次硫容达13.0%,累计硫容达54.2%.在农户沼气脱硫的洁净度较高,且能再生后反复使用,降低了用户的成本.
参考文献:
[1]邢同春.关于干式氢氧化铁脱硫的分析[J].煤气与热力,1990,10(6):18-22.
[2]任爱玲, 阮宜纶.以工业废物制备高效氧化铁系脱硫剂的研究[J].环境工程,2000,18(4):40-43.
[3]呼德龙,马凤美.关于氧化铁脱硫剂活性问题的探讨[J].煤气与热力,2000,20(2):126-127.
[4]李彦旭,钟炳.氧化的脱硫剂高温煤气脱硫行为的研究:还原及硫化动力学[J].燃料化学学报,1998,26(2):130-134.
[5]刘斐,房鼎业,石天宝.NT705型脱硫剂的本征动力学研究[J].化学工业与工程技术,2004,25(4):21-24.
[6]高志华,阴丽华, 李春虎,等.纳米α-FeOOH催化剂一段法脱除COS和H2S性能的研究[J].燃料化学学报,2003,31(3):249-253.
[7]巩志坚, 田原宇,李文华,等.不同原料制备羟基氧化铁的晶型及脱硫活性研究[J].煤炭学报,2006,31(6):790-793.
[8]刘振义,刘凤仁.一种高硫容氧化铁脱硫剂活性组分的表征[J].气体净化,2006,6(C00):107-111.
[9]兰昌云, 何新秀, 徐海军,等.高效常温氧化铁脱硫剂的制备[J].天然气工业,2004,24(12):124-126.
[10]沈凯.NCT型常温氧化铁脱硫剂的研制[J].南化科技,1993,14(3):11-14.
[11] 王丽琴,王晓琪,马永强,等.纸带—光纤技术对硫化氢气体测量的初探[J].分析试验室,2002,21(4):49-51.
[12]中华人民共和国国家标准. GB 12211-90城市燃气中硫化氢含量测定[S].北京:中国标准出版社,1991.
