茯苓菌丝体液体培养条件研究
2010-05-29胡国元游慧珍董兰兰戴欣鹏李伟伟李友国
胡国元,游慧珍,董兰兰,戴欣鹏,李伟伟,胡 婧,李友国
(1.武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色工艺重点实验室,湖北 武汉 430074;2.华中农业大学农业微生物学国家重点实验室,湖北 武汉 430070)
0 引 言
茯苓(Poriacocos)属食药两用的大宗药材.茯苓的主要成分是β-茯苓聚糖,约占干重92%.其次为戊聚糖、果糖、葡萄糖、甲壳素、腺嘌呤、组氨酸、蛋白质、粗纤维、胆碱、酶、卵磷脂、硬朊、麦角甾醇和灰分.另外,还含有三萜类化合物[1].从茯苓中提取制备的茯苓多糖或茯苓异多糖具有促进细胞分裂、补体激活、抗诱变、抗肿瘤 、增强免疫 等生物活性[2].茯苓加工利用或提取制备茯苓多糖的主要原料来源为茯苓菌核.但传统的茯苓栽培法生产的茯苓菌核的生产周期长,产量也不高,且松材消耗量大.用液体培养技术生产茯苓菌丝体,从茯苓菌丝体和发酵液中提取茯苓多糖等活性物质,可较好地解决人工种植茯苓的替代问题,节省了大量的木材,对我国资源和生物多样性的保护有着重要的意义.液体培养生产茯苓菌丝体可连续性地进行规模化工业生产,大大缩短了生产时间,降低了生产成本[2-4].
文献[3-5]报道碳源、氮源与初始pH值为影响茯苓菌丝体液体培养菌丝体产量和和发酵液中胞外多糖产量的主要因素.本实验对不同茯苓菌株的菌丝生长速度比较,筛选出生长速度较快的菌株,在此菌株的基础上探讨了接种量、接种方式、碳源、氮源、初始pH值等因素对茯苓的菌丝体产量和胞外多糖产量的影响,以期确定茯苓液体培养的培养基中最适碳源、氮源和初始pH值.为规模化液体培养茯苓菌丝体和生产茯苓多糖作前期研究工作.
1 材料与方法
1.1 材料
1.1.1 供试菌株 鄂苓1号:从华中农业大学菌种实验中心购买.鄂苓2号:由湖北省中医研究院王克勤研究员惠赠.鄂苓1号和鄂苓2号均为湖北省茯苓栽培菌株.
1.1.2 培养基 母种斜面培养基[5]:葡萄糖20 g,酵母菌膏2 g,蛋白胨2 g, KH2PO40.46 g,K2HPO41 g,MgSO4·7H2O 0.5 g,琼脂20 g,水1 L,pH值为自然状态.
平板培养基:同母种斜面培养基.
种子培养基[3,6]:葡萄糖20 g,酵母菌膏5 g,蛋白胨4 g,KH2PO40.46 g,K2HPO41 g,MgSO4·7H2O 0.5 g,水1 L.
摇瓶发酵培养基:在不含碳源、氮源的种子培养基中,按L9(33)正交试验表(表1)加入相应碳源和氮源,并调节pH值.
1.2 方法
1.2.1 接种和培养 由斜面菌种挑起1块约1.0 cm2菌块接入培养皿中央,26 ℃恒温培养4 d,菌丝均匀长满培养皿,作为固体菌种备用[3,6].
在250 mL三角瓶装入60 mL液体种子培养基,用打孔器把生长于平板外侧的菌丝打孔接种到三角瓶,每瓶接种4块直径为8 mm的菌块,培养温度为26 ℃,摇瓶转速为150 r/min的培养条件下进行摇瓶培养7 d,作为液体菌种备用[3,6].
菌种设置为固体种(接种4块直径为8 mm的菌块[6])、液体种(按6%菌种量接液体种[3]);摇瓶体积及装液量设置为250 mL三角瓶装液60 mL[3];摇床转速150 r/min[3],温度26 ℃[3];接固体种培养15 d[6],接液体种培养6 d[3].
1.2.2 正交试验 本试验选择L9(33)正交试验优化培养基中的[3-4],正交试验因素水平如表1.
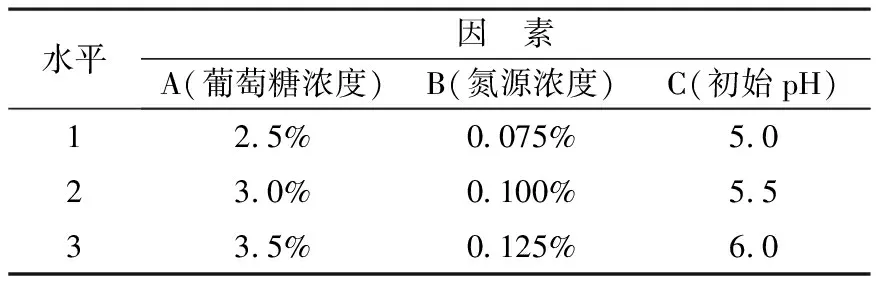
表1 正交试验L9(33)因素与水平
1.2.3 分析和测定a.生长速度的测定.用打孔器打孔接种1块直径为8 mm活化的茯苓菌块在直径为95 mm的平板中央, 26 ℃恒温培养,每隔24 h测定菌块菌丝生长的直径,菌丝长满平板停止测量.根据直径的大小比较不同菌株菌丝的生长速度.b.菌丝干重的测定. 收取的发酵液以砂芯漏斗真空抽滤,用蒸馏水反复洗涤菌丝球,直到洗净菌丝球中残留的培养液,得到的菌丝球于60 ℃下烘干至恒重,以1 L发酵液中菌丝体干重(g/L)计.c.多糖的测定.采用苯酚—硫酸法测定发酵液中总糖的含量,用葡萄糖制作标准曲线,以校正系数0.9校正总糖含量的测定值,校正后的值为相应发酵液中的多糖含量[7].d.pH值测定.采用pHS-3C酸度计测定pH值.
1.2.4 光学显微镜观察 将液体培养形成的不同直径大小的菌丝球分别取样,制片,观察,拍照[8].
2 结果与讨论
2.1 不同茯苓菌株菌丝生长速度的测定
将活化的鄂苓1号、2号同时采用打孔器接种到平板上培养4 d,其菌丝生长速度测定结果见图1.鄂苓1号、2号在平板上菌丝浓厚粗壮,长势旺盛.从图1可知,鄂苓2号比1号生长速率相对快些,后续实验选择鄂苓2号为试验菌株.
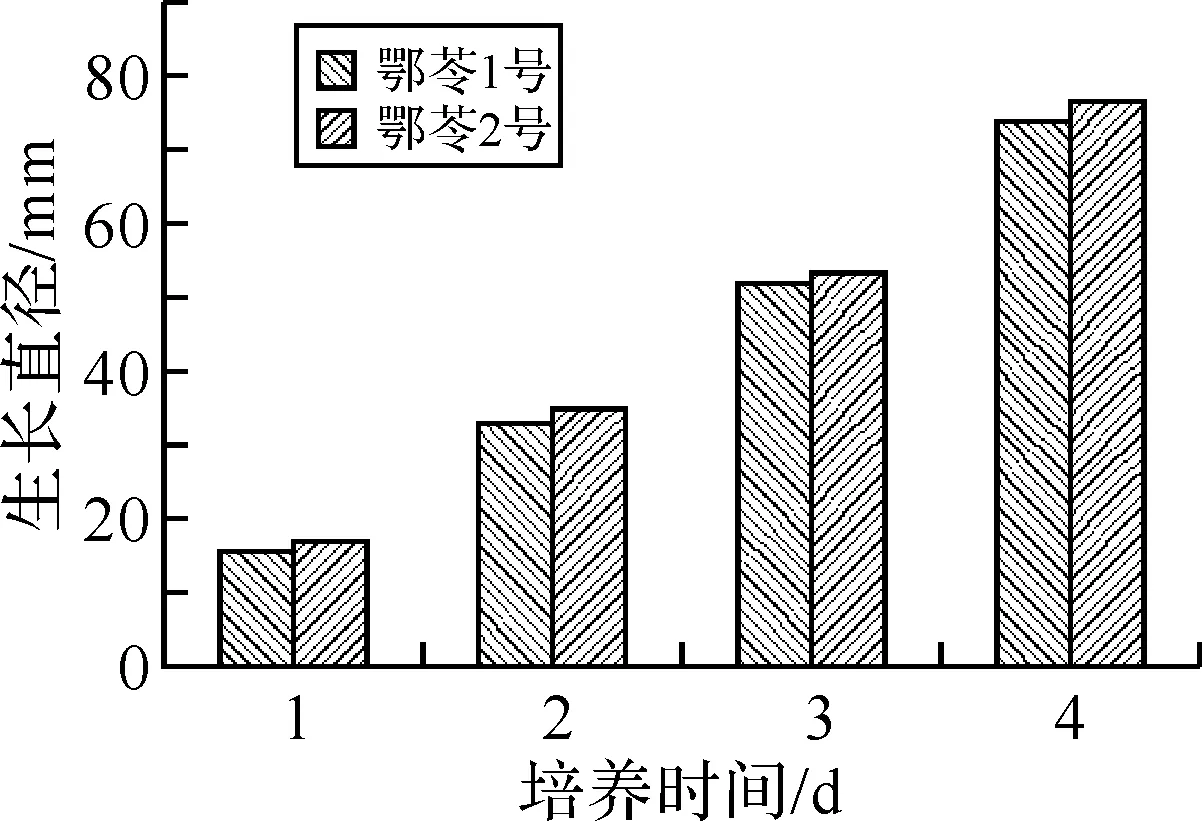
图1 2个茯苓菌株菌丝生长速度测定
2.2 不同固体种接种量对茯苓菌丝体产量的影响
在250 mL三角瓶中装入60 mL种子培养基,将活化的鄂苓2号菌种用打孔接种的方式接种,接种量设置为4、6、8和10块.通过液体摇瓶培养,比较其生成的菌丝体重量来确定最佳接种量.结果表明(见表2),接种量为4块时,菌丝体产量最高.
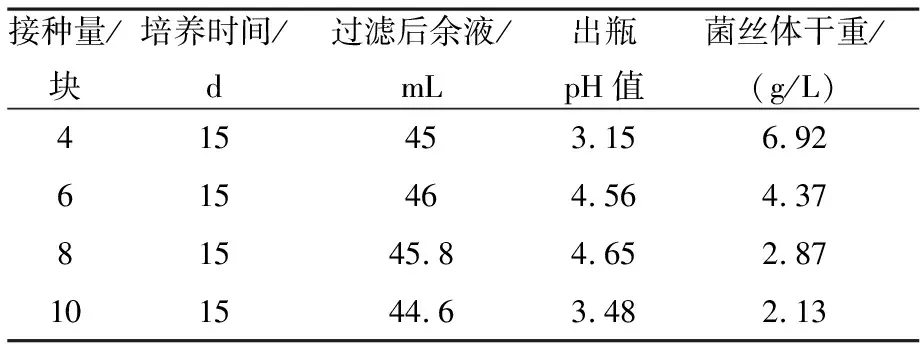
表2 不同固体种接种量对茯苓菌丝体产量的影响*
2.3 不同接种方式对茯苓菌丝体产量的影响
在鄂苓2号的液体培养中,采用固体种、液体种接种,培养基为种子培养基,进行对比试验的结果见表3.在茯苓菌丝培养过程中,接液体种比固体种产量高,菌丝发育点多、接种后菌丝蔓延迅速、菌龄整齐,培养的菌丝球大小较均匀.
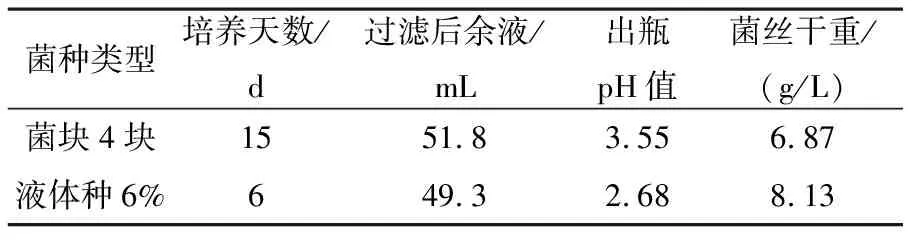
表3 不同接种方式对茯苓菌丝体产量的影响*
2.4 茯苓液体培养基优化的正交试验
本试验选择L9(33)正交试验优化培养基[3-4],正交试验因素水平见表1.分别做固体接种方式、液体接种方式的正交试验,分别以菌丝体干重、胞外多糖含量为考察指标,分析试验结果,确定茯苓培养的培养基中的最适碳源、氮源和初始pH值.
2.4.1 以菌丝体干重为指标,固体接种方式的正交试验 采用固体接种茯苓菌丝块4块于摇瓶中培养15 d,以菌丝体干重为指标,正交试验结果及分析如表4.
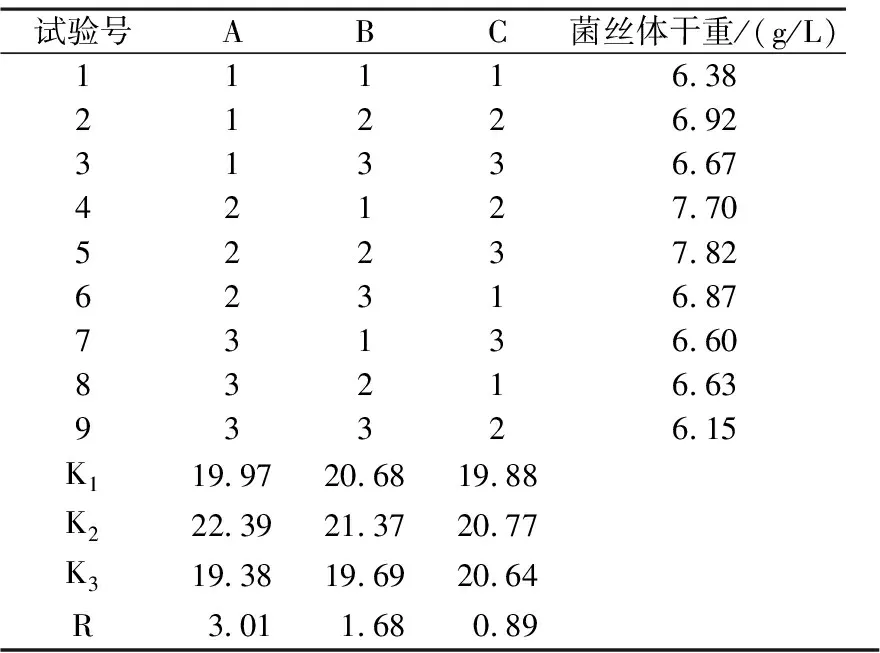
表4 固体接种的正交试验结果与分析
由表4可知,RA>RB>RC.说明3因素对固体接种培养菌丝体生物量的影响顺序是碳源浓度>氮源浓度>pH值.菌丝体产生物量的最优组合为:A2B2C2.由此可知,碳源浓度对茯苓菌丝体产量的影响最大,其次为氮源浓度,而培养基初始pH值影响最小.
2.4.2 以菌丝体干重为指标,液体接种方式的正交试验 采用液体接种方式按6%的接种比例接液体种,摇床培养6 d,以菌丝体干重为指标,正交试验结果及分析如表5.
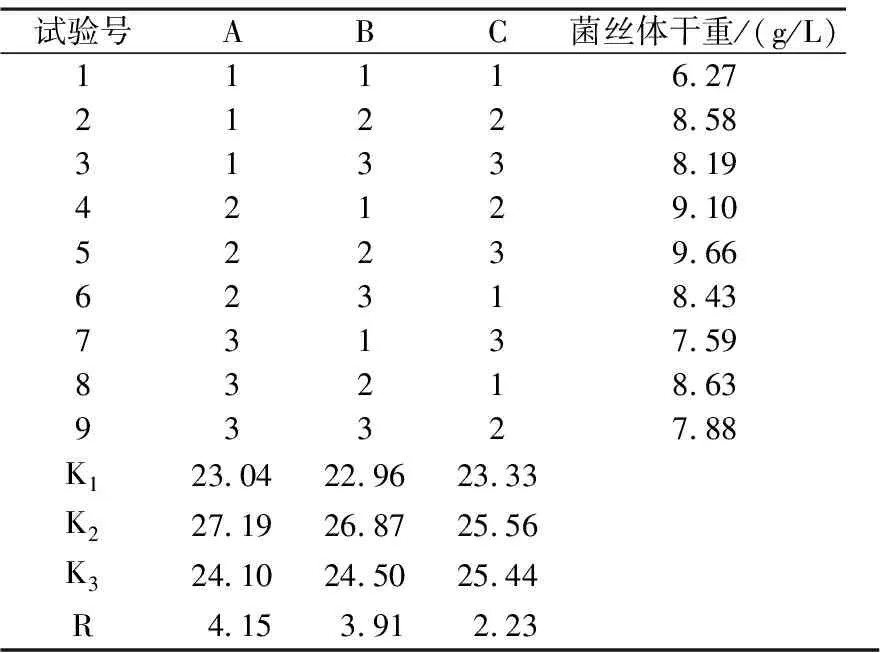
表5 液体接种的正交试验结果与分析
由表5可知,RA>RB>RC.说明3因素对液体接种培养菌丝体生物量的影响顺序是碳源浓度>氮源浓度>pH值.菌丝体产生物量的最优组合为:A2B2C2.由此可知,碳源浓度对茯苓产量的影响最大,其次为氮源浓度,而初始pH值影响最小.
2.4.3 以胞外多糖为指标,液体接种方式的正交试验 采用液体接种方式按6%的接种比例接液体种,摇床培养6 d以胞外多糖含量为指标,正交试验结果及分析如表6.
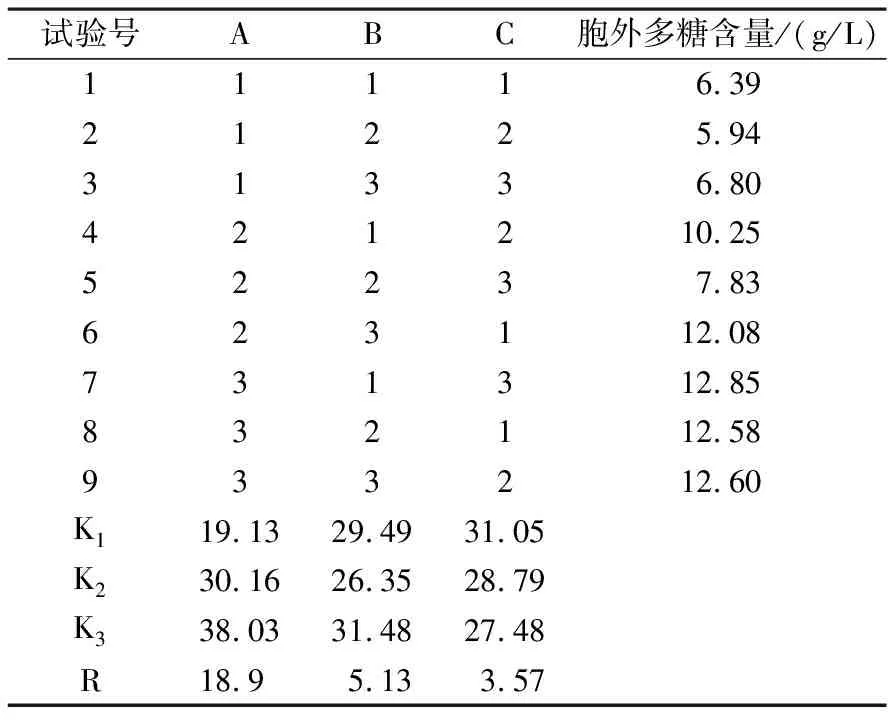
表6 液体接种的正交试验结果与分析(以胞外多糖为指标)
由表6可知,RA>RB>RC.说明3因素对液体接种培养的菌丝体胞外多糖含量的影响顺序是碳源浓度>氮源浓度>pH值.菌丝体胞外多糖积累的最优组合为:A3B3C1.由此可知,碳源浓度对茯苓胞外多糖产量的影响最大,其次为氮源浓度,而初始pH值影响最小.
2.5 菌丝球的形态观察
本试验对固体接种方式液体培养后期的茯苓菌丝球进行了显微观察,结果显示发育较充分的圆形菌丝球有一个明显中央核,外层菌毛区菌丝长度较长而且密度较大.而不规则的菌丝球的核并不像前者那么明显.在整个发酵过程中,菌丝球直径并不是都一样的,分别对其进行染色、制片观察,可知直径为1、2 mm的菌丝球着色均匀,说明菌丝的生活力强.直径为5 mm的菌丝球核出现着色不均匀的现象.而在发酵过程中由于转速或粘度等的影响会产生非球形的大菌块,其中间的菌丝不易着色[8].
3 讨 论
通过比较接种量、接种方式、碳源、氮源、初始pH值等因素对茯苓的菌丝体产量和胞外多糖产量的影响,结果表明:其作用大小是碳源>氮源>初始pH值.以菌丝干重为指标,茯苓液体发酵的发酵培养基中:最适碳源为葡萄糖(3%,质量分数,下同),最适氮源为酵母浸膏(0.51%)和蛋白胨(0.4%),最适初始pH值为5.5.以多糖为指标,茯苓液体发酵的发酵培养基中:最适碳源为葡萄糖(3.5%),最适氮源为酵母浸膏(0.637%)和蛋白胨(0.5%),最适初始pH值为5.0.茯苓菌丝球的形态观察结果显示菌丝球直径大小、菌丝球中央核的大小及其染色均匀程度等都会影响到菌丝的生长速度,从而影响生物量[8].
在茯苓液体发酵过程中,采取液体接种具有生产周期短、菌丝发育点多、接种后菌丝蔓延迅速、菌龄整齐等特点,所以可以采用液体接种方式对茯苓进行液体培养或用于制备用于茯苓栽培的液体菌种.茯苓发酵终点的判断还需深入研究,目前多数真菌发酵主要依据菌丝体的产量、培养液中的pH值、还原糖、含氮量、培养液的颜色变化以及菌丝球的形态变化等来判断[1,9].茯苓液体发酵过程中的C、N消耗、pH值需进行动态检测,并结合菌丝球的形态变化等,确定发酵终点.另外,在液体培养过程中,由于营养成分的消耗会使菌丝球的生长受到影响,也可以采用补料的方式[10],提供其足够的营养物质,延长发酵时间,来提高茯苓菌丝体及其胞外多糖的产量.
当然,继续选育适于液体培养的高产茯苓菌株也是今后应进一步研究的课题[11].李慧等[4]报道无机碳源与有机碳源和无机氮源与有机氮源配合使用,有利于茯苓菌丝体大量生长繁殖,并可诱导促进茯苓多糖的产生和积累,为此,茯苓液体培养的优化工作还需继续探索下去.
参考文献:
[1]林树钱.中国药用菌生产与产品开发[M].北京:中国农业出版社:204-206,316-317.
[2]林雨露,张俐娜,金勇,等.人工培养菌种茯苓菌丝体多糖的分离、组成和分子量[J].高分子学报,2003(1):97-103.
[3]李羿,万德光,裴瑾,等.茯苓液体发酵条件的研究[J].成都中医药大学学报,2005,28(1):52-55.
[4]李慧,常景玲.茯苓多糖发酵工艺的优化[J].安徽农业科学,2006,34(5):920-921.
[5]邵伟,乐超银,熊泽,等.茯苓液体发酵条件的研究[J].食用菌,1999,4:2-3.
[6]胡国元,李伟伟.富硒金针菇深层培养研究[J].湖北民族学院学报,2002,18(2):21-23.
[7]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1998:11-12.
[8]雷德柱.灰树花菌丝的深层发酵及其多糖的研究[D].广州:华南理工大学,2001.
[9]陶文沂,敖宗华,许泓瑜,等.药食用真菌生物技术[M].北京:化学工业出版社,2007:59-60.
[10]李羿,万德光,杨胜.茯苓摇瓶补料发酵和发酵罐补料发酵[J].成都中医药大学学报,2006,1(1):55-57.
[11]卫军,黄鹤,王丽娟,等.茯苓液体发酵条件研究及保健饮料研制[J].食品研究与开发,2006,27(5):85-88.
