实验性小鼠皮肤着色真菌病MCP-1和MIP-2研究
2010-05-28柴宝熊瑛
柴宝 熊瑛
(1.广东医学院附属深圳南山医院皮肤科,深圳518052;2.南方医科大学附属深圳市妇幼保健院皮肤科,深圳518052)
着色真菌病发病机制的研究进展认为细胞免疫(CMI)在其防御机制中非常重要[1-3]。炎症细胞在众多因子的作用下聚集到炎症部位,发挥免疫作用。趋化性细胞因子 (chemokine)作为参与炎症过程的重要细胞因子,对白细胞有趋化和化学增活作用。尽管在真菌感染中趋化性细胞因子作用的研究有较多报道,但着色真菌病趋化性细胞因子方面的研究尚为空白。本文选取对多种免疫效应细胞具有趋化作用的MCP-1(单核细胞趋化蛋白)、MIP-2(IL-8,中性粒细胞趋化因子),在建立小鼠皮肤着色真菌病模型基础上,实时定量PCR方法检测感染后不同时间内小鼠皮损局部组织中2种趋化性细胞因子的mRNA表达水平,ELISA方法检测皮肤组织中2种趋化因子相应的蛋白水平,探讨趋化性细胞因子在着色真菌感染中可能的作用。
1 材料和方法
1.1 材料
卡氏支孢霉D10a,由中国微生物菌种保藏管理委员会医学真菌中心 (中国医学科学院皮肤病研究所,南京)提供。RNA抽提试剂盒购自QIAGEN公司,逆转录试剂盒为Gibco公司产品,荧光实时定量PCR试剂盒为Invetrogen公司产品,小鼠MCP-1、MIP-2 ELISA试剂盒购自深圳晶美生物公司,地塞米松和甲氨蝶呤购自Sigma公司。
1.2 卡氏支孢霉悬液制备
将普通沙氏培养基(SDA)26℃培养2周的卡氏支孢霉黑色菌落挑出,制备浓度为1×108cfu/mL的卡氏支孢霉悬液,另外,再将部分卡氏支孢霉悬液高压灭菌备用。
1.3 小鼠皮肤着色真菌病模型
选取6~8周龄雄性ICR小鼠,18~22 g,随机分为3组,每组15只:A组为正常小鼠皮下接种1×108cfu/mL灭活卡氏支孢霉悬液0.025 mL;B组为正常小鼠皮下接种同样浓度和体积的卡氏支孢霉悬液;C组为小鼠先经腹腔注射甲氨蝶呤100 mg/kg(1次/3 d,共2次),同时灌喂地塞米松2 mg/(kg·d)连续8 d以造成免疫抑制后,皮下接种同样浓度和体积的卡氏支孢霉悬液。各组动物在接种后第7 d、30 d、60 d每次处死5只小鼠,取病变处皮肤组织,-70℃保存。
1.4 荧光实时定量PCR
采用TRIzol法提取总RNA,测定纯度并定量后逆转录,取逆转录产物采用SYBR Green Real Time PCR法检测MCP-1、MIP-2 mRNA的表达。以人GAPDH做内参。PCR反应条件50℃ 2 min,95℃ 10 min,然后 95℃ 15 s,60℃ 30 s,40 个循环。根据标准曲线计算待测cDNA量。
1.5 ELISA
皮损组织匀浆后,按说明书方法依次加入样品/标准品、生物素化抗体、酶结合物工作液、显色剂,最后加入终止液后酶标仪450 nm测吸光度,根据标准曲线计算各样本MCP-1、MIP-2浓度,并以各样本蛋白浓度将结果标准化。
1.6 统计学分析
采用SPSS 11.5统计分析软件包进行数据分析计算。所有数据均以珋x±s表示。两组比较采用两独立样本的t检验。P<0.05表示差异有显著性。
2 结 果
2.1 卡氏支孢霉感染对MCP-1、MIP-2的影响
在接种卡氏支孢霉后7 d,接种活菌的B组皮损组织中MCP-1、MIP-2的mRNA含量明显高于接种灭活菌的A组 (P <0.05,见图1)。ELISA法检测局部皮损组织中MCP-1、MIP-2也得到了类似结论 (P <0.05,见图 2)。
2.2 皮肤着色真菌病小鼠皮损处MCP-1、MIP-2的动态表达
B组小鼠接种卡氏支孢霉后7 d、30 d、60 d动态检测局部皮损组织中MCP-1、MIP-2的mRNA含量及蛋白水平,结果发现7 d时表达明显高于30 d和60 d(P <0.05),而30 d与60 d相比无明显差别 (P >0.05,见图1、2)。
2.3 免疫抑制对皮肤着色真菌病发病过程中MCP-1、MIP-2表达的影响
免疫抑制小鼠(C组)接种卡氏支孢霉后早期(7 d),MCP-1、MIP-2表达水平明显低于B组小鼠(P <0.01);但在卡氏支孢霉接种后期 (30 d、60 d),两者的表达与B组小鼠无明显差异 (P>0.05,见图 1、2)。
2.4 基本病理改变
各组在7 d时以中性粒细胞浸润、坏死、脓肿形成为主,B组较C组、A组明显,各组30d、60d时以上皮样肉芽肿反应为主,B组较C组、A组轻,B组、C组可见硬壳细胞。部分病理图片见图3~5。
3 讨 论
趋化性细胞因子在着色真菌感染中作用的研究罕见。白念珠菌感染过程中相关研究较多。Jiang[4]、Filler[5]、Schaller[6]等分别检测单一核细胞、内皮细胞和口腔上皮细胞在白念珠菌刺激下趋化性细胞因子的表达,证实念珠菌可使上述细胞产生趋化性细胞因子,提示趋化性细胞因子可能参与了宿主对念珠菌的防御反应。
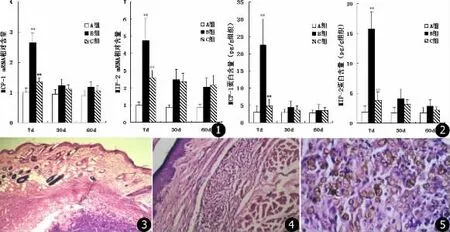
图1 Real-time PCR的方法检测皮损局部MCP-1、MIP-2 mRNA水平 图2 ELISA法检测皮损局部MCP-1、MIP-2蛋白水平 图3 B组7 d时组织病理 (HE,×40) 图4 C组30 d时组织病理 (HE,×40) 图5 B组60d时组织病理:可见硬壳小体(HE×400)Fig.1 MCP-1 and MIP-2 mRNA examined by real-time PCR Fig.2 MCP-1 and MIP-2 protein level examined by ELISA Fig.3 Histology in Group B on day 7(HE,×40)Fig.4 Histology in Group Con day 30(HE,×40)Fig.5 Histology in Group B on day 60 Sclerotic body(HE,×400)
其他真菌亦有相关报道,Schelenz等[7]发现曲霉孢子可诱使宿主产生MCP-1、MIP-2。Goldman等[8]将人类小胶质细胞暴露于新生隐球菌,发现其可表达MCP-1、MIP-2等因子。Souto等[9]证实小鼠肺巴西副球孢子菌感染后的急性炎症早期,肺部有高水平MCP-1表达。Kudeken等[10]体外实验证实MIP-2在内的多种中性粒细胞激活因子均能增强中性粒细胞对马尼非青霉出芽的抑制作用。上述研究证实隐球菌、曲霉、巴西副球孢子菌等真菌感染的防御机制中有MCP-1、MIP-2参与,但迄今为止趋化性细胞因子在着色真菌感染中的研究罕见。
本研究结果显示各组小鼠在接种卡氏支孢霉后7 d、30 d、60 d时MCP-1、MIP-2 的mRNA 均呈阳性表达,同时ELISA检测蛋白亦证实了 MCP-1、MIP-2的存在。7 d时免疫正常接种卡氏支孢霉活菌组MIP-2、MCP-1基因表达水平明显高于免疫正常接种卡氏支孢霉灭活菌液组,同时ELISA检测蛋白水平亦高于免疫正常接种灭活菌液组。提示机体对卡氏支孢霉感染的防御机制中有MIP-2、MCP-1参与。MacCallum DM在系统性白念株菌小鼠感染中亦发现 MIP-2、MCP-1 明显增加[11]。
本研究发现免疫正常接种活菌组MIP-2、MCP-1基因表达和蛋白水平7 d时明显高于本组30 d、60 d,呈下降趋势;7 d时免疫正常接种活菌组MIP-2基因表达水平明显高于免疫抑制组。与MIP-2表达水平变化相一致的是,各组皮损处病理早期表现均以中性粒细胞聚集为主,尤以免疫正常接种活菌组明显。这提示在着色真菌感染早期MIP-2起着趋化中性粒细胞至感染部位清除真菌的作用。各组小鼠病理后期呈慢性炎症表现,以单核巨噬细胞为主,故在后期即30 d、60 d时起主导作用的趋化性细胞因子不应是MIP-2。免疫正常接种活菌组MIP-2基因表达和蛋白水平30 d、60 d时较7 d时明显下降,且二者之间无明显差异,这与病理表现是相一致的。与本研究结果相符的是,Guillot等对副球孢子菌系统感染小鼠的研究结果亦支持MIP-2在真菌感染中的保护作用[12]。Huffnagle等[13]研究发现MIP基因敲除小鼠的白细胞聚集能力及脑隐球菌清除能力均较野生型小鼠下降,并提出须趋化性细胞因子聚集效应细胞参与的Th1型细胞介导炎症反应来清除中枢神经系统隐球菌为宿主防御机制的观点。
免疫正常组MCP-1表达水平7 d时明显高于30 d、60 d,呈下降趋势,7 d时免疫正常组MCP-1表达水平明显高于免疫抑制接种菌液及灭活菌液组,但在本动物模型发病早期各组小鼠病理切片中炎症细胞以中性粒细胞为主,后期则呈慢性炎症表现,以单核巨噬细胞为主,并不能体现出上述MCP-1基因表达水平的曲线和差异。因此,尚且不能明确MCP-1在着色真菌病病程中具体发挥的作用。
本研究结果表明在卡氏支孢霉所致着色真菌病模型的发病过程中有MCP-1、MIP-2这两种趋化性细胞因子的参与。感染早期病灶处大量中性粒细胞聚集可能与局部细胞高分泌具趋化作用的MIP-2所致,而MCP-1在着色真菌病病程中具体发挥的作用尚不清楚,有待于进一步研究。本研究结果提示在着色真菌感染初期可以将MIP-2作为靶目标,在抗真菌药治疗的基础上,予以促进MIP-2分泌的细胞因子或直接给予MIP-2,以促进中性粒细胞在感染局部病灶处的聚集从而增强其对病原真菌的吞噬作用,或许可以取得更好的临床治疗效果。
[1] Pina A,Bernardino S,Calich VL.Alveolar macrophages from susceptible mice are more competent than those of resistant mice to control initial Paracoccidioides brasiliensis infection[J].J Leukoc Biol,2008,83(5):1088-1099.
[2] Hayakawa M,Ghosn EE,da Gloria Teixeria de Sousa M,et al.Phagocytosis,production of nitric oxide and pro-inflammatory cytokines by macrophages in the presence of dematiaceous[correction of dematiaceus]fungi that cause chromoblastomycosis[J].Scand J Immunol,2006,64(4):382-387.
[3] Sousa MG,de Maria Pedrozo e Silva Azevedo C,Nascimento RC,et al.Fonsecaea pedrosoi infection induces differential modulation of costimulatory molecules and cytokines in monocytes from patients with severe and mild forms of chromoblastomycosis[J].J Leukoc Biol,2008,84(3):864-870.
[4] Jiang Y,Russell TR,Graves DT,et al.Monocyte chemoattractant protein 1 and interleukin-8 production in mononuclear cells stimulated by oral microorganisms[J].Infect Immun,1996,64(11):4450-4455.
[5] Filler SG,Pfunder AS,Spellberg BJ,et al.Candida albicans stimulates cytokine production and leukocyte adhesion molecule expression by endothelial cells[J].Infect Immun,1996,64(7):2609-2617.
[6] Schaller M,Mailhammer R,Grassl G,et al.Infection of human oral epithelia with Candida species induces cytokine expression correlated to the degree of virulence[J].J Invest Dermatol,2002,118(4):652-657.
[7] Schelenz S,Smith DA,Bancroft GJ.Cytokine and chemokine responses following pulmonary challenge with Aspergillus fumigatus:obligatory role of TNF-alpha and GM-CSF in neutrophil recruitment[J].Med Mycol,1999 ,37(3):183-194.
[8] Goldman D,Song X,Kitai R,et al.Cryptococcus neoformans induces macrophage inflammatory protein 1alpha(MIP-1alpha)and MIP-1beta in human microglia:role of specific antibody and soluble capsular polysaccharide[J].Infect Immun,2001,69(3):1808-1815.
[9] Souto JT,Aliberti JC,Campanelli AP,et al.Chemokine production and leukocyte recruitment to the lungs of Paracoccidioides brasiliensis-Infected mice is modulated by interferon-gamma[J].Am JPathol,2003,163(2):583-590.
[10] Kudeken N,Kawakami K,Saito A.Cytokine-induced fungicidal activity of human polymorphonuclear leukocytes against Penicillium marneffei[J].FEMS Immunol Med Microbiol,1999 ,26(2):115-124.
[11] MacCallum DM,Castillo L,Brown AJ,et al.Early-expressed chemokines predict kidney immunopathology in experimental disseminated Candida albicans infections[J].PLoSOne,2009,4(7):6420.
[12] Guillot L,Carroll SF,Homer R,et al.Enhanced innate immune responsiveness to pulmonary Cryptococcus neoformans infection is associated with resistance to progressive infection[J].Infect Immun,2008,76(10):4745-4756.
[13] Huffnagle GB,McNeil LK.Dissemination of C.neoformans to the central nervous system:role of chemokines,Th1 immunity and leukocyte recruitment[J].J Neurovirol,1999,5(1):76-81.
