补肾调经方对雄激素致无排卵大鼠模型卵巢血管舒-缩因子的影响
2010-05-26宋翠淼杨秀芳杜惠兰马惠荣段彦苍李国明
宋翠淼, 杨秀芳, 杜惠兰*, 马惠荣, 段彦苍, 曹 刚, 李国明, 陆 君
(1.河北医科大学生理教研室;2.河北医科大学中西医结合妇产科教研室,河北石家庄 050091)
无排卵是不孕症、闭经、功血、多囊卵巢综合征等多种妇科疾病共同的病理现象,严重影响妇女的身心健康。关于无排卵的发生机制方面尚有许多不明之处。已有的研究认为,白介素-6、肿瘤坏死因子-α、表皮生长因子、转化生长因子-α、myc癌基因蛋白、内皮素-1、胰岛素样生长因子、成纤维细胞生长因子、血小板源性生长因子等均可影响卵泡发育及黄体形成,从而参与调节卵巢功能[1-3]。有学者观察卵泡发育障碍、无排卵及不育患者存在卵巢血液供应障碍,且生殖器官血液供应与卵泡发育和生殖内分泌水平密切相关[4,5]。本实验运用雄激素致无排卵大鼠模型,研究补肾调经方对其血浆及卵巢血管舒张因子一氧化氮(Nitric oxide,NO)、环磷酸鸟苷(Cyclic guanosine monophosphate,cGMP)、神经型一氧化氮合酶(Neuronal nitric oxide synthase,nNOS)、内皮型一氧化氮合酶(Endothelial nitric oxide synthase,eNOS),血管收缩因子内皮素-1(Endothelin -1,ET-1)、血管紧张素Ⅱ(Angiotensin Ⅱ,ATⅡ)的影响,以探讨补肾调经方治疗无排卵性疾病的作用及机理。
1 材料与方法
1.1 材料
1.1.1 动物 同批出生9日龄健康♀性SD大鼠40只,由华中科技大学同济医学院实验动物学部提供,清洁级,合格证号:鄂医动字19-020。
1.1.2 药物制备及试剂 补肾调经方由熟地、枸杞、覆盆子、淫羊藿、紫河车、当归、白芍、香附、红花、川芎、桃仁等组成。一次性购自石家庄乐仁堂。丙酸睾丸酮注射液(批号:0203232),天津市氨基酸公司生产;ET-1、ATⅡ、NO 放免试剂盒 (批号:20040423)均购自南京建成生物工程研究所;125I标记cGMP放免试剂盒(批号:20040625)由上海中医药大学同位素室提供;E2(批号:S10950184)、P(批号:S10950183)、T(批号:S10940111)放免试剂盒购自天津九鼎医学生物工程有限公司;一抗:nNOS、eNOS(兔抗大鼠、小鼠等)工作液均购自武汉博士德生物工程有限公司;ET-1(兔抗大鼠、小鼠等)工作液购自北京中山生物技术有限公司。二抗、三抗:SP-9001、兔 SP kit,购自北京中山生物技术有限公司。
1.2 方法
1.2.1 中药制备 将当归、红花、川芎、香附提取挥发油后,加8倍量水与补肾调经方的其它药物共同浸泡40 min,煮沸后文火煎煮60 min,滤出药液;药渣加2倍水量继续煎煮40 min,合并两次滤液,水浴浓缩,与挥发油混和均匀,放置于4℃冰箱中密闭保存。每1 mL药液含生药5.3 g,相当于临床用量的20倍。
1.2.2 动物分组及无排卵大鼠模型制备 参照俞瑾[6]等方法建立雄激素致无排卵大鼠模型。9日龄同批出生SD雌性大鼠40只,随机分为正常对照组(简称“正常组”)、雄激素致无排卵大鼠模型组(简称“模型组”)和补肾调经方治疗组(简称“中药治疗组”),正常组12只,其余两组为14只。模型组及中药治疗组大鼠颈背部皮下一次性注射丙酸睾丸酮1.25mg,正常组注射同等量中性茶油。21日龄断乳,25℃恒温(50%湿度)清洁级饲养,不加饲维生素类制品。12 h光照(6:00~18:00)和12 h黑暗周期交替进行。70日龄起连续两个性周期(一个性周期4~5 d)做阴道脱落细胞涂片,阴道上皮细胞持续角化,提示雄激素致无排卵大鼠模型成功。81日龄起,模型组、中药治疗组(选择阴道上皮细胞持续角化的大鼠各10只)分别灌服蒸馏水和补肾调经方,每100 g体重给药1 mL,连续7周。正常组(选择阴道上皮细胞呈规律的周期性变化的大鼠10只)同法灌服等量蒸馏水。
1.2.3 取材及指标观察 于给药6周后每日上午做阴道脱落细胞涂片一次,连续1周,处死前2 d,每隔2 h涂片一次以确定动情周期,以0.5%的碱性美蓝溶液染色10 min,自来水轻轻洗去多余的染色液,待干,普通光学显微镜下观察,确定动情周期。130、131日龄正常组及中药治疗组处于同一动情期的大鼠及模型组(无性周期)大鼠断头取血,制备血浆、血清,置于-70℃保存,用放射免疫分析法检测血浆NO(利用硝酸还原酶特异性将NO-3还原为NO-2,通过显色深浅测定其浓度的高低,用其代表血浆NO 水平)、cGMP(125I标记)、ET-1(非平衡法)、ATⅡ(均相竞争法)以及血清E2、P和T含量。无菌操作剖腹取出同一侧卵巢组织,4%多聚甲醛溶液中固定,分别进行HE染色和免疫组织化学染色(在同一条件下按SP法进行),以观察卵巢形态学变化和卵巢组织 nNOS、eNOS、ET-1的表达强度。基本步骤为:石蜡切片脱蜡至水,3%H2O2室温孵育5 min,消除内源性过氧化物酶活性。蒸馏水冲洗,PBS浸泡5 min。10%正常山羊血清封闭,室温孵育10 min,倾去血清,滴加一抗,4℃冰箱过夜。PBS冲洗,5 min×3次。滴加生物素标记的二抗,37℃孵育10 min,PBS冲洗,5 min×3次。滴加辣根酶标记链霉卵白素,37℃孵育10 min,PBS冲洗,5 min×3次。DAB显色5 min,自来水充分冲洗,复染,脱水,透明,封片,镜检。用已知的阳性切片同时在同一条件下染色作为阳性对照,用PBS液代替一抗作为阴性对照。
1.2.4 免疫组化图像分析 正常组、模型组和中药治疗组分别随机选取3只大鼠卵巢做免疫组织化学染色切片,每个卵巢随机选取1张切片进行分析,每张切片取颗粒细胞、髓质两区,每区取6个视野,用同济医科大学千屏影像工程公司HPIAS-1000高清晰度彩色病理图文分析系统分析nNOS、eNOS、ET-1在卵巢组织切片中表达的平均灰度,以指征阳性信号的表达强度。根据病理图文分析系统设置,平均灰度值与阳性表达强弱呈反比。
1.2.5 数据处理 用SPSS11.5统计软件进行统计处理,所有数据用均数±标准差(±s)表示。对所测定结果进行正态性及方差齐性检验,组间比较用单因素方差分析。
2 结果
2.1 大鼠血清 E2、P、T含量 E2/P及血浆 NO、cGMP、ET-1、ATⅡ含量的比较
与正常组比较,模型组大鼠血清E2、T含量及E2/P显著升高(P<0.01);血浆NO、cGMP含量降低(P<0.01),血浆 ET-1、ATⅡ含量升高(P<0.01)。与模型组比较,正常组、中药治疗组大鼠血清 E2、T、E2/P 显著降低(P<0.01);血浆 NO、cGMP含量升高(P<0.01),血浆 ET-1、ATⅡ含量降低(P<0.01)。见表1。
表 1 三组大鼠血清 E2、P、T 含量 E2/P 及血浆 NO、cGMP、ET-1、ATⅡ含量的比较(n=10,±s)

表 1 三组大鼠血清 E2、P、T 含量 E2/P 及血浆 NO、cGMP、ET-1、ATⅡ含量的比较(n=10,±s)
与模型组比较,**P<0.01;与正常组比较,☆P<0.05,☆☆P <0.01。
分组 E2/(pg/mL) P/(ng/mL) E2/P T/(ng/dL) NO/(μmol/L)cGMP/(pm/mL)ET-1/(pg/mL) ATⅡ/(pg/mL)正常组 4.14±1.40** 5.42±1.61 0.76±0.32** 0.97±0.37** 55.00±8.94** 0.17±0.02** 49.94±6.61** 90.88±7.71**模型组 8.50±0.85☆☆ 5.19±1.03 1.74±0.48☆☆ 2.08±0.32☆☆ 21.00±5.73☆☆ 0.12±0.02** 61.56±4.17☆☆ 129.41±7.29☆☆中药治疗组 4.59±0.83** 5.52±2.16 0.87±0.29** 1.26±0.39**44.33±6.19**☆ 0.15±0.01** 49.33±5.55** 90.42±8.78**
2.2 大鼠卵巢组织nNOS、eNOS及ET-1表达的比较
与正常组比较,模型组大鼠卵巢颗粒细胞nNOS、eNOS以及髓质nNOS表达明显减弱(P<0.01),颗粒细胞以及髓质ET-1表达明显增强(P<0.01);与模型组比较,正常组、中药治疗组卵巢颗粒细胞nNOS、eNOS以及髓质nNOS表达明显增强(P<0.01)。颗粒细胞及髓质ET-1表达明显减弱(P<0.01)。见表2,图1~3。
表2 三组大鼠卵巢颗粒细胞nNOS、eNOS、ET-1及髓质nNOS、ET-1表达的平均灰度比较(±s)
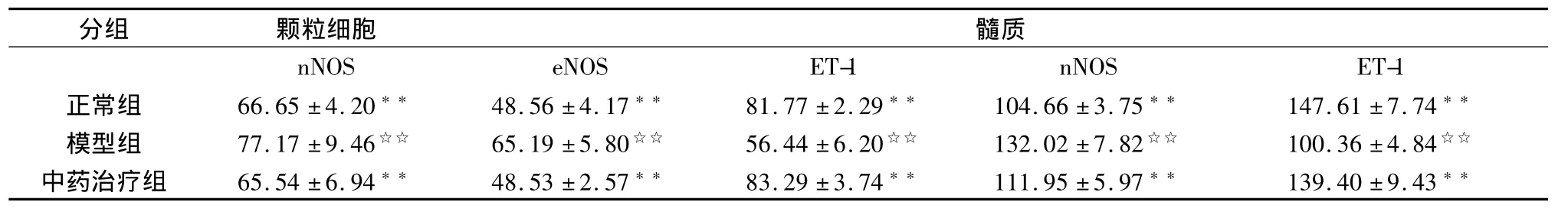
表2 三组大鼠卵巢颗粒细胞nNOS、eNOS、ET-1及髓质nNOS、ET-1表达的平均灰度比较(±s)
与模型组比较,**P<0.01;与正常组比较,☆☆P<0.01。
分组 颗粒细胞髓质nNOS eNOS ET-1 nNOS ET-1正常组 66.65±4.20** 48.56±4.17** 81.77±2.29** 104.66±3.75** 147.61±7.74**模型组 77.17±9.46☆☆ 65.19±5.80☆☆ 56.44±6.20☆☆ 132.02±7.82☆☆ 100.36±4.84☆☆中药治疗组 65.54±6.94** 48.53±2.57** 83.29±3.74** 111.95±5.97** 139.40±9.43**
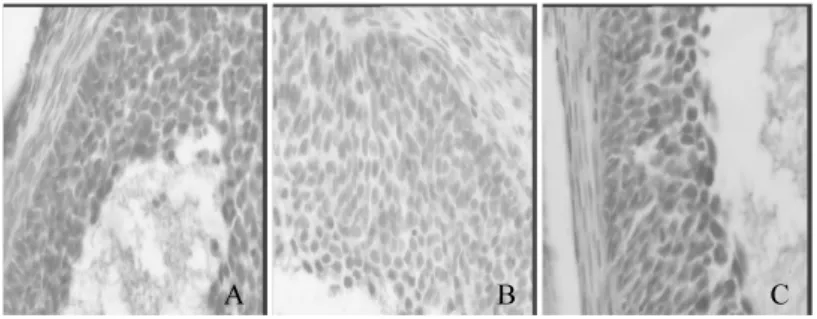
图1 nNOS在大鼠卵巢颗粒细胞的表达(×400)

图2 eNOS在大鼠卵巢颗粒细胞的表达(×400)

图3 ET-1在大鼠卵巢髓质的表达(×400)
2.3 大鼠卵巢组织形态学观察
正常组大鼠卵巢可见各级发育良好卵泡及黄体。模型组大鼠卵巢多数卵泡呈囊性扩张,颗粒细胞层次明显减少,腔内无卵丘及卵细胞,没有黄体形成。中药治疗组大鼠卵巢的结构有一定改善,卵泡发育。见图4。

图4 大鼠卵巢组织形态学变化(HE,×100)
3 讨论
无排卵多表现为卵泡在排卵前的闭锁。Flerko等[7]认为卵泡膜毛细血管血流量的减少在导致大多数卵泡于窦前期闭锁中发挥重要作用。有研究证实,与正常妇女相比,不孕症患者卵巢动脉舒张期血流呈高阻抗、无成熟卵泡且卵巢甾体激素变化无规律,提示卵泡发育障碍、无排卵及不育患者存在卵巢血液供应障碍,且生殖器官血液供应与卵泡发育和生殖内分泌水平密切相关[4-5]。其相关性表现在卵泡的血管生成调控卵泡的生长发育和闭锁,体内对促性腺激素的选择性摄取与优势卵泡的血液供应增加一致[8]。
Klipper等[9]发现大鼠卵巢静脉血中 ET-1 含量显著高于动脉血,提示卵巢自身能分泌ET,而ET是迄今所知具有最强缩血管作用的活性多肽。已有研究证实NO可引起血管舒张,从而调节卵巢功能,其作用机制是通过NO-cGMP(环磷酸鸟苷)通路实现的[10]。NOS是NO合成的起始酶和限速酶。NOS可分为原生型NOS(cNOS)和诱生型NOS(iNOS)两大类,原生型NOS又分为内皮型NOS(eNOS)和神经型NOS(nNOS)。生理状态下,血管内皮可通过cNOS不断释放低水平的NO。NO与鸟苷酸环化酶中亚铁血红蛋白部分结合,激活该酶而使cGMP增高,引起血管平滑肌舒张。
本实验结果表明:与模型组比较,中药治疗组大鼠血浆ET-1、ATⅡ含量明显降低,卵巢颗粒细胞、髓质 ET-1表达亦明显降低。ET-1、ATⅡ具有明显的缩血管作用。与模型组比较,中药治疗组大鼠血浆NO、cGMP含量明显升高,卵巢颗粒细胞 nNOS、eNOS、髓质nNOS表达明显增强,可能导致舒张血管的生理性效应产物 -NO、cGMP生成增多。NO、cGMP具有明显的舒血管作用。中药治疗组大鼠血浆、卵巢血管舒-缩因子的变化,可能改善了卵巢的血液供应,阻碍了大多数卵泡于窦前期闭锁,并促进优势卵泡对促性腺激素的选择性摄取,有利于卵泡的正常发育,卵子排放及黄体形成。
无排卵多表现为卵泡在排卵前的闭锁,而卵泡闭锁与卵泡细胞和颗粒细胞的凋亡有关[11]。有报道NO对于体外培养卵泡的正常发育是必须的,卵泡发育受阻和排卵抑制都与抑制NO合成相关。小卵泡的颗粒细胞中高水平的NO会抑制细胞的凋亡,而大卵泡的颗粒细胞中低水平的NO有相反的效应[12]。
本实验结果表明:与模型组比较,中药治疗组大鼠血浆NO含量明显升高,卵巢颗粒细胞 nNOS、eNOS表达明显增强,可能导致卵巢颗粒细胞NO水平升高,抑制颗粒细胞的凋亡,阻碍卵泡在排卵前闭锁,促使卵泡发育。
另外,本实验结果显示:无排卵大鼠模型表现为血清E2、T水平升高以及E2/P值的异常升高。补肾调经方可能通过降低无排卵大鼠模型血清E2水平,解除异常增高的E2对下丘脑分泌促性腺激素释放激素及垂体分泌促性腺激素的抑制作用,使各级卵泡进一步发育,成熟卵泡不断形成,排卵功能进一步恢复。也可能通过降低无排卵大鼠模型异常增高血清T水平,间接促进卵泡发育。因为生理剂量的雄激素是女性维持正常生殖所不可缺少的,高雄激素可引起黄体生成素/卵泡刺激素比例失调,对卵泡发育不利,即使部分排卵,常发生黄体功能不全[13]。
形态学显示:正常大鼠卵巢各级卵泡发育良好以及黄体形成,而无排卵大鼠模型卵巢皮质内卵泡多数呈囊性扩张,颗粒细胞层明显减少,没有黄体的形成。补肾调经方能使无排卵大鼠模型卵巢颗粒层明显增厚,可见发育期的卵泡,并见黄体形成,一定程度地改善无排卵大鼠模型卵巢的结构。
补肾调经方由养精种玉汤合五子衍宗丸加减化裁而成。方中熟地滋补肝肾,填精养血而为君药。枸杞子、山萸肉、紫河车助君药滋肾益精,补养冲任;覆盆子、淫羊藿、山药温肾益气,“阳中求阴”;当归、白芍养血调经,共为臣药。佐香附、红花理气活血,调畅冲任,进而改善卵巢局部血液供应。诸药合用,滋肾阴、温肾阳、填精血、调冲任,以达补肾调经之功,从而发挥调节卵巢功能的作用。
综上认为,补肾调经方使无排卵大鼠模型血浆、卵巢组织中血管舒张因子的含量以及表达增加,血管收缩因子的含量以及表达减少,一方面可能改善了卵巢的血液供应,另一方面可能阻碍了颗粒细胞的凋亡。以上两方面均可抑制卵泡在排卵前闭锁,促进卵泡的发育,排卵。另外,补肾调经方通过降低无排卵大鼠模型血清高水平E2、T,对卵泡的发育可能发挥了一定的作用。
[1]Wu R,Fujii S,Ryan N K,et al.Ovarian leukocyte distribution and cytokine/chemokine mRNA expression in follicular fluid cells in women with polycystic ovary syndrome [J].Hum Reprod,2007,22(2):527-535.
[2]张利军,王根林.IGFs和EGF对卵泡发育的调控[J].生殖与避孕,2004,24(2):108-110.
[3]Toshiro K.Role of vasoactive substances on endometrial and ovarian function[J].Reprod Med Bio,2007,6(3):157-164.
[4]周 莉,亓 蓉,梁 莹,等.经阴道彩色多普勒观察卵巢血流灌注与卵泡发育的关系[J].生殖与避孕,2008,28(7):441-443.
[5]苏继莲,罗 洁,应伟雯.不孕妇女卵巢血供彩色多普勒特点与卵巢功能的相关性研究[J].实用妇产科杂志,2008,24(4):223-225.
[6]俞 瑾,杨淑萍,张月萍,等.雄激素致高胰岛素高雄激素性无排卵大鼠模型[J].生殖医学杂志,1993,2(4):251-259.
[7]Flerko B,Setalo G,Tima L.Reproduction and development:Advances in physiological sciences Vol.15 pergamon press and Akademia Kiado press[C].Budapest,1980:79-89.
[8]王桂敏,郑淑蓉.女性生殖器官血管研究现状[J].生殖与避孕,1996,16(1):3-6.
[9]Klipper E,Gilboa T,Levy N,et al.Characterization of endothelin-1 and nitric oxide generating systems in corpus luteum-derived endothelial cells[J].Reproduction,2004 ,128(4):463-473.
[10]Nelson S H,Steinsland O S,Wang Y,et al.Increased nitric oxide synthase activity and expression in the human uterine artery during pregnancy[J].Circ Res,2000,87(5):406-411.
[11]徐富翠,郭 勇,梅欣明.卵泡发育与其细胞凋亡[J].四川解剖学杂志,2002,10(2):99-104.
[12]吴向丰,桑润滋,张增力,等.一氧化氮对下丘脑-垂体-卵巢轴的生理调控[J].动物医学进展,2005,26(7):4-7.
[13]魏兆莲,李美芝,陈咏健.高雄激素血症对子宫内膜功能的影响[J].中国妇产科临床,2002,3(3):145-147.
