活性氧在δ-榄香烯诱导人结肠腺癌DLD-1细胞凋亡中的作用研究
2010-05-22王茜莎杨威陶淑娟董金华潘雪刁张德志
王茜莎 杨威 陶淑娟 董金华 潘雪刁 张德志
榄香烯(elemene)是从姜科植物温莪术(CurcumawenyujinY. H. Chen et C. Ling)的挥发油中经减压蒸馏获得的以β-榄香烯为主,同时含少量δ-榄香烯及γ-榄香烯等成分的萜烯类化合物,属国家二类非细胞毒性抗肿瘤药物[1]。目前临床使用的榄香烯乳剂是以β-榄香烯为主要成分。δ-榄香烯是β-榄香烯的同分异构体,实验研究表明δ-榄香烯能诱导人宫颈癌Hela细胞发生凋亡[2],但对人结肠腺癌DLD-1细胞的抗肿瘤作用至今未见报道。本实验在董金华等[3]大量提取δ-榄香烯工艺的基础上,初步进行了δ-榄香烯对DLD-1细胞的抗肿瘤作用研究。
1 材料
1.1 药品与试剂
δ-榄香烯和β-榄香烯均由沈阳药科大学制药工程学院提供,其含量分别为95%、96.7%;用DMSO溶成8 mmol/L临用前储备液,用时培养基稀释为适当浓度用于体外实验。
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、左旋谷胱甘肽(L-Glutathione,GSH)购于Sigma公司; 氯甲基二氯荧光素二乙酸酯(6-Chloromethyl-2′,7′-dichlorofluorescin diacetate, CM-H2DCF-DA)和超氧化物阴离子荧光探针(dihydroethidium,DHE)和四氯四乙基苯并咪唑基羰花青碘化物(5,5′,6,6′-tetrachloro-1,1′,3,3′-tetrethyl benzimidalyl carbocyanine iodide,JC-1)购于美国Molecular Probes公司。
1.2 细胞及培养
人结肠腺癌DLD-1细胞、人正常肝胚胎WRL-68细胞购于American Type Culture Collection 机构。接种在含10%胎牛血清、2 mmol/L谷氨酰胺、100 U/ml 青霉素和100 μg/ml链霉素的RPMI-1640培养液中,在37℃,5%的 CO2环境下培养。
1.3 动物
5~6周龄SPF级昆明种小鼠,雄性,18~22 g,由广东省实验动物实验中心提供[许可证号:SCXK(粤)2003-0002,粤监证字2007A006]。
2 方法
2.1 细胞体外生长活性检测
采用MTT法进行。取对数生长期的DLD-1细胞,以1×105个/ml接种于96孔板(100 μl/孔,5%CO2,37 ℃ 培养过夜后,加入不同浓度的δ-榄香烯(50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L)100 μl/孔;同时设空白对照组(0 μmol/L δ-榄香烯),复设3孔。药物作用0小时、12小时、24小时、48 小时后,弃培养基,向每孔分别加入20 μl的5 mg/ml的MTT存储液,并于37℃孵育4小时。之后向每孔加入150 μl的DMSO,酶标仪570 nm波长处测定吸光值A。按以下公式计算抑制率(IR):IR=(1-实验组平均吸光度A值/对照组平均吸光度A值)× 100%,并用SPSS 11.0软件计算δ-榄香烯的半数抑制浓度(IC50)。
2.2 正常小鼠骨髓细胞及人正常胚胎肝细胞WRL-68生长抑制作用
2.2.1 骨髓细胞的制备
取5~6周龄小鼠3~5只,雄性,断颈处死,无菌操作取小鼠股骨骨髓细胞,用不完全培养基(不含血清)的RPMI-1640培养液6 号针头注射器冲出骨髓细胞,静置数分钟,取上层悬液,1200 r/min离心5分钟,弃上清液;用加双抗的不完全RPMI-1640培养液洗2次。采用台盼蓝染色进行活细胞计数后,用RPMI-1640培养体系调细胞浓度为5×106个/ml(或1×106个/ml)。
2.2.2 δ-榄香烯对骨髓细胞和WRL-68细胞增殖活性的抑制作用
取对数生长期的WRL-68细胞,以1×104个/ml接种于96孔板(100 μl/孔);正常小鼠骨髓细胞以4×105个/ml接种于加到96孔板中(100 μl/孔)。次日加入不同浓度的δ-榄香烯(0~400 μmol/L)100 μl/孔,复设3孔。药物作用24小时后弃培养基,按“2.1”项下方法检测并计算IR。
2.3 线粒体膜电位的检测
线粒体膜电位通常采用JC-1标记法进行测定。线粒体是否完整是通过检测线粒体膜电位的变化来确定的。细胞接种同上。培养12 小时后,加入200 μM δ-榄香烯,药物作用0小时、6小时、12小时、24 小时后,用300 nM的JC-1,37°C避光孵育15分钟。然后用0.25%的胰酶消化收集1×106的细胞,并用冰冷的PBS洗一次,然后将收集的细胞用PBS均匀悬浮,立即用FACSCalibur流式细胞仪检测。计数2×105个的细胞即可。
2.4 检测ROS的生成
过氧化氢物和超氧化物通常采用CM-H2DCFDA(美国Molecular Probe 公司),参照文献[4]稍作改进。取对数生长期的DLD-1细胞,接种于100 mm 培养皿中。200 μM 的δ-榄香烯作用DLD-1细胞6小时、12小时和24小时后离心收集细胞,并用200 μl 的RPMI 1640 培养液制成单细胞悬液。然后加入10 μM CM-H2DCFDA于37℃孵育45分钟,最后用PBS缓冲液清洗以除去CM-H2DCFDA。用流式细胞仪通过相对于正常细胞的荧光密度来检测ROS的含量。GSH于δ-榄香烯作用前1小时进行预处理,考察3小时对凋亡细胞的影响。
2.5 统计学方法
3 结果
3.1 δ-榄香烯对DLD-1细胞的增殖抑制
实验考察了δ-榄香烯对DLD-1细胞作用的时效关系,结果表明δ-榄香烯诱导的细胞死亡呈现明显的时间和剂量依赖性(图1)。δ-榄香烯分别作用DLD-1细胞12小时、24小时及48小时,其IC50分别为308.4 μmol/L、222.4 μmol/L和159.8 μmol/L(图1)。
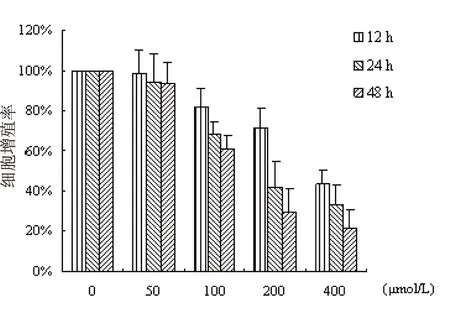
图1 δ-榄香烯对DLD-1细胞作用不同时间的增殖抑制作用
3.2 δ-榄香烯对正常小鼠骨髓细胞及人正常胚胎肝WRL-68细胞生长抑制作用

图2 δ-榄香烯对正常小鼠骨髓细胞及人正常胚胎肝WRL-68细胞生长抑制作用
由图2可知,24小时时200 μmol/L 的δ-榄香烯对人正常肝胚胎WRL-68细胞和骨髓细胞的抑制率仅在10%左右,400 μmol/L 其抑制率不到20%,提示200 μmol/L δ-榄香烯对WRL-68细胞和骨髓细胞增殖的抑制作用明显较肿瘤细胞弱。
3.3 JC-1 检测δ-榄香烯对DLD-1细胞线粒体膜电位(Δφm)的影响
经200 μmol/L的δ-榄香烯作用后,DLD-1细胞的Δφm出现下降,如图3所示。空白对照组中,绝大部分细胞(R1区)发出标志线粒体完整的高密度红色荧光;δ-榄香烯作用组中,R1区的细胞显著性减少,R2区的细胞是(明亮的绿色荧光同时伴有低密度的红色荧光)细胞——标志着线粒体膜电位降低——随着药物作用的时间增加而增加,即线粒体膜电位的降低呈时间依赖性。与空白对照组相比,200 μmol/L 的δ-榄香烯作用DLD-1细胞6 小时呈现绿色JC-1荧光(标志着线粒体膜电位降低),这与线粒体膜去极化降低相一致。
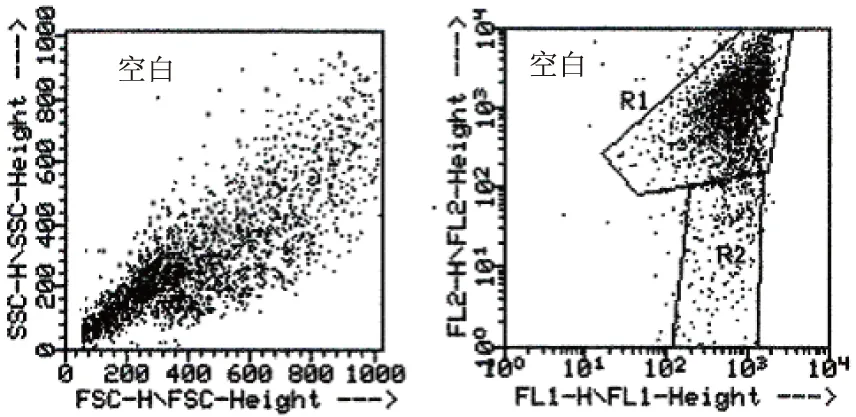
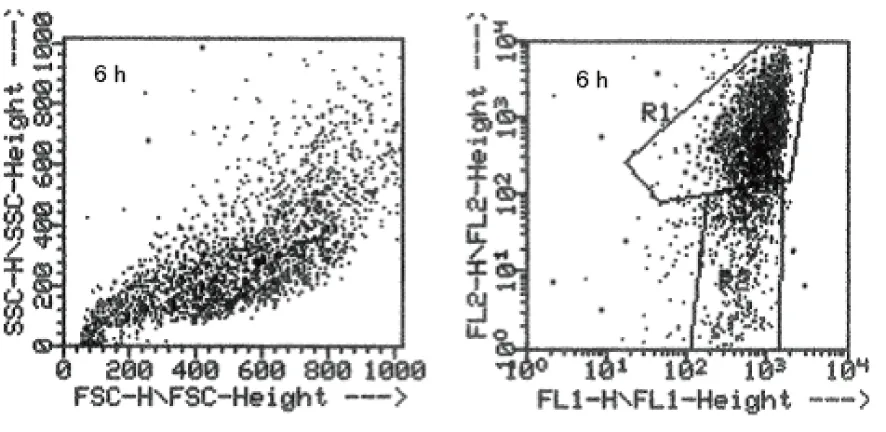


图3 δ-榄香烯对DLD-1细胞膜电位的影响
如图4结果所示,Dφm的降低随着药物作用的时间增加而增加,即线粒体膜电位的降低呈时间依赖性,6小时,12小时,24 小时线粒体膜电位降低的发生趋势分别是空白组的(2.24±0.12)倍、(2.85±0.33)倍、(5.11±0.24)倍(与空白组相比,*P<0.05,**P<0.01)。

图4 δ-榄香烯不同时间对DLD-1细胞膜电位变化
3.4 δ-榄香烯诱导细胞凋亡与ROS的生成增加有关
用流式细胞仪检测δ-榄香烯所引起DLD-1细胞内ROS的生成(图5)。200 μM 的δ-榄香烯处理DLD-1细胞所引起的ROS的生成呈现时间依赖性的增加。如图5所示,200 μmol/L 的δ-榄香烯作用1小时、3小时和6小时所引起的ROS含量的增加,分别接近空白对照组的7.8倍、18.2倍和21.8倍,此增加具有统计学显著性意义(*P<0.01,**P<0.001)。此外,δ-榄香烯的这种作用可以被GSH(ROS的清除剂)显著性抑制,即加入GSH后δ-榄香烯对ROS生成率(3.46%)与空白对照(2.11%)相比无显著性差异。实验结果提示δ-榄香烯诱导的DLD-1细胞凋亡过程可能与ROS的生成增加相关。
4 讨论
近年来,非细胞毒性抗肿瘤药物的研发已成为国际药品市场发展的重要趋势。榄香烯体外对多种肿瘤细胞的抗肿瘤作用已有报道[5-6]。榄香烯对人正常末梢血白细胞的IC50值为1.244 mmol/L。本研究表明δ-榄香烯对DLD-1细胞的生长抑制作用呈时间和剂量依赖性,对DLD-1细胞的IC50值为222.4 mmol/L,此结果与榄香烯对DLD-1细胞的IC50值极为接近(182.4 mmol/L)[7]。研究中同时采用MTT法比较了δ-榄香烯对人正常肝胚胎细胞WRL-68和小鼠骨髓细胞的作用,研究表明δ-榄香烯对DLD-1细胞生长抑制作用远远强于对正常肝细胞和小鼠骨髓细胞的作用。δ-榄香烯对正常细胞的抑制作用很弱,即提示δ-榄香烯可能是一种无细胞毒性的活性单体。
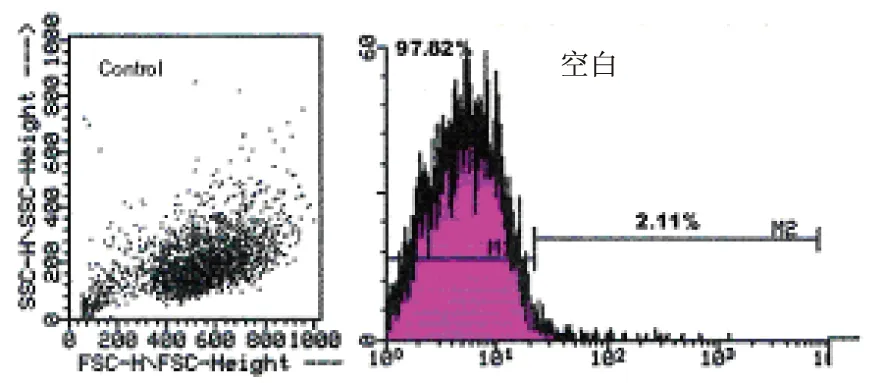

图5 δ-榄香烯致DLD-1细胞内ROS生成(横坐标表示相对荧光密度,纵坐标表示细胞数量)
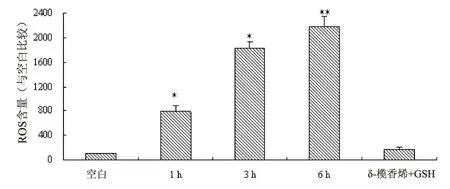
图6 δ-榄香烯不同时间致DLD-1细胞内ROS量变化
目前认为,细胞内过量的ROS蓄积可以引起线粒体膜电位下降,直接诱导细胞凋亡[8]。本研究表明,DLD-1细胞经δ-榄香烯处理6 小时后,线粒体膜电位开始下降,是继大量ROS 产生的后发事件。提示δ-榄香烯所致的线粒体膜电位下降是由于ROS蓄积而引起的。GSH 被认为是平衡细胞内氧化还原状态的重要调节因子[9-10]。许多不同的抗氧化剂诸如NAC[11-12]、ascorbate[13]及α-tocopherol[13]的加入则抑制凋亡的发生,这表明ROS的生成在多种细胞凋亡中担任了极其重要的作用。进一步研究证实,很多抗肿瘤药物在启动肿瘤细胞凋亡过程前,细胞内GSH 被耗竭,同时伴有活性氧的蓄积[14]。将DLD-1细胞在δ-榄香烯作用3小时前用GSH预处理,考察GSH对δ-榄香烯诱导DLD-1细胞凋亡的影响。结果表明,δ-榄香烯所引起的凋亡作用可以被GSH完全抑制,其水平与空白组水平一致,即提示ROS在δ-榄香烯诱导DLD-1细胞凋亡过程中发挥了关键作用。
总之,此次实验研究表明δ-榄香烯是一种非常有效的抗肿瘤活性单体,它能够有效的诱导人结肠腺癌DLD-1细胞的凋亡发生,其凋亡机制还需要进一步深入研究。
[1]李大景,邵金良,张忠录. 榄香烯的药理研究及临床应用[J]. 时珍国医国药,2001,12 (12):1123-1124.
[2]Wang Xi-sha, Yang Wei, Tao Shu-juan, et al. The effect of δ-elemene on Hela Cell lines by apoptosis induction[J]. YAKUGAKU ZASSHI, 2006, 126(10): 979-990.
[3]董金华,程宝国,胡皆汉. 温莪术挥发油中γ-榄香烯的分离鉴定及抗肿瘤活性[J]. 中草药,1997,28(1):13.
[4]Curtin JF, Donovan M, Cotter TG. Regulation and measurement of oxidative stress in apoptosis[J]. J Immunol Methods , 2002, 265: 49-72.
[5]胡军,金伟,杨佩满, β-榄香烯逆转人乳腺癌MCF27/ ADM细胞对阿霉素耐药性的研究[J]. 中华肿瘤杂志,2004,26 (5):268-270.
[6]周洪语,沈建康,侯菊生,等. 榄香烯诱导神经胶质瘤细胞凋亡的实验研究[J]. 癌症,2003,22(9): 959-963.
[7]Wang X W. Elemene: antineoplastic[J]. rugs of The Future, 1998,23(3): 266-270.
[8]Ricci J E, Gottlieb R A, Green D R. Caspase2 mediated loss of mitochondrial function and generation of reactive oxygen species during apoptosis [J] . J Cell Biol, 2003, 160 :65-75.
[9]Slater A F, Steean C, Nobel I, et al. Signalling mechanisms and oxidative stress in apoptosis[J] . Toxi2 col Lett, 1995, 82-83: 149-153.
[10]Powis G, Briehl M, Oblong J. Redox signalling and the control of cell growth and death[J]. Pharmacol Ther, 1995, 68: 149-173.
[11]Lafon C, Mathieu C, Guerrin M A. Transforming growth factor beta 1-induced apoptosis in human ovarian carcinoma cells: protection by the antioxidant N-acetylcysteine and bcl-2[J]. Cell Growth Differ, 1996, 7(8): 1095-1104.
[12]Wu Y J, Muldoon L L, Neuwelt E A. The chemoprotective agent N-acetylcysteine blocks cisplatin induced apoptosis through caspase signaling pathway[J]. J Pharmacol Exp Ther, 2005, 312(2): 424-431.
[13]Barroso MP, Gomez-Diaz C, Lopez-Lluch G. Ascorbate and -tocopherol prevent apoptosis induced by serum removal independent of Bcl-2[J]. Arch Biochem Biophys, 1997, 343: 243-248.
[14]Macho A, Hirsch T, Marzo I, et al. Glutathione depletion is an early and calcium elevation is a late event of thymocyte apoptosis[J]. J Immunol, 1997, 158: 4612-4619.
