陇东野生紫花苜蓿的同工酶分析
2010-05-13陈立强师尚礼满元荣
陈立强,师尚礼,满元荣
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中美草地畜牧业可持续发展研究中心,甘肃兰州 730070)
紫花苜蓿(Medicago sativa)别名紫苜蓿、苜蓿,起源于小亚细亚、伊朗、外高加索和土库曼一带[1]。紫花苜蓿抗逆性强、分布广、栽培面积大、产量高、品质好、利用方式多、适口性好、经济价值高,具有其他豆科牧草所不能比拟的优点[2]。陇东野生紫花苜蓿分布于甘肃清水半阴湿地区,与栽培紫花苜蓿相比,具有根茎,抗旱、抗寒、抗践踏且分枝能力强的优点,因此,具有潜在的饲用栽培和良好种质资源价值[3,4]。
同工酶是基因表达的产物,反应了植物生长发育过程中基因的启动与表达,系统进化中基因的突变与重组,可通过酶谱分析直接判断基因的存在及表达,从而在蛋白质水平上揭示物种的遗传基础[5,6]。利用同工酶分析技术,从分子水平、遗传背景方面来寻找植物种类间的亲缘关系,能弥补形态分类的不足[5,8]。20世纪70年代以来,同工酶技术在草业科学领域中应用于物种、变种和品种的区分鉴定取得了不少成绩[9]。近年来,同工酶分析法已广泛应用于苜蓿材料亲缘关系、抗逆性、品种鉴定和分类上[10]。
通过对陇东野生紫花苜蓿与其他37个国内外紫花苜蓿材料的过氧化物酶、过氧化氢酶和酯酶分析,探讨了陇东野生紫花苜蓿与其他紫花苜蓿材料间的亲缘关系,以期为陇东野生紫花苜蓿种质鉴定、分类、育种以及资源的有效利用提供理论依据。
1 材料和方法
1.1 供试材料
试验材料为陇东野生紫花苜蓿和其他37个紫花苜蓿品种(表1)。
1.2 方法
1.2.1 酶液提取 过氧化物酶(POD,EC1.11.1.7)用种子提取,每份材料随机选取0.5 g种子;过氧化氢酶(CAT ,EC1.11.1.6)和酯酶(EST ,EC 3.2.1.1)用幼苗的根提取,种子在培养箱内发芽培养,光照9 h,黑暗15 h,温度27 ℃,至真叶期,每份材料随机剪取根0.5 g,然后将种子或根置于预冷的研钵中,研磨过程中陆续加入2 mL预冷的0.1 mol/L T ric-HCl缓冲液(pH 8.0)。研磨后迅速倒入 2 mL离心管中,以5 000r/min离心5 min,取上清液灌入离心管中,加入等体积40%的蔗糖溶液混匀,-80℃保存以备点样[11],所有试验过程都在相同条件下进行。

表1 参试紫花苜蓿品种及其来源Table 1 Varieties and origin of alfalfa for test
1.2.2 电泳及染色 采用聚丙烯酰胺凝胶垂直板电泳法,分离胶为7%的1 mol/L T ris-HCl(pH 8.8),浓缩胶为4%的 1 mol/L Tris-HCl(pH 6.8);电极缓冲液为Tris-甘氨酸缓冲液,pH 8.0;前沿指示剂为2%的溴酚兰溶液;进样量10 μ L;先于 100 V 电压下电泳至样品进入分离胶,再用200 V电压继续电泳,待溴酚兰移至分离胶底部(约4 h),停止电泳,剥胶染色,同工酶染色参照文献[12]的方法进行。
1.2.3 数据处理 根据各酶带的迁移距离计算其相对迁移率(R f),Rf=X2/X1,X1为指示剂的迁移距离,X2为凝胶中酶带的迁移距离[13]。根据所统计酶谱带的有无,把有带计为1,无带计为0[14],组成0,1二元矩阵,用NTSYSpc 2.1软件的SAHN程序和UPGMA方法计算材料间的相似系数并进行聚类分析和主成分分析。
2 结果与分析
2.1 同工酶酶带分布特征
同工酶往往由该酶的单个基因位点的多个等位基因或多个位点的等位基因控制,同工酶酶谱能表现出若干条酶带。结果表明,38个供试紫花苜蓿材料的过氧化物酶显示出了10条酶带,其R f值介于0.20~0.75(表 2),其中 Rf 为0.20,0.25,0.30 ,0.49和 0.53的5条带为供试材料的共有带,Rf为 0.39,0.65,0.70,0.73和0.75的5条带为多态性带,R f为0.39的酶带仅出现在陇东野生、陇东、飞马和赛特4个紫花苜蓿材料的酶谱中。供试材料的过氧化氢酶共表现出了7条酶带,且都为多态性带,其R f值介于0.09~0.67(表2),R f为0.09,0.19和0.30的3条带仅在陇东野生紫花苜蓿酶谱中缺失,而R f为0.15,0.20和0.46的3条带仅出现在陇东野生紫花苜蓿酶谱中。酯酶酶谱表也现出7条酶带,其R f值介于0.08~0.99之(表2),除R f为0.11和0.15的两条带外其他酶带均为多态性带,其中R f为0.08和0.65的两条带仅出现在陇东野生紫花苜蓿酶谱中。
结果表明38个紫花苜蓿材料的3种酶电泳共显示了24条酶带,其中有5条是陇东野生紫花苜蓿的特征酶带,有7条(PER为5条,EST为2条)是各材料共有的特征酶带。共有酶带可认为是供试材料具有相同起源基因的表现,而17条多态性酶带(PER为5条,CAT为7条,EST为5条)表明材料在特定的生长环境或不同的进化过程中发生了趋异分化[15]。陇东野生紫花苜蓿与其他紫花苜蓿材料所共有的7条酶带表明在长期的进化中除了形成自己特征的同时还具有苜蓿属植物很强的遗传稳定性。38个紫花苜蓿材料酶谱均存在不同程度的差异,这些酶谱表型可作为区分它们的依据。
2.2 供试材料间的相似系数及聚类分析
应用NTSYSpc2.1软件计算出供试材料间相似系数矩阵,38份紫花苜蓿品种间的遗传相似系数介于0.583~1.000,其中陇东野生紫花苜蓿与其他37个供试材料间的相似系数介于0.583~0.833,与赛特间的相似系数最大,与Pick 3006间的相似系数最小,其平均值(0.702)远远低于品种间的平均相似系数(0.776~0.870),表明他们之间的遗传距离相对较大。基于遗传相似系数,对38个紫花苜蓿品种用非加权成组配对法(UPGMA,Unweighted Pair-Group Method Usingan Arithmetic Average)进行聚类分析,其分析结果如图1,图中数字标号与表1同。从图1可以看出,在相似系数0.702处将38份紫花苜蓿品种分为2类,其中陇东野生紫花苜蓿单独聚为一类,由此推断,陇东野生紫花苜蓿与其他供试材料间的亲缘关系较远,为一相对独立的紫花苜蓿种质资源,这与张雪婷等[4]用POD研究的结果一致。紫花苜蓿品种聚为另一类,且在相似系数为0.810处分为两个亚类,第Ⅰ亚类包括河西,维多利亚,游客,巴洛法,金皇后,陇东苜蓿,赛特,飞马,皇冠,猎人河,雷达克之星,格林,领先者,苏联1号,秘鲁,公农 2号,牧歌401+Z,阿尔冈金。第Ⅱ亚类包括新疆大叶,三得利,Pick 8925,哥萨克,肇东,皇后 2000,美国苜蓿王,美国放牧型,捷克,牧歌,中兰1号,巨人,德福,秘鲁,公农1号,德宝,大西洋,Pick 3006,中农32号。
2.3 主成分分析
通过NTSYSpc 2.1软件,对5个同工酶38份紫花苜蓿材料的同工酶标记原始矩阵进行主成分分析,得第1和第2主成分位置分布图(图2),图中数字标号与表1同,位置相互靠近者表示关系密切,远离者表示关系疏远[16]。供试材料主要分布于3个区域,且陇东野生紫花苜蓿与其他材料间距离较大,供试紫花苜蓿品种集中于两个区域。结果表明主成分分析结果与聚类分析结果基本一致。

表2 38个紫花苜蓿品种的3种同工酶酶带数及迁移率Table 2 The number of isoenzymic bands and its mobility of three isozymes in 38 Medicagosativa varieties %

图1 38个紫花苜蓿品种基于SSR的UPGMA聚类图Fig.1 UPGMA dendrogram of 38 Medicagosativa varieties based on three isozymes
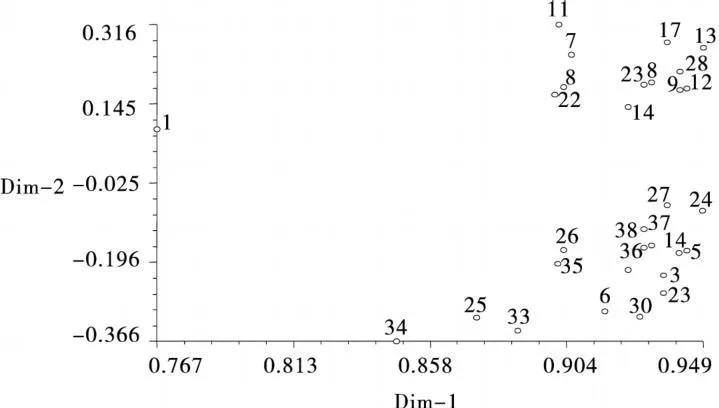
图2 38个紫花苜蓿品种基于SSR的主成分分析Fig.2 Principal component analysis of 38 Medicagosativa varietiesbased on three isozymes
3 小结
38个紫花苜蓿品种共表现出了24条酶带,且所有材料共有7条,在24条酶带中,5条酶带为陇东野生紫花苜蓿所特有。试验表明同工酶对紫花苜蓿材料具有较强的鉴别能力,是分析紫花苜蓿的有效方法。
单独分析某一条带的有无或酶带颜色深浅来比较和鉴定紫花苜蓿材料间的差异有很大的局限性,但若用全部酶带进行定量分析则可全面准确地反映出品种间的酶谱特征和差异,再针对相似系数进行聚类分析,能更加清楚地了解各供试材料间的亲缘关系[9]。38个紫花苜蓿品种间的遗传相似系数在0.583~1.000,陇东野生紫花苜蓿与其他37个品种间的相似系数远远低于品种间的相似系数,进行聚类分析,以遗传相似系数0.780为标准,供试材料可聚为2大类,较直观地显示了亲缘关系,陇东野生紫花苜蓿单独聚为一类,37个品种聚为另一类,主成分分析结果与聚类分析结果基本一致。表明陇东野生紫花苜蓿与品种间遗传距离较大,由此可确定陇东野生紫花苜蓿与其他品种间的亲缘关系较远,为一相对独立的紫花苜蓿种质资源,可用于扩大品种的遗传基础。
试验表明,用同一植株不同发育期和不同器官所提取的同工酶数目和活性都存在很大的差异,因此,在同工酶提取时,所取材料必须要满足发育期和材料部位两个条件[17]。经试验对比,用种子提取的过氧化物酶和用幼苗根提取的过氧化氢酶和酯酶活性较强,反映在凝胶上则酶谱清晰。所以试验选择用种子提取过氧化物酶,用幼苗根提取过氧化氢酶和酯酶。
[1] Falahati-Anbaran M,Habashi A A,Esfahany M,et al.Population genetic structure based on SSR markers in alfalfa(Medicagosativa L.)from various regions contiguous to the centres of origin of the species[J].Journal of genetics,2007 ,86:59-63.
[2] 尹权为,张璐璐,李发玉.过氧化物同工酶在紫花苜蓿遗传多样性分析上的应用[J].草业与畜牧,2008,9:9-11.
[3] 耿小丽,魏瑧武,程鹏舞,等.苜蓿花药培养及倍性鉴定.草原与草坪,2008(6):1-5.
[4] 张雪婷,师尚礼.陇东野生紫花苜蓿的遗传特异性分析[J].草地学报,2009,17(3):333-348.
[5] 王玲英.几种草坪植物过氧化物酶同功酶的测定[J].青海草业,1996,5(1):22-26.
[6] Mahboob A,Chowdhury,Alfred E,etal.Genetic diversity in grasspea(Lathyrussativus L.)[J].Genetic Resources and Crop Evolution ,2000 ,47:163-169.
[7] 龚大洁,周开亚.同工酶及其在爬行动物系统学中的应用[J].西北农业大学(自然科学版),1999,35(1):111-116.
[8] 李晓林.苹果属植物酯酶同工酶分析[J].西南农业大学学报,1997,19(2):105-111.
[9] 陈传军,沈益新,周建国.南农选系草地早熟禾POD同工酶的酶谱特征及与其它品种的差异[J].中国草地,2005,27(2):36-42.
[10] 沙伟,孟凡玲,冯昌军.10个苜蓿品种过氧化物同工酶(POD)分析[J].北方园艺,2007(1):150-152.
[11] Akashi Y,Fukuda N,Wako T.Genetic variation and phylogenetic relationships in East and South Asian melons,Cucumis melo L.based on the analysis of five isozymes[J].Euphytica,2002,125:385-396.
[12] 张维强,唐秀芝.同工酶与植物遗传育种[M].北京:北京农业大学出版社,1993:167-195.
[13] 杨尧军,李毅,张生华,等.箭胡毛杨及其亲本酯酶和过氧化物酶的同工酶分析[J].甘肃农业大学学报,2006,41:46-50.
[14] Fuentes J L,Escobar F ,Alvarez A.Analyses of genetic diversity in Cuban rice varieties using isozyme,RAPD and AFLP markers[J].Euphytica,1999,109:107-115.
[15] 刘波,王荔,陈疏影,等.36份不同居群半夏同工酶研究[J].云南农业大学学报,2008,23(1):1-18.
[16] 唐燕琼,胡新文,郭建春,等.柱花草种质遗传多样性的ISSR 分析[J].草业学报,2009,18(1):57-64.
[17] 程昕昕,耿广汉,刘正.玉米杂种一代的酯酶酶谱分析[J].种子 ,2007 ,26(4):30-31.
