RAAS系统在糖尿病肾病发病机制及治疗中的作用
2010-05-07皮耶罗
皮耶罗
引言
血管紧张素Ⅱ是肾素—血管紧张素—醛固酮系统(RAAS)的主要活性成分。它是一系列蛋白水解反应的产物,开始于由肾素介导的血管紧张素原向血管紧张素Ⅰ的转变(图1)。血管紧张素Ⅱ具有许多的快速起效的作用,包括血管收缩(通过减少血容量),增加醛固酮分泌(导致钠潴留),增加渴感以及抗利尿激素的分泌(使人体减少水摄入),增加心肌收缩力(导致心输出量增加)以及增加交感神经系统活性。这些反应可以看做是当血容量减少时,机体为维持有效循环而做的一系列共同反应。然而,从长远来看,血管紧张素Ⅱ可能导致一些营养改变(trophic changes)如血管平滑肌和心肌增生,细胞外基质沉积,血管对低浓度血管收缩物质变得敏感。这些改变可以看作心血管系统缓慢地结构重塑,以代偿长期的血容量不足。然而,在不限制水和盐的情况下,血容量不足并不是一个普遍存在的问题,因此血管紧张素Ⅱ的营养效应(trophic effects)更可能是致病性的而非保护性的。这一观点或许可以解释,ACEI和ARBs通过抑制血管紧张素Ⅱ的产生和活性,除了明显降压作用外,还可使许多心血管疾病得到改善的原因。在这篇综述中,我们将重点讨论血管紧张素Ⅱ以及RAAS系统的其他活性成分,例如醛固酮和肾素,在糖尿病肾病发病和进展过程中的作用。另外,我们还将讨论这些RAAS抑制剂对糖尿病患者可能发挥的肾脏和心脏保护效应。
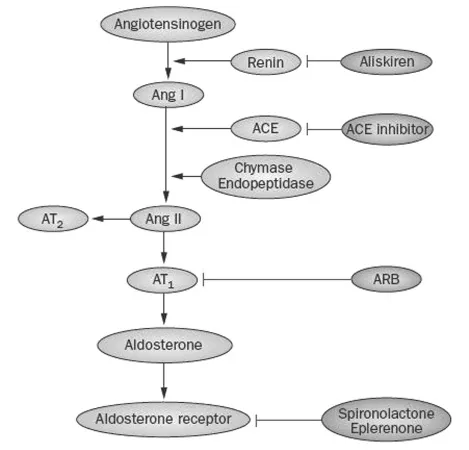
图1. RAAS系统以及口服治疗有效的RAAS抑制剂
未控制的RAAS系统活化效应
RAAS系统直接参与调节血压、液体容量以及对损伤和炎症的血管反应。如果这一系统激活不当,可以导致高血压、液体潴留,以及长期可能引起终末期器官损伤的炎症、血栓、动脉粥样硬化效应。虽然醛固酮、肾素和血管紧张素Ⅰ的一些分解产物也参与其中,但RAAS对靶器官的作用大部分是由血管紧张素Ⅱ介导的,既可以发生在循环系统,也可以发生在组织中。在心脏、肾脏和脑,血管紧张素Ⅱ也可以通过糜蛋白酶(chymases)和内肽酶(endopeptidases)参与的非ACE途径生成,并且与血管紧张素Ⅱ对中枢影响相比,其在靶器官发挥的作用似乎要更大。血管紧张素Ⅱ可与两种不同的受体亚型结合,分别是AT1受体和AT2受体。AT1受体介导血管收缩、醛固酮释放、血管重塑、增加氧化应激以及促进炎症、动脉硬化、血栓形成。相反,AT2受体的激活可以引起血管舒张、生长抑制和抗动脉硬化,另外还有潜在的有害效应,如心脏肥大和伴有冠状或外周动脉闭塞损伤后的血管再生。
第一种 ACEI,卡托普利(captopril),被Ondetti以及他的同事在1977年用于治疗肾血管性高血压,从此,开始了研究RAAS在肾脏疾病的病理生理作用的新时代。1986年,Zatz和他的同事发现,在链脲霉素诱导(streptozotocininduced)的糖尿病大鼠模型中,应用依那普利(enalapril)治疗,可以改善肾小球毛细血管性高血压以及预防蛋白尿和肾小球结构损伤,从而第一次提出了明确的证据,证明RAAS在糖尿病性肾小球疾病的发病以及进展过程中具有重要的作用。随后的研究证实,血管紧张素Ⅱ是介导与糖尿病肾病蛋白尿相关功能和结构变化的关键物质。除具有多种作用之外,血管紧张素Ⅱ还可以通过增加肾小球内毛细血管压力,诱导足细胞细胞骨架重排和改变裂孔隔膜成分,最终损害肾小球屏障的过滤功能。这些改变可以促使血浆蛋白的超过滤,一部分随尿液丢失,一部分在足细胞沉积或在近端小管被重吸收。近端小管细胞和足细胞会释放生长因子以及血管活性或者炎性介质,从而导致肾小球硬化进展以及小管间质瘢痕化。这些数据为20世纪90年代进行的大规模随机对照临床试验提供了背景,这些试验的目的是研究ACE抑制剂在治疗进展性慢性肾病(包括1型糖尿病伴发的显性肾病)中的肾脏保护作用。ARBs、醛固酮拮抗剂以及肾素抑制剂逐渐加入到RAAS抑制剂的家族中。并且在过去十年中,我们进行了很多试验,以确定最有效的可达到最大肾脏保护效应的药物组合。
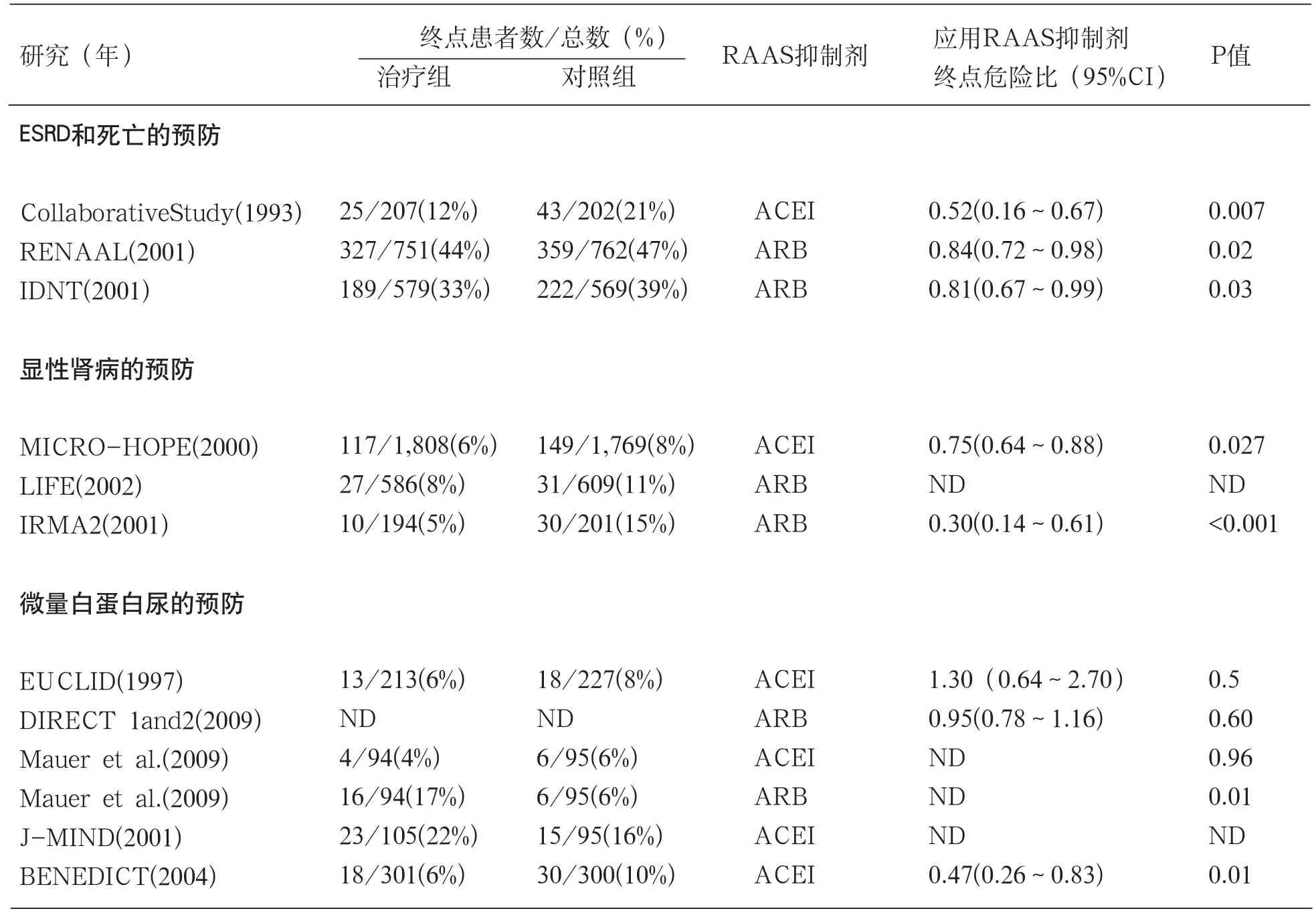
表1 1型和2型糖尿病患者应用RAAS抑制剂的主要随机对照试验
终末期肾病的预防
1型糖尿病
Taguma 和他的同事于1985年进行的一项开创性研究发现,对10名处于糖尿病肾病氮质血症期患者,应用不影响系统性血压剂量的卡托普利(captopril)即可以改善其肾病综合征。在20世纪80年代末和90年代初,Scandinavian研究小组进行的随机临床研究表明,应用ACEI治疗的糖尿病患者肾小球滤过率(GFR)下降要慢于未应用ACEI的患者。1993年,Collaborative研究发现,在409名尿蛋白>500mg/d、血清肌酐<221μmol/ L(2.5 mg/dl)的1型糖尿病患者,应用卡托普利治疗3年,相较于安慰剂组,其双倍血清肌酐(doubling of serum creatinine)、终末期肾病(ESRD)和死亡率的复合终点发生率减少50%(表1)。多变量分析显示,治疗效果与两组患者的血压的微小差别无关,与卡托普利治疗引起的尿蛋白排泄量显着减少有关。并且,如果把卡托普利治疗效果看作单一终点,心血管疾病死亡率减少一半。这第一次为ACEI对糖尿病患者具有心脏保护效应提供了证据。
2型糖尿病
Collaborative 研究发表近10年后,RENAAL研究和IDNT研究的结果相继发表,这两项针对2型糖尿病合并显性肾病患者的大型队列研究的结果显示ARB治疗(与安慰剂组相比)使双倍血清肌酐、终末期肾病(ESRD)和死亡率的复合终点发生率分别减少了16%和19%(表1)。同样,肾脏保护效应与尿蛋白排泄量的显着减少相关,即使在校正了两组之间血压控制的微小差异后,其仍然具有意义。两项研究表明,早期尿蛋白排泄量的减少,可以减慢肾功能丧失的速度,并且在长期可以降低心血管疾病死亡率。
为了评估ACEI和ARBs的特异性肾脏保护作用,进行了一项meta分析,将异质种族的患者随机分为RAAS抑制剂治疗组和对照组,旨在比较两组的肾脏结局。多项小型研究表明,RAAS系统抑制剂对糖尿病性或非糖尿病性慢性肾病高危患者是有肾脏保护效应的。相比之下,多项大型心血管试验结果表明,对于没有肾脏疾病证据的低危因素患者,RAAS系统抑制剂并没有肾脏结局的益处或仅有较少益处。即使有上述局限,但总的数据表明,与未使用RAAS抑制剂抗高血压治疗的患者相比,ACEI或ARBs的使用使ESRD的风险降低了13%,血清肌酐倍增的风险降低了29%,并且这种风险的减少并不能通过血压的变化来解释。此外,meta分析还显示,近5000名糖尿病患者,在收缩压和舒张压控制没有差异的情况下,与非治疗组相比,使用ACEI和ARBs治疗可以更有效地减少尿蛋白,并且这与入组时的尿蛋白水平无关。
显性肾病的预防
波士顿Brenner小组在20世纪80年代进行的一项实验表明,在糖尿病的诱导阶段开始应用ACEI几乎可以完全阻止糖尿病性肾病实验大鼠肾脏的功能和结构的变化。后来的研究,特别是针对2型糖尿病的实验研究结果一致表明,RAAS抑制剂的效应具有时间相关性,在糖尿病的诱导阶段早期应用RAAS抑制剂可以普遍的减少蛋白尿和预防肾小球硬化,但如果在与糖尿病肾病相关的功能和结构变化已经出现之后再开始治疗,则基本上是无效的。这些研究结果为研究人类疾病早期应用RAAS抑制剂干预的效应提供了试验背景。
1型糖尿病
欧洲微量白蛋白尿与卡托普利研究(European Microalbuminuria Captopril Study)以及北美微量白蛋白尿研究(North American Microalbuminuria Study)表明,1型糖尿病合并微量白蛋白尿但肾功能和血压正常的患者,与安慰剂组相比,ACE抑制剂治疗可以降低显性肾病(持续性微量白蛋白尿)发病率并且对肾功能具有保护作用。对12项研究进行meta分析,纳入698名 1型糖尿病合并微量白蛋白尿的患者,随访至少1年,结果表明,与安慰剂组相比,ACEI使白蛋白尿发生率减少了62%。更重要的是,Parving和Hovind 发现,如果1型糖尿病患者预防蛋白尿发生,可以使肾功能在长达8年内维持正常。
2型糖尿病
HOPE研究将9,000多例(其中3,577例是糖尿病患者)心血管疾病高危患者,随机分为ACEI雷米普利(ramipril)治疗组和安慰剂组,平均5年。结果表明,尽管两组血压控制具有一定差别,但与安慰剂组相比,接受雷米普利治疗5年的患者,心肌梗死、中风和心血管疾病死亡的发生率减少了22%。雷米普利治疗还与糖尿病患者蛋白尿的发病率降低相关。
然而,第一次正式公开表明使用RAAS抑制剂可以预防糖尿病肾病的是对2型糖尿病患者进行的厄贝沙坦(Irbesartan)研究和IRM研究,后者是一项随机临床实验,纳入590名高血压患者并伴有2型糖尿病和微量白蛋白尿。研究发现,与安慰剂组相比,应用ARB药物厄贝沙坦300mg/天治疗平均2年,可以使大量蛋白尿的发生率减少3倍(表1), 而应用厄贝沙坦150mg/天,并没有明显影响大量白蛋白尿发生率。
微量白蛋白尿的预防
糖尿病患者发生肾功能不全的首要临床症状一般是微量白蛋白尿,其在糖尿病患者每年发生率大约是2%~5%。微量白蛋白尿的出现强烈预示糖尿病肾病的发生。出现微量白蛋白尿的1型和2型糖尿病患者,其糖尿病肾病发生风险与没有微量白蛋白尿患者相比,分别增加21倍和9倍。此外,有40%~50%伴有微量白蛋白尿的2型糖尿病患者最终死于心血管疾病,这个比例比没有肾脏疾病证据的糖尿病患者死于心血管疾病的比例高3倍。因此,预防微量白蛋白尿可以作为预防最终发生显性肾脏疾病的工具,并可能有助于降低与糖尿病相关的心血管事件发生风险。强化治疗代谢和血压,尤其是应用RAAS抑制剂治疗,也可能使微量白蛋白尿得到改善。这一发现说明微量白蛋白尿对肾脏损害仍然可以逆转,即可用来评估患者肾脏或心血管事件发生风险是否增高。
1型糖尿病
在一项纳入530例尿蛋白正常或者微量白蛋白尿的1型糖尿病患者的临床研究,EUCLID研究,将患者随机分为赖诺普利(lisinopril)组和安慰剂组,随访2年,结果显示,ACEI治疗组患者的尿蛋白排泄率与安慰剂组相比,低2.2 μg/min;但是,这一效果仅限于微量白蛋白尿患者,并不适用于尿蛋白正常患者(表1)。两项大型安慰剂对照研 究(DIRECT-Prevent 1和DiRECT-Protect 1),纳入3326例1型糖尿病患者应用ARB药物坎地沙坦(candesartan)治疗平均4.7年,未能观察到对微量白蛋白尿发展具有保护效应。最近,将285例血压正常的1型糖尿病患者随机分为ACEI依那普利(enalapril)组、ARB药物氯沙坦(losartan)组以及安慰剂组,随访5年发现,与安慰剂组相比,依那普利组未能显著降低微量白蛋白尿的发生率,氯沙坦组微量白蛋白尿的发生风险与安慰剂组相比增加了三倍。
2型糖尿病
日本J-MIND研究对95例尿蛋白正常的2型糖尿病患者,应用依那普利(enalapril)治疗2年,结果发现,其微量白蛋白尿的发生率低于应用硝苯地平(nifedipine)治疗的106例对照组患者(15.8%vs. 21%)。但是,这一研究结果并不十分确定,因为该研究在评估对新发生微量白蛋白尿治疗效果方面缺乏效力。
BENEDICT研究是第一个大型前瞻性临床试验研究,该项研究目的是评估合并有高血压但没有肾脏损害证据的2型糖尿病患者持续性蛋白尿(微量白蛋白尿在连续两次访问证实)是否可以预防。1,204例患者随机分为ACE抑制剂群多普利(trandolapril)单一治疗组,钙通道阻滞剂维拉帕米(verapamil)单一治疗组,群多普利联合维拉帕米治疗组以及安慰剂组,平均随访3.6年后,联合治疗组微量白蛋白尿的发生率是5.7%,群多普利组为6%,维拉帕米组为11.9%,安慰剂组为10%。因此,ACEI治疗对微量白蛋白尿的发生具有显著保护效应,并且联合应用非二氢吡啶类钙通道阻滞剂并不会使保护效应增强(见表1)。非二氢吡啶类钙通道阻滞剂治疗效果与安慰剂类似。与群多普利治疗(单独或与维拉帕米联合)相关的微量白蛋白尿发病率的降低,在校正基线以及收缩压和舒张压之后仍非常显著,这表明ACEI对肾脏具有特异性保护作用,并且这种保护作用不能被治疗组之间血压的差别所解释。
无论采用何种治疗方法,将收缩压控制在140mmHg以下或舒张压控制在82mmHg以下都可以使微量白蛋白尿的风险显著降低。ACEI治疗对于血压高于140/82 mmHg的患者尤其有效,ACEI治疗可以使其微量白蛋白尿的发病率降低到和血压在140/82 mmHg以下的患者相同。在临床实践中,即使应用两种以上的药物也只有少数糖尿病患者的血压达标,因此这一发现说明ACEI在高血压治疗联合用药中的重要性。事实上,高血压本身就是肾病的独立危险因素,可能预示和促进微量白蛋白尿的进展。因此将ACEI作为糖尿病患者抗高血压治疗的一线药物的另一个原因就是其具有控制血压和预防微量白蛋白尿及相关疾病发病率的双重益处。
正在进行的ROADMAP研究,其目的在于评估4,400例尿蛋白正常的2型糖尿病患者进行ARB治疗是否可以预防微量白蛋白尿的发展。该研究将其中超过2000例2型糖尿病患者分为非RAAS抑制剂治疗组,尽管BENEDICT研究显示ACEI对于这类患者微量白蛋白尿的发生具有保护作用。VARIETY实验目的在于评估对于目前尿蛋白处于正常高限但具有微量白蛋白尿高危风险的2型糖尿病患者是否联合应用两种RAAS抑制剂比单一药物更有效(临床实验登记号 NCT00503152)。
ADVANCE实验结果表明,控制代谢对于预防微量白蛋白尿也具有关键作用。在11,140例2型糖尿病患者,将糖化血红蛋白(HbA1c)降到6.5%以下,与标准血糖控制组相比,可以使微量白蛋白尿的发生率减少9%,肾功能恶化风险减少21%。虽然严格的代谢控制并没有减少心血管疾病发生危险,但将糖化血红蛋白控制在7%更有利于预防微血管并发症。
心血管事件的预防
尽管ACEI和ARBs对糖尿病患者的肾脏保护效应相似,并且都与肾脏损害的严重程度无关,但一些研究表明,这些药物对心血管事件可能具有不同的影响。
ACEI
在Collaborative研究中,平均随访3年之后,接受卡托普利(captopril)治疗的207例1型糖尿病合并显性肾病的患者中有8例死亡(3.9%),安慰剂组的202例患者中有14例死亡(6.9%)。ABCD研究也得到了一致的研究结果,该研究旨在对尿蛋白正常、微量白蛋白尿、大量蛋白尿的2型糖尿病患者比较应用 ACEI依那普利(enalapril)和钙通道阻滞剂尼索地平(nisoldipine)2种治疗方法,以及2种血压控制目标(舒张压<75 mmHg或者舒张压在80~90 mmHg之间)效应的不同。结果显示,依那普利治疗组的235例患者有5例(2.1%)发生了致命或非致命性的急性心肌梗死,而尼索地平组235例患者有25例(10.6%)。此外,ACEI治疗组比尼索地平治疗组患者的左心室质量指数降低更明显。根据这些调查结果,经过4年随访之后,ABCD研究的数据和安全监督委员会认为由于其卓越的心脏保护效应,所有的病人都应该改用依那普利治疗。
ARBs
在RENAAL研究中,751例氯沙坦(losartan)治疗的患者有90例(12.0%)发生了致命性心血管事件,安慰剂组762例患者中有79例(10.4%)。这一结果虽然在统计学上没有显著意义,但有很大的临床意义,这种与氯沙坦治疗相关的心血管事件死亡率的升高似乎与患者尽管使用了RAAS抑制剂但仍有严重蛋白尿残留事件发生相关。在LIFE研究中,586例氯沙坦治疗的2型糖尿病患者有103例(17.6%)发生了致命性或非致命性心血管事件,609例使用β受体阻滞剂阿替洛尔(atenolol)的患者中有139例(22.8%)。然而,被分到阿替洛尔组的患者具有更多的心血管事件高危因素(例如吸烟、高舒张压和心房纤颤)以及在治疗开始时糖尿病更加严重,这些因素都可能干扰实验结果的分析。另一个争论焦点是该结果是否反映了氯沙坦具有心脏保护效应,还是阿替洛尔具有通过加重胰岛素抵抗以及增加中央主动脉压力导致的有害作用,此两个因素都是心血管事件发生的独立危险因素。
ACEI和ARBs的比较
DETAIL研究旨在表明,在合并微量白蛋白尿或者大量蛋白尿的2型糖尿病患者,ARB类药物替米沙坦(telmisartan)的肾脏保护作用并不低于ACEI依那普利(enalapril)。经过5年随访,替米沙坦组的120例患者有27例(22.5%)发生了致命性或非致命性心血管事件(脑卒中、急性心肌梗死、充血性心力衰竭),依那普利组的130例患者中发生了21例(16.2%)。但该文献没有报告这在统计学上是否有显著差异。
2 型糖尿病的预防
ACEI有可能可以预防2型糖尿病的观点来自于对心血管事件高危风险患者进行的HOPE研究的二次分析。分析表明,雷米普利(ramipril)治疗组与安慰剂组相比,可以使2型糖尿病发病风险减少34%。随后对12项随机试验进行的meta分析发现,应用ACEI与ARBs治疗,与安慰剂组相比,可以使2型糖尿病发病率分别降低27%和23%。DREAM研究旨在验证ACEI治疗可以预防糖耐量受损患者发生糖尿病的假说。研究结果表明,接受雷米普利治疗3年的患者血糖水平及HbA1c水平均低于对照组,但两组之间的糖尿病发病率没有显著差异。因此,尽管ACEI对糖尿病高危人群的代谢控制较其他的抗高血压药物更有益,但这类药物似乎没有预防糖尿病发生的作用。
影响RAAS抑制剂治疗获益最大的因素
ACEI/D的多态性
ACE基因是一个与慢性肾脏疾病的发生及进展相关的基因,该基因的多态性可以影响ACEI和ARBs的治疗效应。与杂合子插入/缺失型(I/D)和纯合子缺失型(D/D)相比,纯合子插入型(I/I)对1型和2型糖尿病患者肾病的发生和进展具有保护效应,可能是由于该基因型可以降低ACE的血浆水平以及降低葡萄糖诱导的肾小球高滤过相关。I/I可以使尿蛋白正常或者合并微量白蛋白尿的糖尿病患者采用ACEI治疗获益最大,D/D 基因型则可以使合并大量蛋白尿的患者获益最大。评价ACE I/D多态性可能有助于确定肾病发生和进展的风险并且评估患者是否可以从RAAS抑制剂治疗中获益最大。
盐摄入量
在糖尿病实验模型中,限制食盐摄入可以改善动脉高血压,肾小球高滤过和蛋白尿,缩小肾脏体积,增强ACEI的抗蛋白尿效应。在高血压合并肾脏疾病的患者,限制食盐摄入可以增强ACEI和ARB治疗的抗高血压和抗蛋白尿效应,并且在长远意义上可以减少GFR的降低。糖尿病患者的食盐摄入量往往是高的,进而引起体内钠总量升高,导致盐敏感性高血压,加剧肾脏损害,使ACEI的疗效降低。这些研究结果强调,为使RAAS抑制剂的肾脏保护效应达到最大,限制食盐摄入是重要的。
肥胖
肥胖是2型糖尿病全球流行的重要原因,是肾脏和心血管疾病的独立危险因素。除药物干预外,限制热量和增加体力活动是治疗肥胖和改善代谢综合症及相关并发症的一线治疗措施。值得注意的是,肥胖被普遍认为与盐敏感性高血压相关,并且可以降低RAAS抑制剂的疗效。但是现在这一普遍观点受到质疑,在试验中,表现出RAAS抑制剂肾脏保护作用的2型糖尿病患者(处于不同肾病阶段),绝大多数都是肥胖的。在这些患者中,RAAS抑制剂可能比利尿剂和β受体阻滞剂更有优势,因为其不会使代谢综合征加重。限制热量联合限制食盐摄入和/或利尿剂治疗可能有助于提高这一人群RAAS抑制剂的肾脏保护作用。
最大限度地发挥RAAS抑制剂的疗效
增加ARBs药物坎地沙坦(candesartan)或缬沙坦(valsartan)的剂量,超过抗高血压治疗的推荐剂量,已经被证实可以增加其对合并微量白蛋白尿或者大量蛋白尿的2型糖尿病患者的抗蛋白尿作用,而并不会对血压控制产生明显的影响。但过分强调这些医药公司赞助的研究结果,会掩盖学术研究发现的ACEI的相似作用。在360例非糖尿病性慢性肾病患者中,将 ACEI贝那普利(benazepril)剂量增加到20.8mg/天,使蛋白尿水平比基线水平减少了近60%,比10mg/天的抗高血压应用剂量观察到的40%更加显著。此外,大剂量(30~40mg/天)ACEI赖诺普利(lisinopril)具有减轻慢性肾病和肾病综合征相关血脂异常的额外益处,从而减少了应用HMGCoA还原酶抑制剂进行降脂治疗的费用。在大剂量ARBs则没有观察到类似的结果。
由于RAAS双重抑制在抗蛋白尿效应上的优越性(表2),因此,联合应用这两类RAAS抑制剂对大多数糖尿病肾病患者来说是可取的。联合应用ACEI和ARBs较单一应用其中任何一种药物更加有效。在接受ACEI治疗的患者加用ARBs可以抑制通过非ACE途径产生的血管紧张素Ⅱ的活性。在接受ARB治疗的患者加用ACEI可以抑制由于AT1受体阻滞诱导的代偿性血管紧张素生成。这些观点可能可以解释,1型糖尿病合并糖尿病肾病的患者ACEI和ARBs联合治疗引起的蛋白尿下降比单一RAAS抑制剂更加显著的原因。在CALM研究中,将199例合并2型糖尿病、微量白蛋白尿的高血压患者随机分为坎地沙坦(candesartan)和赖诺普利(lisinopril)治疗组,经过12周的单一药物治疗后,再继之以12周的单一药物治疗或者联合治疗,联合治疗引起的蛋白尿下降较单独应用坎地沙坦或者赖诺普利更加显著。
在上述研究中, RAAS双重抑制比单药治疗可以更好的控制血压水平。但是,其更加卓越的抗蛋白尿效应,到底是由于RAAS抑制更加有效引起的,还是由于血压控制更加理想引起的,这是不能确定的。一项交叉研究旨在解决这一问题,其比较了在非糖尿病性慢性肾病患者单独应用固定剂量的苯那普利(benazepril)和缬沙坦(valsartan),以及联合应用两种药物的半剂量,结果显示抗蛋白尿效应的不同。联合治疗可以更好的降低蛋白尿。而三组的血压控制水平基本上相同,说明联合用药比单一药物治疗抗蛋白尿效用更强,并不是由于抗高血压作用增强的结果,而是由于其可以更有效的抑制RAAS。
两个正在进行的随机试验,VALID和VA NEPHRON-D(临床实验登记号分别是NCT00494715和NCT00555217),将正式讨论对2型糖尿病合并显性肾病的患者是否应用RAAS双重抑制比单一药物更有效预防患者进展为终末期肾病。ACE抑制剂联合ARBs应用以减少尿蛋白排泄率是预防糖尿病肾病患者进展为终末期肾病的最有效的方法,同时可以预防与慢性肾脏疾病相关的心血管事件引起的死亡风险。ARBs仅在ACE抑制剂引起患者咳嗽(不良反应)时才比ACE抑制剂更适合。
相比之下,RAAS抑制剂对非蛋白尿肾病的患者似乎没有肾脏保护作用。同时,应用这种治疗方法而使患者暴露于RAAS抑制剂引起的不良反应的风险下也是没有必要的,例如高血钾、急性肾功能恶化;这些不良反应在老年人以及合并有GFR降低和/或肾血管疾病的2型糖尿病患者更加常见。ONTARGET研究结果表明,这些不良反应的风险在联合应用ACE抑制剂和ARBs以达到最大RAAS抑制剂效果时会进一步增加。该研究将25,620例确诊的动脉粥样硬化性血管疾病的患者随机分为雷米普利(ramipril)组,替米沙坦(telmisartan)组,或两者联合治疗组,这其中包括6,982名2型糖尿病合并终末期器官衰竭的患者。经过56个月的随访,三组心血管事件的发生率相似,而任何形式的透析、肾移植、双倍血清肌酐或死亡等结局,在联合治疗组较单独应用替米沙坦或雷米普利的患者更加常见。因此联合用药虽然可以使尿蛋白改善,但却使得不良反应的发生率增加。因此,人们建议应重新评估在慢性肾脏疾病患者将尿蛋白的改善作为肾功能恢复的评价指标是否合理。但是,接受联合治疗的患者的不良肾脏事件增加更多的是由于这些患者需要进行急性血液透析来治疗一过性肾功能不全。可以想象,这对急性血液透析需求的增加更多反映的是由于血压降低过多、低血容量或者缺血性肾脏疾病造成的一过性的肾脏低灌注,而这些在停药后可以得到改善。相反,双倍血清肌酐、终末期肾病的发生率各组之间相似,都比较罕见,反映了这种慢性肾功能的逐渐衰退与在正常人群观察到的结果相似,其与治疗方案无关,而与年龄逐渐增加相关。这种慢性肾功能的逐渐衰退可能在很大程度上是由于只有4%的病人有明显的蛋白尿,这也可以解释为何在这一人群应用RAAS抑制剂似乎没有改善肾功能的原因。因此,在心血管事件发生风险增加,但无明显蛋白尿包括肾血管硬化或缺血性肾脏病(大多数的CKD患者)的患者,RAAS抑制剂疗效最大化并不能减少患者的肾脏和心血管事件的发生,但可以使不良反应的发生率增加。ACEI和ARBs对于肾脏和心血管事件的影响是相似的,并且联合用药也不会增加其疗效。
显性糖尿病肾病
在应用传统抗高血压剂量的ACEI控制肾病范围内蛋白尿(nephrotic-range proteinuria)失败的56名患者中,应用最大耐受剂量的ACEI联合ARBs( RAAS双重抑制)进行降压、纠正代谢和血脂的强化治疗,使其中的26名患者的蛋白尿得到缓解或减少,并减缓GFR下降。随访4年后,其中只有2名进展到终末期肾病阶段,而性别、年龄和尿蛋白排泄率都匹配的对照组的56例病人接受了传统ACEI治疗,有17例进展到了ESRD阶段。然而,在糖尿病患者,该方法的肾脏保护效应并不是特别大。尽管采用强化治疗和多药联合治疗,在大多数糖尿病患者其收缩压仍大大高于控制目标,这可能部分抵消了RAAS抑制剂对这些患者的抗蛋白尿和肾脏保护作用。
难治性高收缩压是2型糖尿病特别是合并肾功能不全患者的一个常见问题,其可导致肾脏和心血管事件发生风险进一步增高。此外,与在1型糖尿病肾病和非糖尿病性慢性肾病研究得到的结果相反, ACEI在2型糖尿病合并显性肾病的患者并不能明显改善受损的肾小球屏障的分子筛功能。此外,ACEI治疗可能并不能预防这些患者超滤蛋白对肾脏的慢性毒性作用,在长期其肾脏保护效应可能更小。ACEI对糖尿病肾病后期的治疗效果不佳的一种解释是,在显性肾病,糖尿病患者的肾脏结构改变非常严重并且弥散,以至于药物治疗并不能达到阻止蛋白尿和疾病进展的预期疗效。这一观点与RENAAL试验的结果一致,氯沙坦可以使基线尿蛋白肌酐比低于2000 mg/g的患者进展为ESRD的风险减少近50%,但对重度蛋白尿患者,则没有明显效果。这些结果说明,对于糖尿病合并显性肾病的患者,迫切需要寻找新的更有效的治疗方法以预防肾病进展。
加用醛固酮拮抗剂
ACEI或ARBs治疗可以引起血浆醛固酮水平显著降低,这有助于RAAS抑制发挥对全身和肾脏系统的有益效应。但是,大约50%的患者血浆醛固酮水平又开始增加(在最初的降低之后)至治疗前的水平或更高。这种现象被称为“醛固酮突破(aldosterone breakthrough)”,可能由血钾水平的增高,或者是由非ACE途径(糜蛋白酶和组织蛋白酶介导)产生血管紧张素Ⅱ增加,进而引起肾上腺醛固酮刺激性升高。醛固酮在远端肾单位可以发挥盐皮质激素作用,从而引起水钠潴留,这限制或减弱了ACEI以及ARB的降压和减少尿蛋白效应。醛固酮也可能通过上调肾小球血管紧张素Ⅱ受体对肾小球血流动力学和血管紧张素Ⅱ的营养作用(trophic effects)发挥协同效应。最后,醛固酮水平升高可能直接对肾小球动脉、肾成纤维细胞、系膜细胞和足细胞产生有害的促炎症和促纤维化效应。这些影响中的大多数都可以通过使用醛固酮拮抗剂而消除。
在盐负荷单侧肾脏切除大鼠注射醛固酮,其重度蛋白尿和足细胞损害可以通过应用醛固酮拮抗剂依普利酮(eplerenone)消除,但应用血管扩张剂肼屈嗪(hydralazine)则无效,尽管两者降压水平相似。与之一致,在接受氯沙坦治疗的5/6肾切除大鼠加用螺内酯(spironolactone)治疗,可以使蛋白尿进一步减少,并且可以使肾小球硬化、肾小管间质纤维化和血管病变逆转。以前的证据表明,加用螺内酯在ACEI治疗的慢性肾病患者,也可以发挥抗蛋白尿效应。这些实验数据促使人们进行了一系列的随机临床试验。这些试验所选取的研究对象是一小部分蛋白尿肾病患者(大多与2型糖尿病相关),都采用ACEI、ARBs或两者联合作为基础治疗(表2)。总的来说,数据显示经过4~52周的治疗,醛固酮拮抗剂与安慰剂组相比可以使尿蛋白减少30~60%。
与这些实验结果一致,在81例2型糖尿病合并高血压和微量白蛋白尿并接受ACEI赖诺普利(lisinopril)治疗的患者,加用醛固酮拮抗剂螺内酯25mg/天治疗,与安慰剂组相比,可以使尿蛋白减少34%,明显超过氯沙坦(losartan)组观察到的17%的效果。尿蛋白的减少似乎是醛固酮抑制的特异效果,因为三组的血压控制水平基本一致。两项旨在观察ACEI和ARB治疗的基础上加用螺内酯治疗效果的研究结果表明,在经过最初肾功能损害加重的阶段之后,GFR下降的速度要慢于对照组,这一发现更加验证了螺内酯具有肾脏保护效应这一观点。
尽管取得了这些令人鼓舞的结果,但是,与螺内酯长期应用有关的不良反应,包括男性乳房发育,勃起功能障碍和月经异常,阻碍了对其长期治疗效果的评估。这种数据的缺陷随着依普利酮(eplerenone)的发展而解决,它是一种特异性醛固酮拮抗剂,没有螺内酯的非选择性盐皮质激素效应。在一项对286例2型糖尿病合并持续性蛋白尿患者进行的随机多中心试验中,在ACEI治疗基础上加用依普利酮50mg/天或100mg/天,与安慰剂组相比,可以显著降低尿蛋白排泄率,并且治疗的耐受性良好。因此,现在我们可以对依普利酮的长期肾脏保护效应进行充分评估,并且验证是否其对肾功能的改善效果可以抵消不良反应造成的影响,如高血钾。这是以醛固酮为基础的RAAS抑制治疗方法的主要限制,特别是在糖尿病合并肾功能不全的患者。

表2 RAAS双重抑制对糖尿病患者蛋白尿影响的主要随机对照试验
直接肾素抑制剂
用ACEI或ARB药物治疗患者,由于AT1受体抑制相关的正反馈,引起肾素释放增加,进而使RAAS抑制剂的疗效减弱。由于肾素能催化RAAS级联反应的第一步反应,也是其限速步骤,因此,肾素抑制剂被认为是一种敏感方法,阻断正反馈环,以“封锁”RAAS下游反应。此外,有数据表明,肾素可以通过在心脏、肝脏、胎盘、脑和肾脏表达的肾素原受体发挥直接的不依赖血管紧张素的效应。这些受体的过表达已经被证实可以引起血压和血浆醛固酮水平的升高,以及与糖尿病微血管并发症相关的蛋白增高。
阻断肾素原与肾素原受体的结合已经被证实有助于预防链脲菌素诱导的糖尿病大鼠模型的肾损害。阿利吉仑(aliskiren),一种口服有效的人肾素抑制剂,已经被开发用于临床,使得可以在糖尿病肾病患者观察到肾素抑制剂的肾脏保护效应。在15例合并微量白蛋白尿或者大量蛋白尿的2型糖尿病患者,使用阿利吉仑300mg/天治疗28天,与治疗前相比,可以使尿蛋白/肌酐比下降44%,使收缩压下降6~8mmHg。随后的一项交叉研究发现,在26例2型糖尿病合并高血压的患者,使用阿利吉仑300mg/天和厄贝沙坦(irbesartan)300mg/天治疗2月,所引起的尿蛋白下降水平相似;两种药物联合应用和单独应用其中任何一种药物相比,尿蛋白下降更加明显。
AVOID研究是一项多国家参与的随机双盲安慰剂对照的研究,旨在评估在接受100mg/天的氯沙坦基础治疗的599名合并2型糖尿病肾病的高血压患者使用阿利吉仑300mg/天所产生的抗蛋白尿效应。研究人员发现,使用阿利吉仑治疗24周,可以使蛋白尿减少20%(安慰剂组没有明显变化,表2)。此外,阿利吉仑治疗组25%的患者,其尿蛋白肌酐比下降达到50%以上,而安慰剂组仅有12.5%的患者下降。在研究结束时,各治疗组之间的血压差异很小,并且没有统计学意义,蛋白尿的变化与动脉血压的变化也没有相关性。进而得出,阿利吉仑在高血压、2型糖尿病和肾病患者,具有肾脏保护效应,而这与其引起的血压下降无关。 ALTITUDE研究(临床实验登记号NCT00549757)旨在确定是否在ACE抑制剂或ARBs治疗的基础上加用阿利吉仑(300mg/天)治疗4年可以减少肾脏和心血管事件的发生率。其对8600例患有2型糖尿病合并微量白蛋白尿、大量蛋白尿或者心血管疾病的患者进行了研究。其他一些关键问题也必须得到解决,以确定阿利吉仑是否是现阶段通用的RAAS抑制剂的有效替代药物。首先,这种药物与其他RAAS抑制剂相比,是否具有更加卓越的抗蛋白尿和肾脏保护作用?其次,是否阿利吉仑与ACEI、ARBs、醛固酮拮抗剂联合应用效果要优于不包括阿利吉仑的其他RAAS抑制剂的联合应用?最后,阿利吉仑为基础的联合治疗是否可以降低高血钾风险?
结论
ACEI和ARBs在糖尿病和非糖尿病患者都具有肾脏保护效应,并且两种药物联合应用可以使保护效应增强。临床研究显示,使用醛固酮受体拮抗剂和直接肾素抑制剂也可以在降压之外获得更多的肾脏和心脏保护效应。但还需要进行长期的临床试验,以评估这些药物是否比ACEI和ARBs更加具有优势,无论是在单独使用时还是作为附加治疗时。这种试验应进行充分的对照比较,以消除由于对新药的偏好而引起的偏倚,从而使新药在与传统有效药物的关系上得到合理的定位。传统药物,如ACEI,比新药便宜,而且仿制药也一般有效,因此医药公司对其发展并不十分感兴趣。然而,这些传统药物的使用在预防以及治疗糖尿病和非糖尿病性肾病方面是十分有用的,特别是在资源有限没有条件进行肾脏替代疗法的地区,预防肾衰竭即是挽救生命。
关键点
● 血管紧张素II在糖尿病肾病的发生和发展中发挥着重要作用,抑制血管紧张素Ⅱ的产生,或积极应用血管紧张素转换酶(ACEI)和血管紧张素II受体阻断剂(ARBs),都对糖尿病患者具有肾脏保护效应。
● ACEI对糖尿病性肾病患者具有心脏保护效应,而ARBs则没有观察到这类作用。
● 在糖尿病患者早期应用ACEI,可以预防微量白蛋白尿的发生,后者是肾脏功能受影响的早期征象,也是心血管疾病的一个标志。
● 2型糖尿病患者出现肾功能不全和肾病范围内蛋白尿后,再应用ACEI和ARBs进行干预的效果并不好,这强调了对患者进行早期干预的重要性和对这一人群寻找新的治疗方法的迫切需要。
● 增加ACEI和ARBs的剂量至超过抗高血压推荐剂量,以及这两类药物的联合应用,都可以更有效地减少尿蛋白和获得最大限度的肾脏保护效应。
● 醛固酮受体拮抗剂和直接肾素抑制剂也可以减少糖尿病患者的蛋白尿,但需要进行长期的临床试验,以评估这类药物在单独应用或者联合应用时,是否比ACEI和ARBs类药物更有效。
