CD4、CD8、MSI表达与散发性结直肠癌预后关系的研究
2010-05-03周玮芦珊杨刚
周玮芦珊杨刚
我国结直肠癌的发病率呈逐年上升趋势[1],结直肠癌的治疗仍以手术治疗为主[2],但仍有40%以上的患者5年内出现复发、转移。目前推测预后的主要可靠依据为常规病理和临床分期等,但用现代分子生物学理论来判断肿瘤的恶性程度、转移、复发的危险性,以补充病理和临床分期的不足,更精确地判断患者的预后是一非常有意义的课题[3]。
细胞毒T淋巴细胞(cytotoxic T lymphocytes,CTL)是机体细胞免疫中重要的效应细胞,参与机体抗肿瘤作用,近来,人们又认识到CD4(+)T细胞在机体抗肿瘤免疫反应中的重要作用。CTL以表达CD8(+)的T淋巴细胞为主,大肠癌中有CD8(+)T淋巴细胞的局部浸润者生存时间提高[4,8]。另外结直肠癌有微卫星不稳定(microsatellite instability,MSI)的表达[5],有研究表明MSI(+)者预后好于MSI(-)者,且有癌肿较大、低分化等病理特点[6,7],而此两项特点却与常规病理预后指标相矛盾。有研究认为MSI(+)结肠癌有癌肿内T淋巴细胞的浸润,因此预后较好[8],为此我们检测了SCRC组织中CD4、CD8和MSI表达及与其预后的关系。
1 材料与方法
1.1 标本材料
标本取自南昌大学第二附属医院1999年1月至2000年3月手术切除的SCRC标本,共50例(经我院医学伦理学委员会同意)。全部患者按阿姆斯特丹标准排除遗传性结、直肠癌,符合SCRC标准;其中男性23例,女性27例,年龄29~81岁,平均年龄49.6岁。术前未经任何抗癌治疗,均经病理学检查确诊。按pTNM病理学分期,Ⅰ期0例,Ⅱ期13例,Ⅲ期26例,Ⅳ期11例。其中区域淋巴结阳性37例,阴性者13例。癌旁组织为上述20例SCRC组织的阴性切缘组织。从原病历中获得癌细胞分化程度、淋巴结转移、癌浸润深度、肿瘤大小等临床病理资料。同时根据上述资料按新版TNM分期标准重新进行TNM分期。
1.2 主要试剂
MAB-0021鼠抗人CD8单克隆抗体、即用型克隆系 C8/144B、Rev 021602鼠抗人CD4单克隆抗体、即用型克隆系4B12、封闭用正常山羊血清工作液、生物素标记二抗工作液和过氧化酶标记链霉素卵白素工作液均为福州迈新公司产品。2×Taq PCR Master Mix为北京天为时代科技有限公司产品。DNA Marker为北京天为时代公司产品。胰酶、DAB(Dialminobenzdine)显色液、蛋白激酶K为美国Dako公司产品。基因组DNA提取试剂盒DP-303/304为北京天为时代科技有限公司产品。引物 BAT25、BAT26、D5S346、D17S261、D2S123为北京三博远志生物技术有限公司产品。
1.3 免疫组织化学检测
SP(streptavidin-peroxindase)法即过氧化物酶标记的链霉素卵白素染色法[12]。以0.01 mmol/L PBS缓冲液取代一抗作阴性对照,用已知阳性切片作为阳性对照。免疫组化步骤按说明书进行操作。
1.4 DNA 提取
在10μm厚的石蜡切片上采用显微微切技术获得肿瘤组织,并进行脱蜡处理,将组织打碎处理为细胞悬液,然后10 000 rpm离心1 min,倒尽上清,加200μl缓冲液GA,振荡至彻底悬浮,然后按产品说明书操作,得到的基因组DNA在OD260处有显著吸收峰。
1.5 PCR 步骤
各取cDNA产物2μl,待测凋亡相关基因和β-actin的正、反义引物各1μl(10μmol/L),2×Taq-Mix 12.5 μl,加 ddH2O 6.5 μl,总反应体积 25 μl。反应条件:94℃ 3 min,94℃ 45 s,55℃ 45 s,72℃ 45 s,38 个循环;结束前72℃延伸10 min。
1.6 结果判定标准
CD4和CD8主要表达于癌细胞的胞膜和胞质,为棕褐色颗粒。免疫组织化学染色切片在光镜下计数。每张切片首先在100倍光镜下观察10个以上独立视野,选取5个阳性细胞数最多的视野,然后换成400倍的光镜进行计数,取5个视野计数的平均数。按文献标准[8],在400倍光镜下CD4细胞阳性数>40个定为CD4(+),其余均为CD4(-);CD8细胞阳性数 >80个者定为CD8(+),其余则定为CD8(-)。参与计数的病理科医师对患者的临床等其它相关信息不知。
MSI结果判定标准按美国国立癌症研究所制定的标准进行:5个微卫星DNA标记中若有2个或2个以上出现MSI现象为MSI(+),若仅有1个出现MSI现象为MSI(-),如无出现MSI现象为MSS。由于MSI(-)和MSS的临床特征相似,故本研究将此两类合并为一组统计。
1.7 随访
采用电话随访及来院复诊相结合方式,登记目前状况、死亡时间、直接死亡原因、复发时间,计算无病生存期、累积生存率等。
1.8 统计学方法
采用卡方检验分析组间差异,应用Spearman等级相关检验分析相关性。采用Log Rank法比较存活率间的差异,同时采用SPSS10.0软件进行统计分析。
2 结果
2.1 SCRC、癌旁组织中CD4和CD8的表达情况
CD4、CD8阳性染色位于癌细胞的胞膜和胞质,癌旁组织切片中均无阳性染色。50例SCRC组织中CD4和CD8表达率均较相应的癌旁组织高,差异有显著意义(P <0.05),见表1。

表1 SCRC和癌旁组织中CD4和CD8的表达情况(例,%)
2.2 CD4和CD8表达与术后生存率的关系
本组50例SCRC患者术后5年生存率为48%。按CD4和CD8表达强弱分组,CD4(+)和CD8(+)组术后5年生存率均高于CD4(-)和CD8(-)组,但无统计学意义(P>0.05)。若将标本分成CD4/8(+/+)[CD4/8(+)]、CD4/8(+/- )、CD4/8(- /+)、CD4/8(-/-)四组,为统计方便将 CD4/8(+/+)表示为CD4/8(+),将CD4/8(+)以外的CD4/8各种表达组合均统表示为CD4/8(-)。则CD4/8(+)组的5年累积生存率高于其余三组之和[即CD4/8(-)],差异有显著性(P <0.01),见表2。
2.3 CD4、CD8表达与SCRC临床病理特征的关系
有无淋巴结转移、肿瘤浸润深度、TNM分期与CD4/8(+/+)表达呈负相关关系(P<0.01),见表2。
2.4 SCRC 组织中 CD4、CD8表达与 MSI(+)的关系
本组50例 SCRC中MSI(+)者12例(24.0%)。CD4/8(+)表达中有62.5%为 MSI(+),而 MSI(-)组中仅占 25.0%,差异有显著性(P<0.01)。经Spearman等级相关分析显示,SCRC组织中CD4/8(+)表达与MSI(+)呈正相关关系(P<0.01),而与MSI(-)无相关性(P >0.05),见表3。
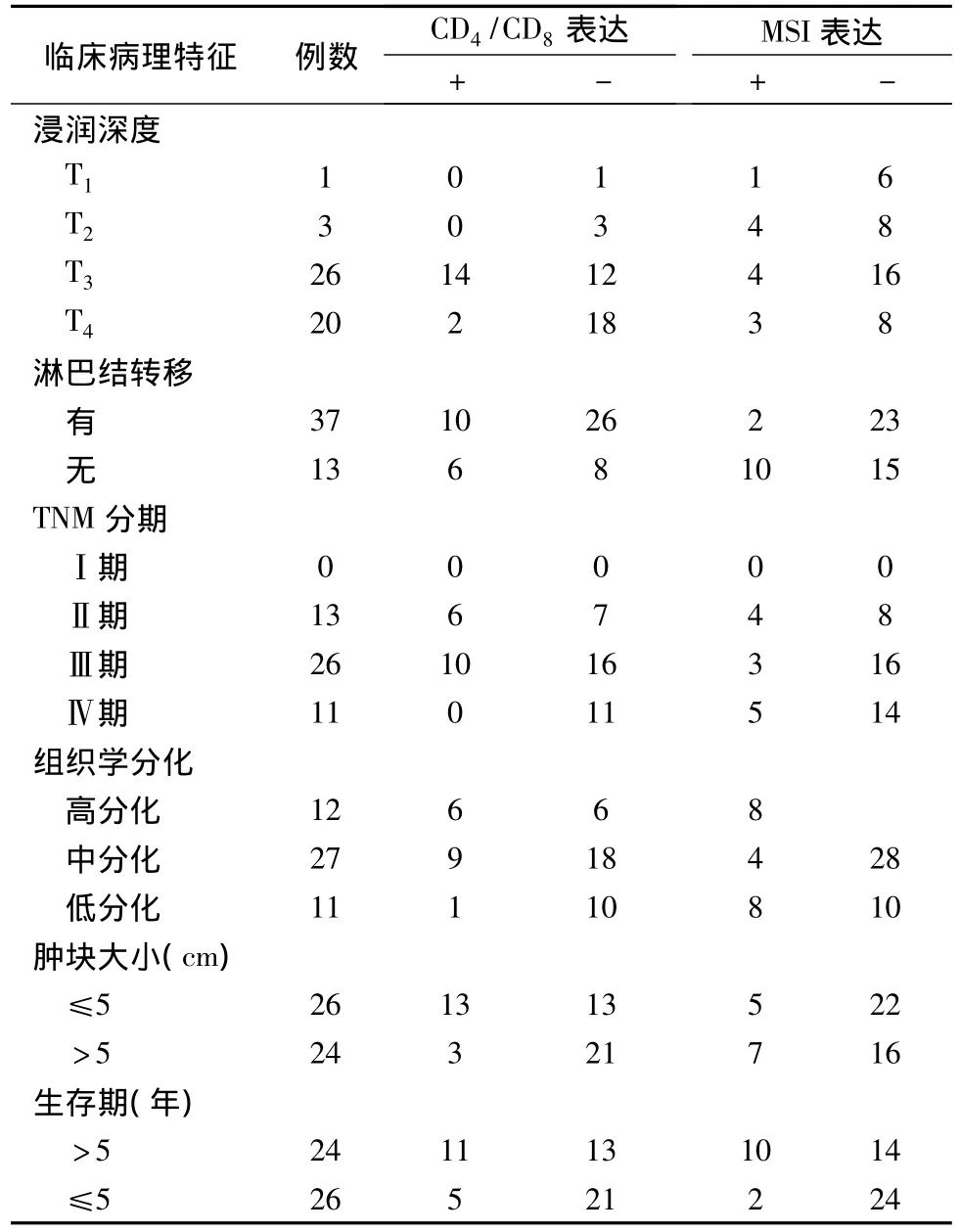
表2 CD4/8表达与SCRC临床病理特征的关系(例)
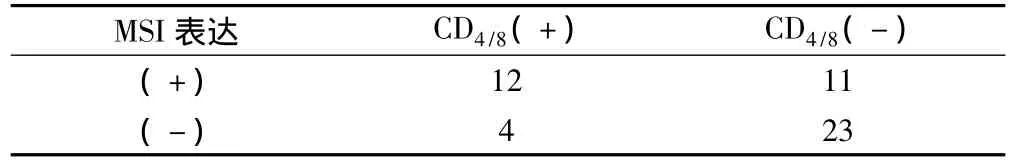
表3 MSI与CD4 CD8表达的关系(例)
3 讨论
3.1 SCRC组织中的肿瘤浸润淋巴细胞
肿瘤浸润淋巴细胞(tumou-infiltrating lymphycyte,TIL)是一类由不同细胞构成的异质细胞群。肿瘤原发灶局部免疫细胞是防止肿瘤生长、发展的第一道防线。TIL可浸入肿瘤组织中,其抗肿瘤作用比循环淋巴细胞更直接,更准确地反映宿主-肿瘤相互作用的免疫应答状态。细胞毒T淋巴细胞(cytotoxic T lymphocyte,CTL)是机体TIL细胞免疫中重要的效应细胞之一,CTL主要是表CD8T淋巴细胞,其主要功能是特异性杀伤靶细胞。肿瘤中CD8T淋巴细胞浸润是有助于延长患者生存时间的独立预后指标[9],有研究认为成熟的T淋巴细胞除CD8T亚群外,还有CD4T淋巴细胞亚群,过去仅注意CD8T的抗瘤作用,近来开始逐渐认识到CD4T淋巴细胞在机体抗肿瘤免疫反应中的作用。有研究认为,CD8T细胞在CD4T细胞本身和其分泌的大量细胞因子辅助作用下杀伤肿瘤细胞,缺乏CD4T淋巴细胞是抗肿瘤免疫效应低下的原因[10,11]。本研究显示 SCRC 中 CD4、CD8表达水平均高于正常组织,差别有统计学意义。虽然单独CD4T(+)组或CD8T(+)组与相应的阴性组相比累计生存时间均更长,但其5年累积生存率差别没有统计学意义,但若将CD4(+)、CD8(+)合并成为CD4/8(+),而CD4/8(+/+)以外的CD4/8各种表达组合均统归为CD4/8(-)加以统计,则CD4/8(+)组的5年累积生存率高于CD4/8(-),差异具有显著性。这提示CD4T可促进CD8T的抗癌效应。因而,对CD4T和CD8T细胞抗癌机制的深入研究对结直肠癌预后判定有一定的价值。
3.2 CD4、CD8表达与 MSI的关系
本组MSI(+)表达率为24%,与先前文献报道相比稍高[12],先前研究认为MSI(+)的结直肠癌预后较好,5年累积生存率高于MSI(-)。而MSI(+)的癌细胞组织分化低者较MSI(-)多见,此点与常规病理的预后相矛盾。目前对MSI(+)预后较好的原因尚不清楚,有学者认为与MSI(+)肿瘤突变负担增加最终削弱了其生长能力及转移潜能,另有学者认为与MSI(+)肿瘤引起机体更强的免疫反应有关[13]。然而,MSI(+)肿瘤局部是否有免疫细胞浸润现象的不同还未见研究报道?本研究发现CD4/8(+)表达占MSI(+)组的62.5%,而在 MSI(-)组中仅占 25.0%,经Spearman等级相关分析显示,SCRC组织中CD4/8(+)表达与MSI(+)具有相关关系,与MSI(-)不具有相关性。这提示MSI(+)的SCRC患者的预后较好的原因可能与癌肿局部的CTL免疫反应有关;从MSI(+)表型产生机制角度解释,由错配修复基因突变引起的MSI(+)组织中有大量的突变蛋白聚集,这些突变蛋白可作为外来抗原刺激机体的免疫系统产生免疫反应并参与抗肿瘤效应[13]。这也为肿瘤组织局部淋巴细胞浸润的产生机制提供合理解释。进一步研究MSI(+)中CD4T和CD8T产生的具体机制,如CD4T或CD8T是由哪个或哪几个框移突变肽诱导而来的,从而作为SCRC免疫性靶抗原治疗提供理论基础。
3.3 MSI、CD4、CD8 与 TNM 分期的关系
TNM分期是目前主要临床分期方法,但在预后判断上也存在一些矛盾现象,应用分子生物学等方法来估计肿瘤的恶性程度,以补充TNM分期的某些不足,更准确地判断预后,为进一步积极辅助治疗提供依据。本研究发现,MSI表达与TNM分期无相关性,而CD4/8(+)与TNM分期有相关性。进一步对同一TNM分期患者生存差异分析发现,13例TNMⅡ期患者中7例存活超过5年,另外6例少于5年,其CD4/8(+)的表达率分别为57.1%和33.3%,差异有统计学意义。26例TNMⅢ期患者中9例存活超过5年,另外17例少于5年,其 CD4/8(+)表达率分别为 66.7%和23.6%,差异有统计学意义。此现象可能是目前临床上常见的TNMⅢ期预后较TNMⅡ期好的原因所在,即MSI(+)导致抗肿瘤效应的CD4/8T细胞局部反应。
因而,本研究认为CD4/8(+)检测可补充TNM分期的不足,特别是MSI(+)者,用于判断预后,或者说可对TNM分期进一步细化,联合TNM分期和CD4/8、MSI可更准确的判断患者的预后,从而为随后的综合治疗的制订提供更准确的治疗方案。
[1] 姜世雄,王锡山,耿长辉.3 607例结直肠癌病例的临床特征变化分析〔J〕.癌症,2009,1:69.
[2] 曹卡加,马国胜,刘奕龙.广州市2000~2002年大肠癌的发病率分析〔J〕.癌症,2009,4:441.
[3] Graziano F,Cascinu S.Prognostic molecular markers for planning adjuvant chemotherapy trials in Dukes’B colorectal cancer patient:How much evidence is enough?〔J〕.Annals of Oncology,2003,14(7):1026.
[4] Nakamura Y,Watchmaker P,Urban J,et al.Helper function ofmemory CD8+T cells:heterologous CD8+T cells support the induction of therapeutic cancer immunity〔J〕.Cancer Res,2007,67(20):10012.
[5] Watkins DJ,Chau I,Cunningham D,et al.Defining patient outcomes in stageⅣcolorectal cancer:a prospective study with baseline stratification according to disease resectability status〔J〕.Br JCancer,2010,102:255.
[6] Yamada K,Kanazawa S,Koike J,et al.Microsatellite instability at tetranucleotide repeats in sporadic colorectal cancer in Japan〔J〕.Oncol Rep,2010,23:551.
[7] Stelzner S,Hellmich G,Koch R,et al.Factors predicting survival in stageⅣcolorectal carcinoma patients after palliative treatment:amultivariate analysis〔J〕.JSurg Oncol,2005,89:211.
[8] Toshiaki I,Tomonobu F,Yuriko S,et al.Tumor-specific immunological recognition of frameshift-mutated Peptides in Colon Cancer with MSI〔J〕.Cancer Research,2003,63(17):5564.
[9] Guidoboni M,Gafa R,Viel A,etal.Microsatellite instability and high content of activated cytotoxic lymphocytes identify colon cancer patients with a favorable prognosis〔J〕.Am J Pathol,2001,159(2):297.
[10] Daniel D,Chiu C,Giraudo E,et al.CD4+T cell-mediated Antigen-specific immunotherapy in amousemodel of cervical cancer〔J〕.Cancer Res,2005,65:2018.
[11] Egilomez NK,Hess SD,Chen FA,et al.Human CD4+Effector T cellsmidiate indirect interleukin-12 and interferongamma-dependent suppression of autologous HLA-negative lung tumor xenogratts in severe combined immunodeficent mice〔J〕.Cancer Res,2002,62(9):2611.
[12] Giacomini P,Leung SY,Chen X,et al.A gene expression signature of genetic instability in colon cancer〔J〕.Cancer Res,2005,65(20):9200.
[13] Lohsiriwat V,Pongsanguansuk W,Lertakyamanee N,et al.Impact ofmetabolic syndrome on the short-term outcomes of colorectal cancer surgery〔J〕.Dis Colon Rectum,2010,53:186.
