日粮蛋白质和发酵碳水化合物水平对断奶仔猪生长性能和肠道特性的影响
2010-04-28川北医学院教务处陈守云
川北医学院教务处 陈守云
昌邑市畜牧兽医管理局 徐海涛
刚断奶仔猪的日粮中过量的粗蛋白质(CP)可能会刺激蛋白质发酵和促进胃肠道中病原菌的增殖(Ball和Aherne,1987)。 通过降低日粮中 CP的含量(Nyachoti等,2006)或者通过增加日粮中可发酵碳水化合物(FC)的量(Awati,2005)可以达到减少蛋白质发酵的目的。本试验旨在评定降低刚断奶仔猪饲料中CP的水平或是增加刚断奶仔猪饲料中FC的量是否对仔猪蛋白质发酵有负作用,并测定仔猪生长性能。
1 材料与方法
1.1 试验动物与处理 本试验选用272头断奶初生重为(8.7±0.17)kg、平均年龄为(26±0.8) d 约克夏和长白猪的二元杂交猪。所有断奶仔猪被分到4个日粮处理中,每个处理日粮都包含低含量和高含量的CP和FC,并且每个处理按照2×2因子排列法分为10个重复。有4个重复中每栏中放8头仔猪,有6个重复每栏中放6头仔猪。所有仔猪均关在电池控制环境的栏(2.00 m×1.10 m)中。
1.2 试验日粮 四组日粮的配制以低含量CP(15%)或高含量 CP(22%)与低含量 FC(7.5%)或高含量FC(13.5%)相结合的方式。日粮组成及营养水平见表1。
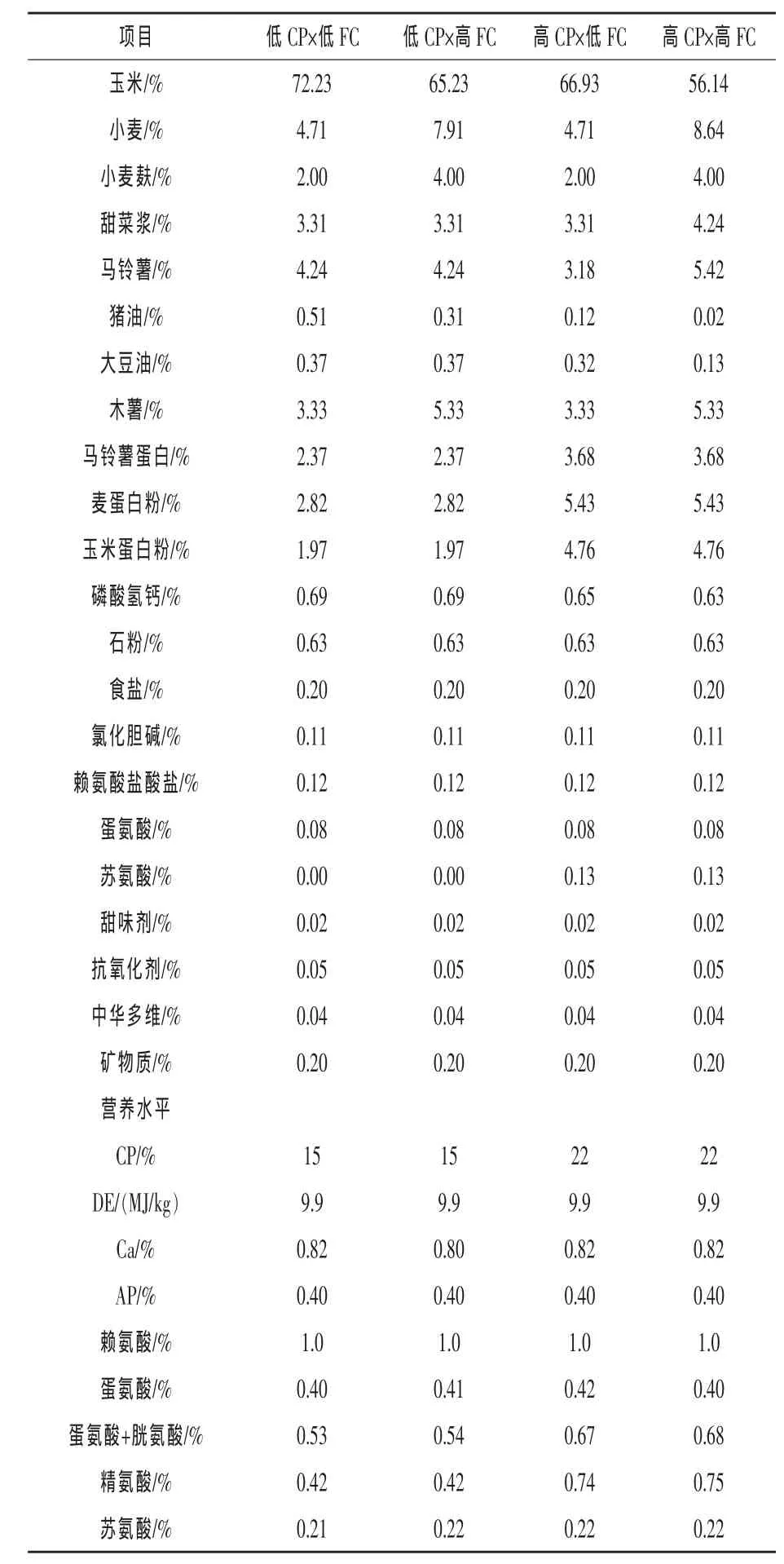
表1 日粮组成及营养水平
根据CVB(2003)将可发酵碳水化合物定义为可发酵非淀粉多糖和回肠中本身含有的不被吸收的小部分淀粉之和。可发酵碳水化合物通过减少小麦和玉米的用量而增加小麦麸、甜菜浆和本地的马铃薯含量。增加动物脂肪和豆油以补偿净能值得含量。通过增加木薯、马铃薯蛋白、麦蛋白粉、玉米蛋白粉和合成氨基酸来增加粗蛋白的水平。每千克日粮中均包含9.9 MJ的净能和1.0 g的回肠可消化赖氨酸。在整个实验过程中仔猪自由采食和饮水。
1.3 方法和分析 记录每栏仔猪(断奶)0、7、14 d和28 d的采食量和体重,并计算每栏猪的日增重、采食量和重料比。此外,每重复选2头平均体重一样的断奶7 d的仔猪安乐死处理并解剖进行肠内性状的检测。在空肠中段获得一段长约20 cm的肠内节段。在小肠黏膜内检测麦芽糖酶、蔗糖酶和N-氨基肽酶的特殊活性 (Marion等,2005),测定绒毛长度和隐窝深度 (Goodlad等,1991)以及回肠和结肠的食糜样本中的NH3的含量,采用培养计数法计算大肠杆菌和乳酸杆菌的数目,并测定乳酸和挥发性脂肪酸(VFA)的量(气相色谱法)。
1.4 统计分析 试验数据等使用GenStat统计软件进行方差分析(GenStat,2000)。
2 结果与分析
2.1 生产性能 由表2可知,在4周的试验期内,增加低CP日粮中的FC含量会降低采食量、日增重和重料比,而增加高CP日粮中的FC含量不影响仔猪的生长性能。此外,给仔猪喂低FC的日粮的同时,降低CP的含量会提高仔猪的采食量和日增重,但是对于喂高FC日粮的仔猪如果降低CP的含量则不会提高仔猪的日增重,相反,还会降低重料比。

表2 对断奶4周仔猪生长性能的影响
2.2 肠道特性 由表3可知,CP和FC含量间的相互作用不显著。低CP水平会降低空肠内氨水的量,而对肠内其他的特性作用不明显。增加日粮中FC的水平会增加乳酸杆菌的数量,降低空肠中大肠杆菌的数量,但不会降低结肠中的大肠杆菌。日粮中FC的含量高会降低空肠中氨水的浓度,并会降低结肠中氨水的浓度。此外,FC的含量高也会增加空肠中乳酸的浓度和结肠中总VFA的浓度。不同日粮的处理组间对消化酶的活性和肠的形态没有明显的影响。
3 讨论
在日粮中降低CP的含量并增加FC的含量会减少蛋白质发酵的风险,并会改进肠道的健康状况和提高生长性能。事实上,同时降低日粮中CP的量和增加日粮中FC的量会降低空肠中氨的浓度。此外,FC含量高对细菌和发酵产物的作用表明,随着日粮成分的改变,微生物群落的构成也会发生相应的变化,这个结果与Konstantinov等(2004)一致,同时表明FC含量高有利于保护仔猪免受致病性大肠杆菌的侵害。日粮中CP含量低也可以降低蛋白的发酵,但是它不对大肠菌和乳酸菌及VFA的产生起任何作用。Nyachoti等(2006)也发现,降低日粮CP的含量(从23%降到17%)并不会对VFA的总浓度和空肠中细菌群数量产生影响。尽管增加FC的量会对肠道的特性有影响,但是增加FC的水平并不会改善断奶后仔猪前4周的生长性能。可能是因为刚断奶仔猪消化能力发育还不成熟,FC含量高的日粮中纤维成分的营养供给不够理想。

表3 对断奶7 d仔猪的空肠和结肠中细菌数目的影响
4 结论
增加日粮中可发酵碳水化合物的量可能会改变断奶仔猪肠道微生物群落结构,降低消化道中氨的浓度,增加消化道中乳酸和VFA的量,但对断奶仔猪的生长性能无显著影响。
[1]Awati A.Prebiotics in piglet nutrition.Fermentation kinetics along the GI tract,PhD Diss[D].The Netherlands:Wageningen University,2005,
[2]Ball R O,Aherne F X.Influence of dietary nutrient density,level of feed intake and weaning age on young pigs.II.Apparent nutrient digestibility and incidence and severity of diarrhea[J].Can J Anim Sci,1987,67:1105 ~ 1115.
[3] CVB.Veevoedertabel Feedstuff Table,Nutritional Value of Feed Ingredients[M].Central Veevoederbureau,Lelystad,The Netherlands.2003.
[4]GenStat.GenStat for Windows,Release 4.2.5th ed. [M].Oxford:VSNInternational Ltd.2000.
[5]Goodlad R A,Levi S,Lee C Y,et al.Morphometry and cell proliferation in endoscopic biopsies:evaluation of a technique[J].Gastroenterology,1991,101:1235 ~ 1241.
[6]Konstantinov S R,Awati A,Smidt H,et al.Specific response of a novel and abundant Lactobacillus amylovorus-like phylotype to dietary prebiotics in the ileum and colon of weaning piglets[J].Appl Environ Microbiol,2004,70:3821~3830.
[7]Marion J,Petersen Y M,Romé V,et al.Early weaning stimulates intestinal brush border enzyme activities in piglets,mainly at posttranscriptional level[J].J Pediatr Gastroenterol Nutr,2005,41:401 ~ 410.
[8]Nyachoti C M,Omogbenigun F O,Rademacher M,et al.Performance responses and indicators of gastrointestinal health in early-weaned pigs fed low-protein amino acid-supplemented diets[J].J Anim Sci,2006,84:125 ~134.
