蟹源地衣芽孢杆菌培养条件的优化
2010-04-28苏州大学基础医学与生物科学学院郝向举李义王文娟郭明凯孙汉王玥
苏州大学基础医学与生物科学学院 郝向举 李义* 王文娟 郭明凯 孙汉 王玥
益生菌具有调节动物肠道生态平衡,增进健康等重要作用,而芽孢杆菌在恶劣环境下形成的抗性休眠体芽孢具有耐高温、耐挤压、可经受颗粒饲料加工过程中的恶劣环境,而在储藏过程中,芽孢又不会消耗饲料的营养成分,不影响饲料品质等优点而倍受青睐。孢子体耐受酸碱,可避免消化液对它的破坏,从而顺利进入宿主肠道。本试验对河蟹肠道分离出一株对致病菌有体外抑制能力的地衣芽孢杆菌,对培养条件进行优化,并对其种子培养基进行探讨,为河蟹益生菌制剂的研发奠定基础。
1 材料与方法
1.1 试验菌种 地衣芽孢杆菌ESB3,分离自中华绒螯蟹肠道,本实验室保存(李术娜等,2009)。
1.2 方法
1.2.1 培养时间对菌株ESB3生长的影响 取菌株ESB3培养24 h的肉汤培养液5 mL,接种于装有50 mL,初始pH为7.2的肉汤培养液的250 mL三角瓶中,28℃,150 r/min摇床培养,从第4小时开始,稀释平板法测活菌数,每隔2 h检测一次,直至48 h(王彦波,2009;罗璋等,2007;刘燕,2006;刘莹等,2006)。
1.2.2 初始pH值对菌株ESB3生长的影响 取菌株ESB3培养24 h的肉汤培养液5 mL,接种于装有 50 mL, 初始 pH 分别为 6.3、6.6、6.9、7.2、7.5、7.8、8.1、9.0 的肉汤培养液的 250 mL 三角瓶中,28℃,150 r/min摇床培养,在前一个试验确定的最佳培养时间时测其OD600值,重复3次(王彦波,2009;于明超等,2007;周德庆,2002)。
1.2.3 温度对菌株ESB3生长的影响 取菌株ESB3培养24 h的肉汤培养液5 mL,接种于装有50 mL,前面试验确定的最佳初始pH的肉汤培养液的250 mL三角瓶中,150 r/min摇床培养,培养温度分别为 23、28、30、32、37 ℃和 42 ℃, 在第一个试验确定的最佳培养时间时测其OD600值,重复3次 (李术娜等,2009;罗璋等,2007;刘燕,2006;刘莹等,2006)。
1.2.4 盐度对菌株ESB3生长的影响 取菌株ESB3培养24 h的肉汤培养液5 mL,接种于装有50 mL,前面试验确定的最佳初始pH的肉汤培养液的250 mL三角瓶中,培养液其他成分不变,Na-Cl浓度(m/V)分别为 0、0.5%、1%、1.5%、2%、2.5%,150 r/min摇床培养,培养温度为前面试验确定的生长最适温度,在第一个试验确定的最佳培养时间时测其OD600值,重复3次 (王彦波,2009)。
1.2.5 转速对菌株ESB3生长的影响 取菌株ESB3培养24 h的肉汤培养液5 mL,接种于装有50 mL,前面试验确定的最佳初始pH、最佳盐度的肉汤培养液的250 mL三角瓶中,培养温度为前面试验确定的生长最适温度,摇床培养,转速分别为 130、150、170、190 r/min 和 210 r/min, 在第一个试验确定的最佳培养时间时测其OD600值,重复 3 次(罗璋等,2007)。
1.2.6 不同碳源、氮源、无机盐源对菌株ESB3生长的影响 选择不同的碳源(葡萄糖、蔗糖、乳糖、可溶性淀粉)添加到基础培养基中,使含量为1%(m/V), 基 础 培 养 基 配 方 :(NH4)2SO42.0 g,NaH2PO4·H2O 0.5 g,K2HPO40.5 g,MgSO4·7H2O 0.6 g,CaCl2·2H2O 0.1 g,蒸馏水 1000 mL;选择不同的氮源(蛋白胨、胰蛋白胨、酵母膏、牛肉浸膏和硝酸铵)添加到基础培养基中,使含量为1.5%(m/V), 基础培养基配方:K2HPO41.36 g,MgSO4·7H2O 0.2 g,NaH2PO42.13 g,FeSO4·7H2O 0.5 g,CaCl20.5 g,蒸馏水1000 mL;选择不同的无机盐(NaCl、CaCl2、MgSO4、FeSO4和 K2HPO4) 替代牛肉膏蛋白胨培养基中的NaCl,使含量为0.5%(m/V)。三个单因子试验培养条件均为前面试验确定的最佳条件,在最佳培养时间时用稀释平板计数法测定发酵液中的活菌数,重复3次 (刘莹等,2006;罗璋等,2007;周德庆,2002;Qi等,2009)。
1.2.7 L9(34)正交试验 以单因子试验最适碳源的3个浓度1%、1.5%、2%(m/V), 氮源的 3个浓度1%、2%、3%(m/V), 无机盐的 3个浓度0.3%、0.5%、0.7%(m/V)设计正交试验。以单因子试验确定的最佳培养条件培养,稀释平板计数各发酵液活菌数(刘莹等,2006;罗璋等,2007;周德庆,2002;Qi等,2009)。
2 结果与讨论
2.1 培养条件优化结果
2.1.1 培养时间对菌株ESB3生长影响 结果见图1。接种后6 h之前,细菌活菌数几乎无变化,属于生长曲线延滞期,从6~20 h细菌活菌数急剧上升,属于生长曲线指数期,从20~36 h细菌活菌数波动很小,属于生长稳定期。36 h后细菌活菌数开始下降,属于衰亡期。20 h为指数期和稳定期的转折点,这个时间点上的培养物浓度高,子代培养物的延滞期也短,所以菌株ESB3的最佳发酵时间为20 h。

图1 培养时间对菌株ESB3生长影响
2.1.2 初始pH值对地衣芽孢杆菌ESB3菌株生长的影响 结果见图2。pH主要是影响菌体细胞膜电荷状况,引起膜渗透性的变化以及影响营养物离子化程度,从而影响菌体对养分的吸收。pH 7.2、7.5、7.8 的 OD600值显著高于 pH 8.1、9.0 (P <0.05),高于 pH 6.3、6.6、6.9,但差异不显著(P >0.05),综合显著性差异分析,菌株ESB3生长最适pH为7.8。
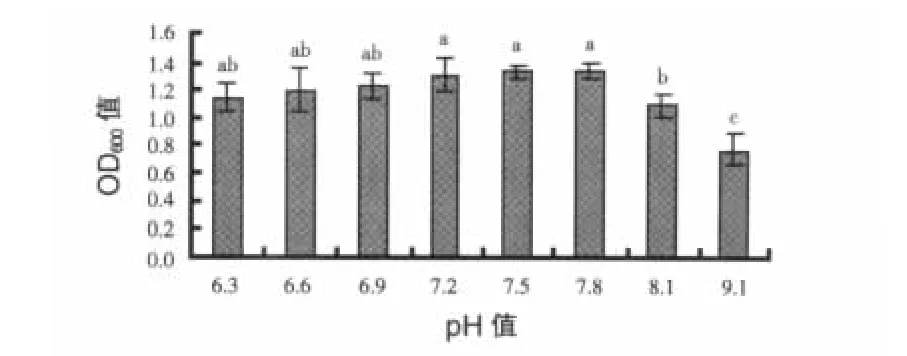
图2 初始pH值对菌株ESB3生长的影响
2.1.3 温度对地衣芽孢杆菌ESB3生长的影响结果见图3。温度主要通过改变酶反应速率来影响菌体的生长。一般培养基温度升高,酶反应速率增大,生长代谢加快,生产期提前。但酶本身很容易因过热而失去活性,表现为菌体容易衰老,影响最终产量(Saarela等,2000)。本试验中23~30℃时,地衣芽孢杆菌ESB3的生长随温度升高而上升,而30~42℃时,则随温度上升而下降。综合显著性差异分析,地衣芽孢杆菌ESB3的最适生长温度为30℃。
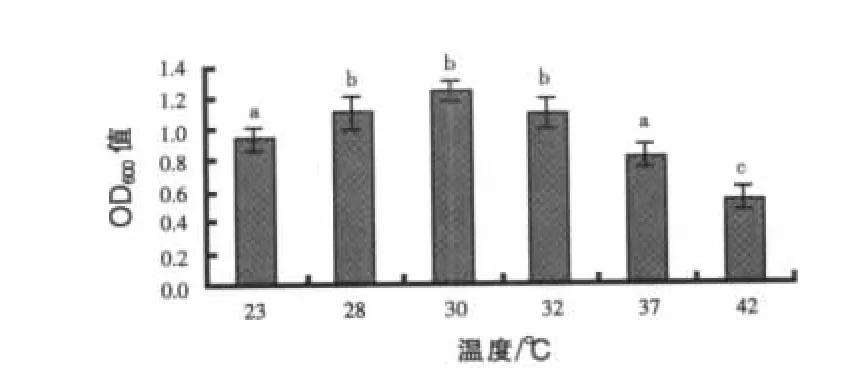
图3 培养温度对菌株ESB3生长的影响
2.1.4 盐度对地衣芽孢杆菌ESB3生长的影响结果见图4。无机盐的营养功能十分重要,可以作为细胞内一般分子成分,也可以调节渗透压、稳定pH和作为酶的激活剂 (Verschuere等,2000)。NaCl是最常用的无机盐。0%、0.5%、1%、1.5%、2%浓度组的OD600值无显著差异 (P>0.05),但2%的盐度下OD600值已经有下降的趋势,而2.5%组 OD600值显著变小(P<0.05)。 这表示NaCl含量由0%~1.5%,盐度变化对生长无明显作用,而当大于1.5%时生长变缓。地衣芽孢杆菌ESB3的适宜培养盐度为1.5%以下,最适盐度为1.5%。这一结果与中华绒螯生活的环境情况相符。
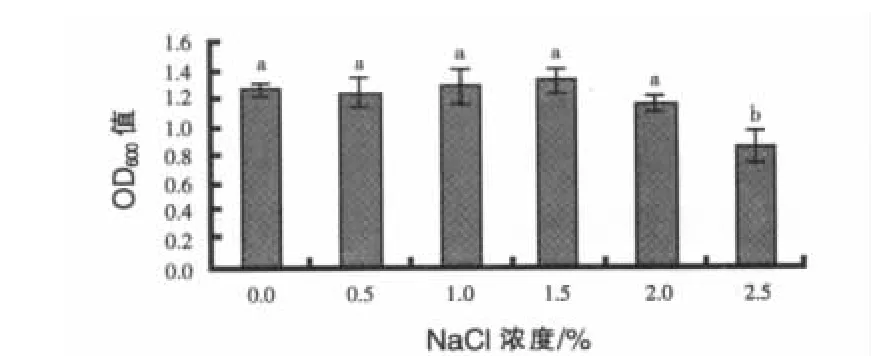
图4 盐度对菌株ESB3生长的影响
2.1.5 转速大小对地衣芽孢ESB3菌株生长的影响 结果见图5。转速在190 r/min时,OD600值显著高于 130、150、210 r/min(P < 0.05),好于 170 r/min,但差异不显著(P>0.05)。菌株ESB3的最适培养转速为190 r/min。
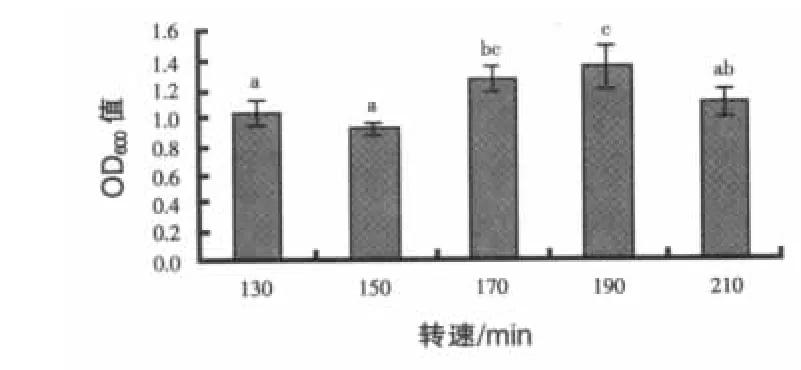
图5 转速对菌株ESB3生长的影响
2.2 最适种子培养基研究结果 不同碳源对ESB3生长的影响:结果见表1。以可溶性淀粉为碳源时,培养液活菌数最大为8.01×108CFU/mL,显著高于其他组 (P<0.05),组间极差为5.94×108。
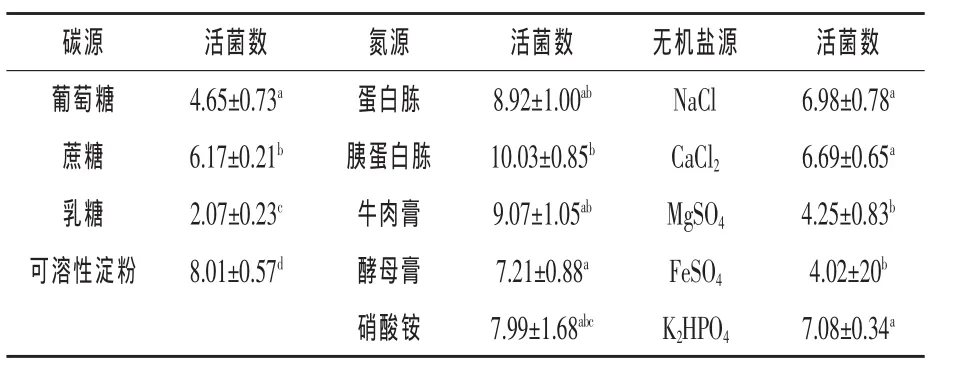
表1 碳源、氮源、无机盐选择试验结果×108CFU/mL
不同氮源对ESB3生长的影响:结果见表1。以胰蛋白胨为氮源时,培养液活菌数最大为10.03×108CFU/mL,显著高于酵母膏和硝酸铵组(P<0.05),好于蛋白胨和牛肉膏组,但差异不显著(P > 0.05),组间极差为 2.82×108。
不同无机盐源对ESB3生长的影响:结果见表1。以K2HPO4为无机盐源时,培养液活菌数最大为7.08×108CFU/mL。K2HPO4组显著高于Mg-SO4、 FeSO4组(P < 0.05),好于 NaCl、CaCl2组,但无显著差异,组间极差为3.06×108。
L9(34)正交试验:结果见表 2。 3 因素的极差大小为 K2HPO4(1.84)>可溶性淀粉(1.64)>胰蛋白胨(1.43)。极差越大,反映该因素水平变动时,总指标变化越大,也就是该指标对综合指标的影响越大。本试验条件下较好的因素搭配水平为可溶性淀粉(2%)、胰蛋白胨(2%)、K2HPO4(0.3%),此时培养液细菌浓度可达11.09×108CFU/mL。

表2 正交试验结果×108CFU/mL
3 小结
本研究结果表明,地衣芽孢杆菌ESB3在本试验条件下的最适发酵时间为20 h,生长的适宜初始pH为7.2~7.8,最适pH为7.8,最适生长温度为30℃,适宜培养盐度为1.5%以下,最适盐度为1.5%,最适转速为190 r/min。
单因子试验表明,地衣芽孢杆菌ESB3在本试验条件下的最适碳源、氮源和无机盐分别为可溶性淀粉、胰蛋白胨和 K2HPO4。L9(34)正交试验表明:可溶性淀粉(2%)(m/V)、胰蛋白胨(2%)(m/V)、K2HPO4(0.3%)(m/V)时地衣芽孢杆菌 ESB3活菌数最高,达 11.09×108CFU/mL。
[1]李术娜,王树香,王占利,等.大丽轮枝菌拮抗细菌B.subtilis LZ2-70产芽孢条件优化[J].棉花学报,2009,21(4):307 ~ 312.
[2]刘燕.猪益生性芽孢杆菌的筛选与特性研究:[硕士学位论文][D].北京:中国农业科学院,2006.
[3]刘莹,孙云丹,杨翔华,等.地衣芽孢杆菌LNPU-1发酵条件研究及培养基优化[J].食品科技,2006,8:28 ~ 31.
[4]罗璋,陈昌福,白晓慧,等.枯草芽孢杆菌BHI344培养条件的优化[J].中国饲料,2007,10:41 ~ 43.
[5]王彦波.池塘芽孢杆菌的筛选、鉴定和生长特性研究[J].水生态学杂志,2009,2(1):91 ~ 94.
[6]于明超,李卓佳,文国樑.芽孢杆菌在水产养殖应用中的研究进展[J].广东农业科学,2007,11:78 ~ 81.
[7]周德庆.微生物学教程(第二版)[M].北京:高等教育出版社,2002.
[8]Qi Z Z,Zhang X H,Boon N,et al.Probiotics in aquaculture of China-Current state,problems and prospect[J].Aquaculture,2009,290:15 ~ 21.
[9]Saarela M,Mogensen G,Fonden R,et al.Probiotic bacteria:safety,functional and technological properties[J].J Biotech,2000,84:197 ~ 215.
[10]Verschuere L,Rombaut G,Sorgeloos P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiol Mol Biol Rev,2000,64:655 ~ 671.
