车前子不同炮制品多糖含量测定
2010-04-25,,,
,,,
(1.温州市第三人民医院,浙江 温州 325000;2.温州医学院 仁济学院,浙江 温州 325035)
《中国药典》[1]记载,车前子为车前科植物车前PlantagoasiaticaL.或平车前PlantagodepressaWilld.的干燥成熟种子, 具有清热利尿、渗湿通淋、明目、祛痰的功能,用于治疗水肿胀满、热淋涩痛、暑湿泄泻、目赤肿痛、痰热咳嗽。在临床上可治各种病症[2]。目前,国内外对车前子多糖的研究表明,车前子多糖具有抗炎、缓泄、抗衰老、抗氧化、清除自由基、保护动脉内皮、整肠通便、降低血脂、调节血糖的作用[3-11]。车前子多糖的主要组成单糖是木糖和阿拉伯糖等戊糖[12],殷军艺等[13]对大粒车前子多糖分离、纯化及单糖组成分析的研究中,经GC-MS分析确定PLP由阿拉伯糖、木糖、甘露糖和半乳糖构成,其摩尔比为5.6∶9.4∶1.3∶1,但文献报道中车前子多糖测定通常都是以己糖(如葡萄糖)作为标准对照品。所以本实验采用周超等[14]在研究中建立的一种准确测定车前子多糖的方法,即采用苯酚-硫酸法测定车前子中多糖量,以木糖作为标准对照物,检测波长480 nm,希望更准确地测定车前子中多糖的含量。为在选用车前子的不同炮制品时,提供量的参考。
1 实验部分
1.1 实验材料 751-GW分光光度计(惠普上海分析仪器有限公司),80-2离心机(上海手术器械厂),隔膜真空泵(天津市津藤实验设备有限公司),单相电容运转电动机(上海申生科技有限公司),美的多功能电磁炉(广东美的生活电器制造有限公司),万用电热器(浙江嘉兴市风桥电热器厂制造),分析天平,冰箱,透析袋,回流装置,容量瓶(25、100 mL),移液管(0.5、1、5 mL),离心管,烧杯,玻璃棒;D-木糖,80%,95%乙醇,无水乙醇,丙酮,乙醚,氯仿-正丁醇(4∶1),3%苯酚,浓硫酸,蒸馏水,自来水;车前子,自然晒干。
1.2 实验方法
1.2.1 车前子的炮制 历史沿革:宋代有酒浸(《总录》)、微炒(《局方》)、焙(《宝产》)、酒蒸(《济生方》)等炮制方法。明代还有米泔水浸蒸(《醒斋》)的方法。清代又增加了青盐水(《幼幼集成》)。并有“酒蒸捣碎,入滋补药;炒研,入利水泄泻药”(《备要》)的记载。现在主要的炮制方法有炒黄、盐炙等。生品车前子:取车前子,除杂质,筛去灰屑。清炒车前子:取净车前子,置炒制容器内,用文火加热,炒至略有爆声,并有香气逸出时,取出晾凉。盐炙车前子:取净车前子,置炒制容器内,用文火加热,炒至略有爆鸣声时,喷淋盐水,炒干,取出晾凉。
1.2.2 车前子多糖的提取与精制 称取干燥的生品车前子50 g,加8倍量体积分数80%乙醇浸泡24 h,过滤,挥干乙醇,加水于沸水浴中回流提取3 h,纱布两层过滤,滤渣再回流提取2 h,合并滤液,浓缩,加95%乙醇至醇浓度达到80%,冰箱中冷藏过夜。次日离心分离(4 000 r/min,10 min),沉淀依次用无水乙醇、丙酮、乙醚洗涤两次,干燥得生品车前子粗多糖,称量。做2分,其中1分精制,备用。生品车前子粗多糖用蒸馏水溶解,Seva ge法除蛋白[15],然后用流动自来水透析48 h,蒸馏水透析24 h,透析液浓缩,加95%乙醇至醇浓度达到80%,冰箱中冷藏过夜。次日离心分离(4 000 r/min,10 min),沉淀依次用无水乙醇、丙酮、乙醚洗涤2次,干燥得生品车前子精多糖,称量。
1.2.3 标准曲线的绘制 准确称取干燥至恒量的D-木糖标准品25.10 mg,置于100 mL容量瓶中,加蒸馏水配成0.251 0 mg/mL的溶液。准确移取此溶液0.5,1.0,1.5,2.0,2.5,3.0,3.5 mL,分别置于25 mL容量瓶中,稀释至刻度,配成系列标准溶液,浓度为0.005,0.010,0.015,0.020,0.025,0.030,0.035 mg/mL。最佳显色条件:在上述配制的系列溶液中分别取2.0 mL,加3%苯酚0.5 mL,摇匀后加浓硫酸4.0 mL,充分混合均匀,25℃室温放置35 min,在480 nm处测量吸光度。
1.2.4 换算因子的测定 精密称取生品车前子的精制多糖0.030 0 g,配制成0.03 mg/mL,按照1.2.3确定的最佳显色条件,由回归方程求出生品车前子精制多糖液中木糖的浓度。按下式计算换算因子f=m/(C·D)。式中:m-称取精制多糖的质量(mg),C-精制车前子多糖中木糖的质量浓度(mg/mL),D-多糖的稀释因素(mL)。
1.2.5 样品中车前子多糖的测定 精密称取生品车前子粗多糖0.030 0 g,配制成0.03 mg/mL,按照1.2.3确定的最佳显色条件,由回归方程求出生品车前子精制多糖液中木糖的浓度。按下式计算样品中多糖的量:W/%=C·D·f/m×100。式中:C-供试液中木糖的浓度(mg/mL),D-多糖的稀释因素,f-换算因子,m-供试车前子多糖的质量(mg)。清炒和盐炙的车前子粗多糖都作同等条件的处理,分别得出相应的多糖含量。
2 结果
2.1 标准曲线 在确定的最佳显色条件下测定吸光度,以吸光度(A)对木糖浓度(C)作回归处理,得回归方程:C=0.030 3 A-0.000 7,R=0.999 6。木糖标准品在0~0.035 mg/mL范围内呈良好线性关系。
2.2 换算因子 经过对精制车前子多糖吸光度的测定,并计算后,求得车前子多糖相对于D-木糖的换算因子:f=1.571。
2.3 多糖含量 经过对粗品车前子不同炮制品的吸光度测定,由回归方程求出相应的车前子精制多糖液中木糖的浓度,并通过计算,得出结果。如表1。

表1 车前子不同炮制品多糖含量测定结果
2.4 精密度试验 准确移取0.03 mg/mL粗多糖样品溶液2 mL,按照1.2.3确定的最佳显色条件,平行测定5份。相对标准偏差RSD=0.98%。
2.5 稳定性试验 准确移取0.03 mg/mL粗多糖样品溶液2 mL,按照1.2.3确定的最佳显色条件,间隔15 min读取显色后的样品溶液吸光度,连续1 h考察其稳定性。相对标准偏差RSD=0.44%。
2.6 加标回收率 准确移取0.03 mg/mL粗多糖样品溶液2 mL,加入不同浓度的木糖标准溶液各1 mL,按照1.2.3确定的最佳显色条件,计算回收率(平行测定2次)。结果见表2。
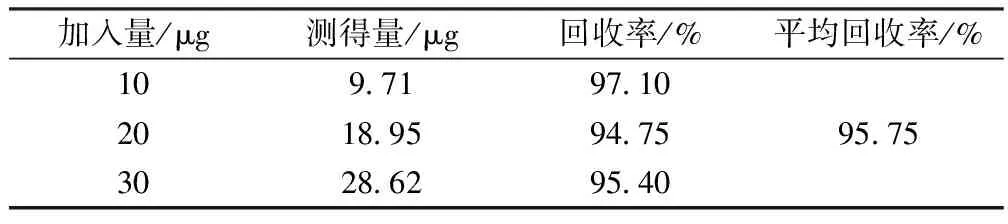
表2 加标回收率测定结果
3 讨论
本次实验测定车前子多糖含量采用苯酚-硫酸法,检测波长为480 nm,由于车前子多糖的主要组成单糖是木糖和阿拉伯糖等戊糖[12],所以本实验以D-木糖作为标准对照品,这与以往文献报道中车前子多糖测定通常都是以己糖(如葡萄糖)作为标准对照品所不同,利用D-木糖与精制多糖的换算因子计算多糖量,得出的结果更能准确地反映其真实值。
通过对车前子不同炮制品多糖含量的测定,不难发现炮制后的车前子多糖含量较生品均降低,王东等[16]对车前子及其炮制品中多糖含量的分析研究结果中表明,3种车前子炮制品,无论是清炒还是盐炙,其多糖含量较生品都有所降低,与本实验结果相符。
[1]中华人民共和国卫生部药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出社,2005:46.
[2]蒋琴芳.车前子临床应用偶拾[J].吉林中医药,2005,25(10):51-52.
[3]谢小梅,付志红.车前子多糖对小鼠阴道菌群失调的调整作用[J].辽宁中医药,2006,33(2):241-242.
[4]吴光杰,田颖刚,谢明勇,等.车前子多糖对便秘模型小鼠通便作用的研究[J].食品科学,2007,28(10):514-516.
[5]王东,袁昌鲁,林力,等.车前子多糖对小肠运动障碍小鼠的影响[J].中华中医药学刊,2008,26(6):1188-1189.
[6]李红,张美玲,张兆芳,等.车前子粗多糖胶囊治疗功能性便秘45例疗效观察[J].中国中医药信息杂志,2007,14(9):74-75.
[7]唐永富,黄丹菲,殷军艺,等,车前子多糖对骨髓来源树突状细胞表型和吞噬功能的影响[J].食品科学,2007,28(10):517-520.
[8]袁从英,熊晨,郭会彩,等.车前子多糖抗脂质过氧化作用的研究[J].中国老年学杂志,2009,29:1202.
[9]王素敏,黎燕峰,代洪燕,等.车前子调整脂代谢及其抗氧化作用[J].中国临床康复,2005,9(31):248-250.
[10]Tomoda M,Yokoi M,Ishikawa K.Isolation and characterization of a mucous polysaccharide, "Plantago2mucilage A"from the seeds of plantago major var.asiatica.Chem Phar Bull,1981,29(10):2877-2884.
[11]付志红,谢明勇,聂少平.微波技术用于车前子多糖的提取[J].食品科学,2005,26(3):151.
[12]Fischer MH,Yu N,Gray GR et al.Carbohy drate Research,2004,339:2009.
[13]殷军艺,聂少平.大粒车前子多糖分离、纯化及单糖组成分析[J].食品科学,2008,28(9):29-5325.
[14]周超,谢明勇,万茵,等.车前子多糖的测定方法研究[J].分析实验室,2008,27(4):58.
[15]陈伟,林新华,黄丽英,等.芦荟多糖中游离蛋白去除的分光光度法[J].光谱实验室,2005,22(1):114.
[16]王东,林力,袁昌鲁,等.车前子及其炮制品中多糖含量的分析[J].时珍国医国药,2002,13(4):198.
