金属离子掺杂对LiFePO4结构和性能的影响
2010-04-21陶兴华唐致远
陶兴华, 唐致远
(天津大学化工学院应用化学系,天津 300072)
汽车工业的迅速发展,推动了全球机械、能源、交通等工业的进步和发展,但燃油汽车在造福人类的同时,尾气排放也给人类居住环境造成了严重污染。据统计,目前大气污染成分的63%来自燃油汽车,已达到了必须加以严格控制和治理的程度。能源短缺和环保的要求推动了电动汽车(EV)及混合动力汽车(HEV)[1]的发展,它们对锂离子电池有着特殊的性能要求,但目前商品化的锂离子电池还不能满足大规模应用的要求。磷酸铁锂正极材料由于其出众的安全性和便宜的价格等优点,在动力型电池应用方面具有非常诱人的前景,被认为是标志着“锂离子电池一个新时代的到来”[2]。
LiFePO4大规模应用最大的障碍是其离子传导率和电子传导率比较低,导致大电流放电性能比较差。目前改善LiFePO4导电性能的研究主要集中在碳包覆[3-5]及金属粒子掺杂[6]两方面。对材料进行碳包覆能在晶粒表面形成碳包覆层,提高电子电导率,阻止晶粒长大,但是这种表面修饰工艺不能从根本上改善材料的结构[6-7],阻碍了LiFePO4性能的进一步提高。对材料进行离子掺杂,通过高价离子取代LiFePO4晶格中的部分Fe2+,改变晶格中局域能级,降低锂离子在晶格中扩散的能垒,从而提高LiFePO4的电化学性能[8-10]。本文采用不同的金属氧化物(TiO2,V2O5,Nb2O5)作掺杂前驱体,合成了高价金属离子掺杂的LiFePO4/C复合材料,通过XRD、循环伏安和恒流充放电测试,分析了掺杂离子种类对材料结构和电化学性能的影响。
1 实验
按化学计量比准确称量LiH2PO4,FeC2O4·2 H2O和适量葡萄糖,加入5%(金属离子摩尔比)的金属氧化物(TiO2,V2O5,Nb2O5)。再加入适量无水乙醇,用玛瑙研钵进行湿磨。待样品混合均匀后,80℃真空干燥2 h,在氮气气氛下300℃预烧6 h,冷却后研磨2 h,然后在氮气气氛中700℃焙烧16 h,冷却充分研磨后备用 (掺杂Ti4+、V5+、Nb5+的样品分别标记为LFTP、LFVP、LFNP)。以制备的样品为正极材料,活性物质、导电炭黑和PTFE按质量比85∶10∶5混合均匀涂敷在直径约12mm铝箔上,压制成片,120℃真空干燥6 h。然后转入手套箱以金属锂片为负极,聚丙烯微孔膜(Celgard 2300)作为隔膜,以1mol/L LiPF6/[碳酸乙烯酯(EC)+碳酸二乙酯(DEC)+碳酸二甲酯(DMC)](体积比1∶1∶1)的混合溶液为电解液,制备2032型扣式电池。
采用武汉力兴电池程控测试仪进行恒流充放电测试,电压范围2.5~4.0 V。交流阻抗(EIS)和循环伏安(CV)测试在Gam ry电化学工作站上进行,其中EIS的频率范围为0.5 Hz~100 kHz,CV的电压范围为2.5~4.2 V,扫速0.1mV/s。XRD表征采用日本理学电机D/Max-2500自动X射线衍射仪,Cu 靶 (λ=0.154 056 nm),石墨单色器,40 kV,40mA,扫描步长0.2°,扫描范围10°~80°。
2 结果与讨论
2.1 掺杂不同离子对物相结构的影响
图1所示为掺杂不同金属离子LiFePO4/C复合材料的X射线衍射谱。由于金属离子的掺杂量比较小,并以固熔体的形式存在,没有改变LiFePO4的晶格结构,所以这四种样品与LiFePO4的标准XRD谱晶体结构相同,均有尖锐的衍射峰,且均按正交晶系D2h16,pmnb空间群指标化,没有出现杂质峰。
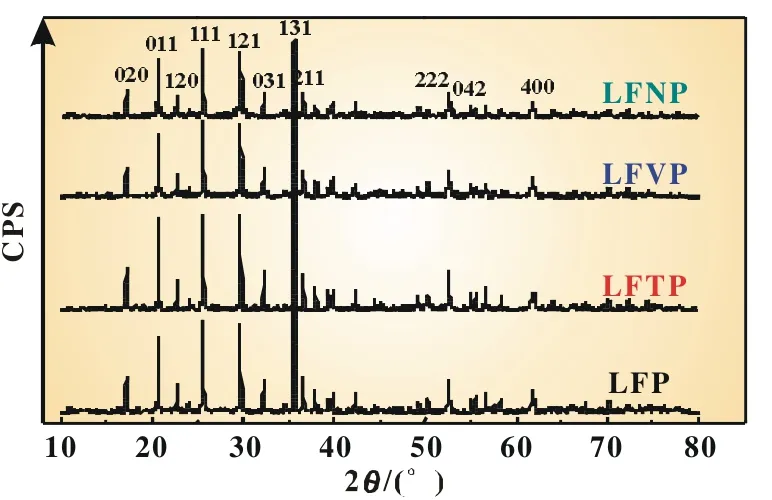
图1 掺杂不同离子LiFePO4/C样品的XRD谱图
从表1的数据可以看出,虽然特征峰出现的角度和晶格参数变化不大,但掺杂不同金属离子的LiFePO4/C样品的XRD图谱中次强峰强度I111与主特征峰强度I131的比值都发生了变化,其中掺杂Nb5+离子的LiFePO4/C样品I111/I131值达到了0.893,明显高于未掺杂金属离子的LFP样品,该现象与早期报道一致[11]。

表1 掺杂不同金属离子LiFePO/C晶格参数及特征峰强度比
2.2 掺杂不同离子对电化学性能的影响
图2是不同金属离子掺杂的LiFePO4/C复合材料0.05C首次放电比容量曲线。高价金属离子的掺杂显著提高了首次放电比容量,其中掺杂Nb5+改善最明显,为154mAh/g,达到了理论比容量的91%;掺杂Ti4+和V5+的LiFePO4比容量都提高到133mAh/g左右。

图2 不同金属离子掺杂LiFePO4/C材料首次放电比容量
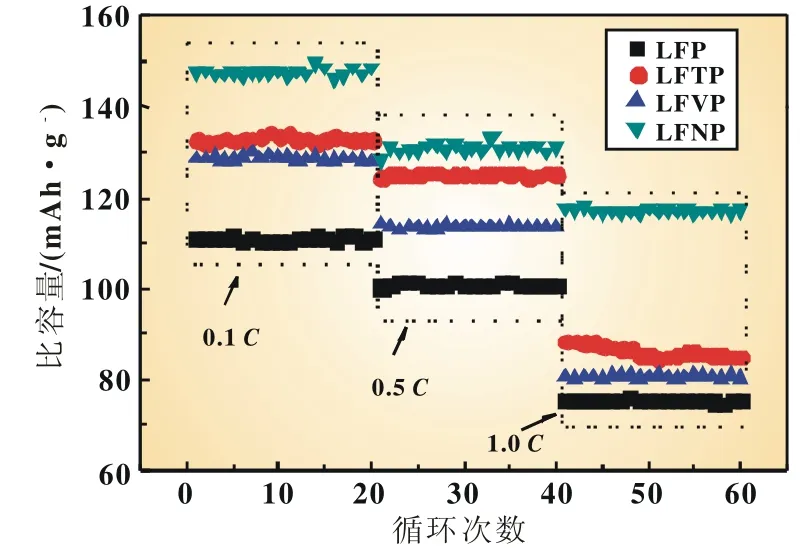
图3 不同金属离子掺杂LiFePO4/C材料循环性能曲线
图3给出了不同离子掺杂的LiFePO4/C复合材料在不同倍率下循环性能曲线,与未掺杂的LiFePO4/C相比,各种掺杂的LiFePO4/C都表现了较高的首次放电比容量和容量保持率。其中Nb5+在低倍率和高倍率下均表现出优异的循环性能,0.1C比容量保持在148mAh/g,甚至在1C倍率下,经过60次循环比容量依然保持在117mAh/g左右。掺杂Ti4+和V5+在0.1C倍率下对LiFePO4/C的性能改善效果明显,分别从未掺杂的111mAh/g提高到133mAh/g和128mAh/g;而在0.5C倍率下,掺杂Ti4+的效果明显好于V5+,保持比容量从未掺杂的100mAh/g提高到125mAh/g,掺杂V5+仅为113mAh/g;但随着放电倍率进一步提高,两者放电比容量均接近于未掺杂的LiFePO4/C材料,说明掺杂Ti4+和V5+离子对高倍率循环性能的改善效果不明显。
尽管金属离子掺杂后,LiFePO4/C的电化学性能都得到了提高,然而提高的程度却各不相同,显然这与掺杂离子的本性有关。少量高价金属离子进入LiFePO4的晶格中,改变了阳离子的外层电子能量分布,减弱Fe-O键,降低锂离子在晶格中移动的能垒,提高锂离子迁移数和电子导电性,从而使LiFe-PO4/C材料的电化学性能得到提高。在这个过程中,金属离子的半径和价态是影响掺杂效果的关键因素。在Ti4+、V5+和Nb5+三种金属离子中,Nb5+(0.069 nm)和Ti4+(0.060 5 nm)具有与Fe2+(0.064 5 nm)最接近的离子半径,V5+的半径为0.059 nm。显然,具有+5价的高价态和接近Fe2+半径的Nb5+应该具有更好的掺杂效果。此外,掺杂Ti4+对循环性能的影响大于V5+,可能是由于离子半径对晶格结构影响大于价态的影响,如果掺杂离子半径和Fe2+的半径差距太大,不能有效嵌入晶格,即使具有较高的价态也不能很好减弱Fe2+附近电子的束缚程度。
为了进一步研究高价金属离子掺杂对循环性能的影响,我们对不同离子掺杂的LiFePO4进行了循环伏安测试,如图4所示。在2.5~4.2 V窗口内,出现一对氧化还原峰,峰值距离和峰面积可以表征LiFePO4的脱嵌锂反应的可逆程度。从图中可以看出,掺杂Nb5+的LiFePO4/C材料氧化峰和还原峰的峰值分别为3.565 V和3.311 V,距离较小,且峰面积相比另外两条曲线小,表明掺杂Nb5+的LiFePO4/C应该具有更好的循环性能;掺杂Ti4+的LiFePO4/C材料CV曲线在还原峰值、峰面积均优于掺杂V5+,应该具有相对较好的循环性能,这也进一步验证了充放电性能测试的结果。
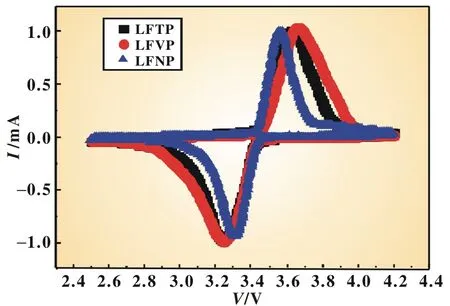
图4 不同离子掺杂LiFePO4/C材料循环伏安曲线
3 结论
用金属氧化物(TiO2,V2O5,Nb2O5)作前驱体,高温固相法合成了掺杂不同金属离子的LiFePO4/C复合材料,结果表明三种金属离子掺杂均能提高LiFePO4/C的电化学性能,其中以Nb5+离子效果最明显,在0.05C倍率下首次放电比容量达到154mAh/g,即使在1C倍率下放电,经过60次循环依然能保持在117mAh/g左右。Fe位掺杂的效果和掺杂离子的半径、价态有密切关系,并且半径和Fe2+离子越接近、价态越高,掺杂后的LiFePO4/C复合材料电化学性能越好。
[1] LARM INIE J,LOWRY J.Electric vehicle technology explained[M].Queensland:JohnWiley&SonsAustralia Ltd,2003:1-20.
[2] 倪江锋,苏光耀,周恒辉,等.锂离子电池正极材料LiMPO4的研究进展[J].化学进展,2004,6(4):554-560.
[3]HUANG H,YIN SC,NAZAR L F.Approaching theoretical capacity of LiFePO4at room temperature at high rates[J].Electrochem ical and Solid-State Letters,2001,4(1):A170-A172.
[4]TAKAHASHIM,TOBISHIMA S,TAKEIK,et al.Characterization of LiFePO4as the cathodematerial for rechargeable lithium batteries[J].Journalof Power Source,2001,97/98:508-511.
[5]CHEN Z,DAHN JR.Reducing carbon in LiFePO4/C composite electrodes tomaximize specific energy,volumetric energy and tap density[J].Journal of the Electrochem ical Society,2002,149(9):A1184-A1189.
[6]CHEN Y,WANG Z L,YU C Y,etal.Electrochem ical properties of Mo-doped LiFePO4cathode material[J].Acta Physico-Chimica Sinica,2008,24(8):1498-1502.
[7]WANG G X,BEWLAY S L,KONSTAN TINOV K,et al.Physical and electrochemicalpropertiesof doped lithium iron phosphate electrodes[J].Electrochem ical Acta,2004,50:443.
[8]CHUNG SY,BLOKING JT,CHIANG YM.Electronically conductive phosphor-olivines as lithium storage electrodes[J].Naturematerials,2002,1(2):123-128.
[9]PENAZZIN,ARRABITOM,PIANAM,eta1.M ixed lithium phosphates as cathode materials for Li-ion cells[J].Euro Ceram Soc,2004,24(6):A1381-A1384.
[10]WANGD Y,LIH,SHISQ,eta1.Improving the rate performance of LiFePO4by Fe-site doping[J].Electrochem ical Acta,2005,50(14):2955-2958.
[11] 倪江锋,周恒辉,陈继涛,等.铬离子掺杂对LiFePO4电化学性能的影响[J].物理化学学报,2004,20(6):582-586.
