硒对公猪精液品质的影响及其机理
2010-04-17方正锋车练强
钟 铭 吴 德* 方正锋 车练强 林 燕
(1.四川农业大学动物营养研究所,雅安 625014;2.动物抗病营养教育部重点实验室,雅安 625014)
公猪对群体的繁殖力有着重要的影响,然而在实际生产中却是容易忽视的群体。在公猪的营养需要方面,M ark等[1]认为确定对精子发生有害或有益的“特殊营养因子”比确定公猪的饲粮营养需要更为重要。硒是动物机体必需的微量元素之一,在生物体内参与重要的生理活动,是谷胱甘肽过氧化物酶的重要组成成分,能消除机体内产生的自由基。对雄性动物的研究已发现,动物体内的代谢过程产生过多的自由基是导致动物不育的主要因素[2]。由此可见,硒与雄性动物的繁殖性能有着重要联系。本文就硒对种公猪精液品质影响及其机理研究进展做一综述。
1 硒对公猪精液品质的影响
Jacyno等[3]用不同形式的硒[亚硒酸钠(Na2SeO3)和酵母硒]+维生素E饲粮饲喂70日龄的公猪,到180日龄时开始采精,测定其精液品质。结果发现,硒的添加形式和水平对精液体积没有显著影响,而含硒0.2 mg/kg的酵母硒组的精子密度、总数及渗透阻力(ORT)显著高于含硒0.2 mg/kg的Na2SeO3组。Kolodziej等[4]发现,含硒0.5 m g/kg的Na2SeO3组公猪的精液品质较好,精浆中天冬氨酸转氨酶(AspAT)的活性最低,表明AspAT很少从精细胞渗到精浆中,精细胞膜受损较少。因此,硒对保证精子细胞膜的完整性有着重要作用。Segerson等[5]从公猪78日龄开始饲喂低硒饲粮,试验组每14 d注射1次Na2SeO3(0.33mg/kg BW),对照组每14 d注射1次同剂量生理盐水,230日龄开始采精,发现注射硒制剂的公猪精液精子数比对照组高,但精子活力没有显著变化。然而,M arin-Guzman等[6-7]研究表明,硒对公猪精子活力和畸形率有着重要的影响。饲粮含硒0.5 mg/kg的Na2 SeO3组公猪精子中ATP浓度比未添加组高25%[6],精子活力、正常精子数分别是未添加组的1.46、2.56倍[7];同时公猪28日龄断奶到18月龄期间饲粮添加硒更有利于精液品质的提高。Fernandez等[8]也认为在0~0.5 mg/kg的硒添加范围内,随着饲粮中硒浓度的增加,精子活力和精子密度也随之提高。M ahan[9]研究发现,供给公猪强化硒饲粮,其正常精子率为62%,而低硒饲粮组的正常精子率仅为25%。M arin-Guzman等[6]观察了硒缺乏组和0.5 m g/kg硒添加组公猪精子的超微结构,发现硒缺乏组精子尾部中段的线粒体呈椭圆形,排列松散,细胞膜部分破损,导致精子出现断尾现象(图1)。
母猪受孕率是反映精液品质好坏最直观的指标。M arin-Guzman等[7]分别用来自低硒组、硒强化组公猪的精液使发情母猪受孕,受孕后5~7 d将其屠宰,发现低硒组游向卵母细胞的精子数量较少。这与Fernandez等[8]的报道一致。
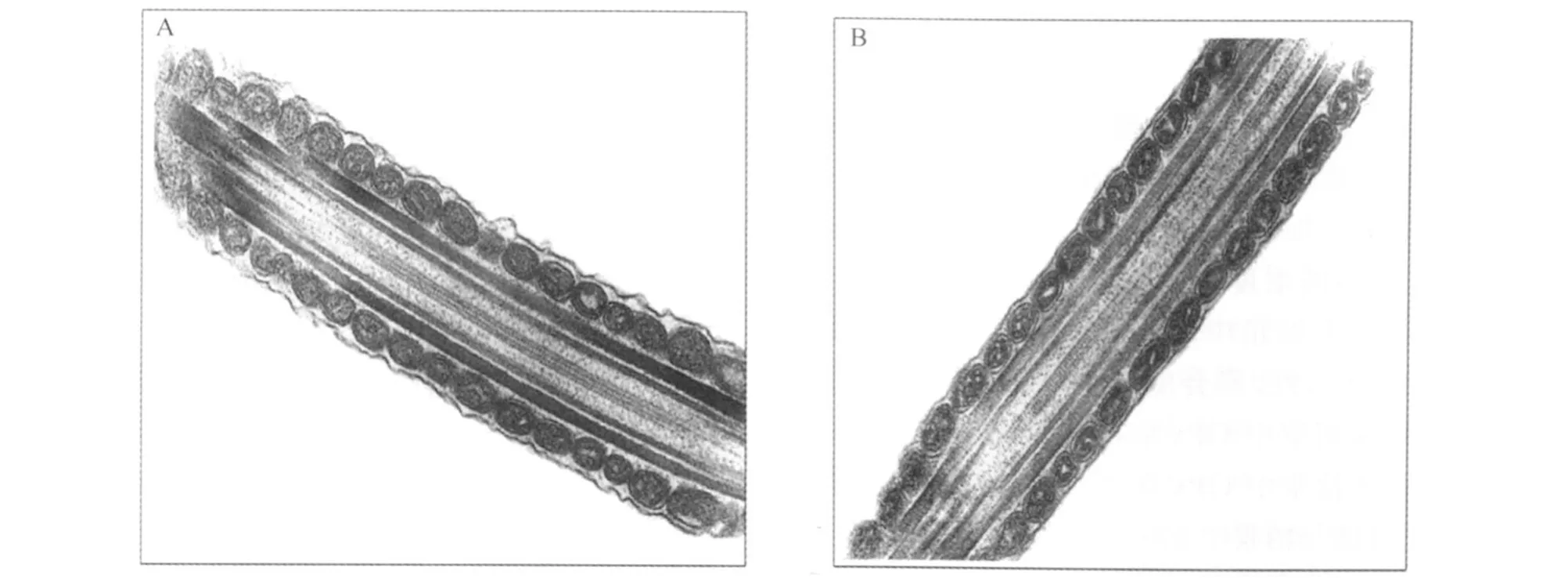
图1 公猪精子鞭毛中段纵向切片的电子显微照片(90 K)Fig.1 Transm ission electron m icrographs(90 K)of longitudinal sec tions of flagellar m idpiece of boar spermatozoa
由以上的研究结果可以看出,硒对公猪精液品质尤其在精子密度、精子活力、精子正常形态方面起着积极的作用。公猪饲粮中不适宜的硒添加水平,使得精子膜受损,尾部中段线粒体形态发生异常,导致ATP产生不足,继而精子的运动受到影响,最终降低精子游向卵子、冲破卵膜的能量,无法完成正常的受精过程,导致母猪受孕率下降。
2 硒影响雄性动物精液品质的机理
2.1 硒对雄性生殖激素的影响
梁明振等[10]的研究表明,精浆中的促卵泡生成素(FSH)、促黄体生成素(LH)和睾酮(T)浓度的变化受公猪饲粮含硒量的影响。当硒添加量适宜时,硒的添加会促进上述3种激素的分泌,而当硒添加量过多时,这3种激素的浓度又会降低。有报道指出,饲粮硒的水平可影响大鼠血清中的T浓度,缺硒时睾丸分泌的T量减少[11]。
然而对人的研究发现,与摄入低剂量(每天摄入13μg)硒的男性相比,摄入高剂量(每天摄入297μg)硒的男性血浆中T、LH及FSH浓度无显著变化,而血浆和精浆中前列腺素(PGF2α)的浓度显著升高。血浆及精浆中的硒水平与饲粮中硒水平存在正相关关系,而精子中的硒水平不受饲粮中硒水平的影响[12-13]。精浆中的硒由附性腺的上皮细胞分泌,这暗示饲粮中硒水平的变化引起精液品质的变化不依赖于下丘脑-垂体-睾丸性腺轴,而是通过影响附性腺组织对硒及激素的分泌来起作用。PGF2α可以促进雄性激素的分泌,Marin-Guzman等[14]在公猪上的试验也发现,硒能够稳定公猪前列腺和精囊腺中PGF2α的分泌。饲粮中添加硒可通过影响雄性激素的分泌来影响精液的品质。目前,硒对雄性激素分泌的影响调控机制还不清楚,尚待进一步研究。
2.2 硒的抗氧化作用对精液品质的影响
雄性动物精子细胞膜富含多不饱和脂肪酸,对脂质过氧化反应尤其敏感,此反应可导致精子活力快速和不可逆丧失,进而使雄性动物繁殖性能降低[15]。饲粮中添加的硒经十二指肠、空肠和回肠吸收后,大部分以硒半胱氨酸的形式参与到蛋白质合成中,形成硒蛋白而发挥着生物学功能[16]。大部分硒蛋白具有抗氧化功能,其中较为重要的是谷胱甘肽过氧化物酶家族(GPx)。
Marin-Guzm an等[7]发现公猪精子、精浆、附睾、精囊腺、前列腺内的GPx的活性、硒的浓度会随着饲粮中硒的添加量增加而增加。但在未开始采精之前,睾丸中硒的浓度与GPx的活性没有相关性。Jacyno等[3]报道饲粮中硒的添加并不影响血浆中硒浓度及GPx活性,但会使精浆中硒浓度增加,然而并不能增强精浆中GPx的活性。Lasota[17]的研究也没有找到精浆中GPx活性与精液品质之间的相关性,这可能与精浆中存在其他硒蛋白[如硒蛋白P(Sepp1)]有关。关于硒对公猪精浆脂质过氧化反应的影响,Fernandez等[8]认为饲粮不同的硒添加水平(0.025、0.300、0.500 mg/kg)不影响精浆中丙二醛(MDA)的浓度。
然而对小鼠的研究发现,随着饲粮中硒添加量的升高,睾丸中硒的浓度增加,GPx的活性增加,并且GPx m RNA的表达水平也增加[18];但当硒的添加量过高时,GPx的活性趋于稳定[19]。Shalini等[20]报道,当饲粮中硒缺乏或过量时,会使得小鼠睾丸中MDA、氧化性型谷胱甘肽(GSSG)的浓度增加,同时,附睾中精子染色体凝聚发生紊乱,DNA断裂,精子畸形率升高(图2)。这说明,饲粮中硒缺乏或过量都会使睾丸处于氧化应激状态,加快脂质过氧化反应,破坏精细胞膜,阻扰精子染色体凝聚,使得DNA暴露,易受活性氧族(ROS)的攻击而发生断裂,导致精子出现畸形。

图2 小鼠附睾中精子吖啶橙染色结果(400×)Fig.2 A cridine orange staining o fm ice epididymal spermatozoa(400×)
2.3 硒对精子结构成分磷脂氢谷胱甘肽过氧化物酶(GPx4)的影响
Calvin[21]在注射了75Se的大鼠中发现,75Se聚集在精子的尾部中段,表明硒可能与精子的结构组成有关。运用基质辅助激光解吸电离质谱技术(MA LDI-TOF)发现精子尾部中段线粒体微囊中近50%的结构蛋白是无酶活的GPx4。GPx4在精子发育的早期具有酶活性,而在精子成熟期则聚合变构,转变成一种结构成分,维持精子的正常形态和活力[22]。动物摄入低硒饲粮,引起精子头尾断裂的现象可能与GPx4的生物合成量减少有关。父代雄鼠供给缺硒饲粮,其睾丸中GPx4的活性不受影响,然而后代雄鼠睾丸中GPx4的活性下降到仅为补硒组后代该酶活性的13%,暗示雄性动物对GPx4具有很强的储存能力[23]。然而,Lei等[24]研究发现,当大鼠饲粮中的硒水平由2μg/kg上升到190μg/kg时,睾丸中GPx4的活性及其m RNA的表达水平不受饲粮硒水平的影响。同样,Schriever等[25]报道,饲粮中硒的添加水平会显著影响睾丸中细胞内谷胱甘肽过氧化物酶(GPx1)的活性和GPx1、Sepp1以及硒蛋白W(Sepw1)m RNA的表达水平,而对GPx4的活性及其m RNA的表达无显著影响。这提示,只有在动物体内硒耗竭的情况下,睾丸中GPx4的活性才会受到影响,从而导致精子尾部线粒体结构异常,头尾断裂。当动物体内具有一定的GPx4储备时,饲粮中的硒可通过影响睾丸中GPx1、Sepp1、Sepw1的浓度,调节睾丸中的氧化应激状态以及硒的转运水平,从而影响精液品质。
2.4 硒与精子发生的关系
2.4.1 硒对精子发生的影响
在Marin-Guzm an等[14]的试验中发现,硒的添加对公猪不同发育阶段精子生成的影响不同。在5.4或6.2月龄时,睾丸中精子总数不受饲粮中硒添加量的影响;在9.0月龄时,精子总数随着硒的添加有上升趋势;在18.0月龄时,补充硒可以获得高的精子数,且支持细胞、圆形精子细胞、次级精母细胞的数量较多。这说明硒有利于精子的生成,在整个发育阶段,尤其在进入青春期后,硒的补充显得尤为重要。同时,缺硒组精子颈部原生质滴附着百分率比补硒组高。原生质滴附着情况标志着精子在附睾中的成熟度。饲粮中的硒影响着精子的发生和成熟,这可能与GPx4在精子发生中的作用有关。在精子整个发育过程中,GPx4最早出现在精母细胞粗线期的Ⅶ~Ⅹ阶段,然后逐渐增加,在精子细胞延伸期达到分泌高峰[26]。因此,推测硒对精子发生的影响可能通过影响GPx4的合成过程来起作用,但该假设需要进一步证实。
2.4.2 硒对雄性生殖细胞内转录因子的影响
转录因子活化蛋白1(AP1)是一种复合转录因子,由同源或异源二聚体DNA结合蛋白组成,为典型的亮氨酸拉链结构,有Jun家族、Fos家族2个成员。AP1结合在一些与抗氧化防御、抗癌相关的基因的启动子区域,如编码γ-谷胱甘肽合成酶(γ-GCS)、从头合成谷胱甘肽系统里的相关限速酶、超氧化物歧化酶、血红素加氧酶等的基因。这些酶将会随着AP1的变化而变化,从而改变细胞的抗氧化能力[18]。同时AP1对氧化反应敏感,在生殖细胞增殖分化过程中起着重要的作用[27]。核转录因子-κB(NF-κB)与细胞的增殖分化过程有关[28],易被ROS激活,并且其激活过程受硒的调控[29]。
Shalini等[30]发现,适宜硒添加量组小鼠的早期有丝分裂的精原细胞和精母细胞内cjun和cfos的m RNA表达水平较高,在减数分裂时有所降低,而在精细胞延伸和成熟时表达水平达到顶峰。而硒的缺乏将会导致睾丸生殖细胞中的cjun和cfos的m RNA表达水平降低,从而减少生殖细胞的数量,降低生育能力。为了探究硒对AP1、NF-κB表达的不同调节机制,Shalini等[31]将小鼠睾丸细胞在体外培养,以0.5、1.5μm ol/L的量单独添加亚硒酸盐或同BSO(10 nmol/L,一种谷胱甘肽耗竭剂)一起添加,检测了还原性谷胱甘肽(GSH)、GSSG的活性及细胞内γ-GCS、cjun和cfos的mRNA表达水平,结果发现硒对cjun和cfos的影响是不同的。在氧化应激反应较缓慢的情况下,cjun和cfos的基因表达增强,而在硒过量或GSH耗竭的情况下,ROS的聚集诱发p65(NF-κB的亚基)的表达。AP1的表达通常与细胞增殖分化有关,有利于精子的生成。而NF-κB基因的激活,将会使细胞凋亡。由此可见,硒可通过影响雄性生殖细胞内转录因子的表达而调控精子的发生过程。
2.4.3 硒对雄性生殖细胞内细胞分裂周期蛋白的影响
硒缺乏和过量时,会影响细胞内的氧化还原状态,而氧化应激与生殖细胞凋亡有一定联系。在整个细胞分裂过程中,驱使细胞进入分裂中期的过程由CDC2和Cyclin B1形成的异源二聚体所调控[32]。在雄性配子形成时,这些蛋白质在减数分裂的过程中起着关键作用。任一蛋白质的钝化或合成中断,都会扰乱细胞分裂过程,促使生殖细胞凋亡[33]。K aushal等[32]研究发现脂质过氧化反应在硒过量和缺乏时都加强,而CDC2、Cyclin B1、Cdc25c的表达显著减少,p21蛋白(一种激酶抑制剂)的表达显著提高。因此,在硒缺乏和过量产生的氧化应激下,通过控制Cdc25c、p21蛋白的表达,使CDC2/Cyclin B1复合物下调,导致细胞周期停滞。这从新的角度解释了由硒缺乏和过量产生的氧化应激最终导致精子数量减少的原因。
3 硒在公猪生产中的运用
公猪饲粮中硒的缺乏和过量都会对精液品质造成不良影响。通过总结部分研究(表1)发现,种公猪断奶后,饲粮中硒的适宜添加量在0.3 mg/kg左右,有机硒的添加量低于无机硒。在夏季热应激及采精频率较高时,可适当提高硒的添加量[34]。硒具有一定毒性,NRC(1998)给出的硒的毒性剂量为5.0mg/kg。有机硒低毒高效,是较理想的硒源,开发更为经济的有机硒源成为目前的热点。

表1 公猪饲粮中硒的适宜添加量Tab le 1 Optim al supplemental levels o f selenium in boars'diet
4 结 语
公猪饲粮中的硒水平在决定精液品质好坏方面起着重要作用。硒影响着雄性动物生殖激素的分泌,并维持着精细胞内的氧化还原状态,同时参与精子中段结构的构建,调控着精子发生过程。硒影响雄性动物精液品质的机理已从表观现象进入到蛋白质分子水平。为保证较佳的精液品质,建议种公猪断奶后饲粮中硒添加量为0.3 mg/kg。
[1] MARK E W,KEV IN J R,THOMAS D C.Boar nutrition for op timum sperm p roduction[J].A dvances in Pork Production,2004,15:295-305.
[2] JONESR,MANN T.Lipid peroxidation in spermatozoa[J].Proceedings o f the Royal Society:Biology Science,1973,184:103-107.
[3] JACYNO E,KAWECKA M,KAMYCZEK M,et al.Rep roductive performance o f young boars receiving during their rearing inorganic or oraganic selenium+vitam in E in diets[J].Animal H usbandry, 2005,8(1):214-226.
[4] KOLODZ IEJ A,JACYNO E.Effect of selenium and vitam in E supplementation on rep roductive perform ance of young boars[J].A rchiv Tierzucht:A rchives Animal Breeding,2005,48:68-75.
[5] SEGERSON EC,GETZ W R,JOHNSON B H.Selenium and reproductive function in boars fed a low selenium diet[J].Journal of Animal Science,1981, 53:1360-1367.
[6] M ARIN-GUZMAN J,MAHAN D C,WH ITMOYER R.Ef fect o f dietary selenium and vitam in E on the ultrastructure and ATP concen tration o f boar spermatozoa,and the ef ficacy o f added sodium selenite in extended semen on sperm m otility[J].Journal of Animal Science,2000,78:1544-1550.
[7] MARIN-GUZMAN J,MAHAN D C,CHUNG Y K,et al.Effects o f dietary selenium and vitam in E on boar perform ance and tissue responses,sem en quality,and subsequent fertilization rates in mature gilts[J].Journal o f Animal Science,1997,75: 2994-3003.
[8] FERNANDEZ D L,M EDRANO A,ARENASE, et al.The ef fect of selenium supplement in diets of young boars on semen quality,antioxidant enzymatic activity and lipid peroxidation[J].Theriogeno logy,2008,70:1386.
[9] MAHAN D C.Low dietary selenium,vitam in E affect boar perform ance[J].M idwest Sec tional Meetings,1998,3:16-18.
[10] 梁明振,卢克焕,黎宗强,等.饲粮不同硒水平对公猪繁殖及精浆营养生化参数的影响[J].广西农业生物科学,2003,22(3):165-170.
[11] 瞿祥虎,邓利群,黄开勋.低硒对雄性大鼠性腺发育和分泌功能的影响[J].中国地方病学杂志,1999,18 (6):415-418.
[12] HAWKESW C,PAUL JT.Effects of dietary selenium on sperm motility in healthy men[J].Journal o f And ro logy,2001,22:764-772.
[13] HAW KESW C,ALKAN Z,KENNETH W.Selenium supplementation does not af fect testicular selenium status or semen quality in North Am ericanm en [J].Journal o f Andro logy,2009,30:525-533.
[14] MAR IN-GUZMAN J,MAHAN D C,PATE J L. Effect o f dietary selenium and vitam in E on spermatogenic development in boars[J].Journal of Animal Science,2000,78:1537-1543.
[15] STOREY B T.Biochem istry o f the induction and p revention of lipoperoxidative dam age in human spermatozoa[J].M olecular of Hum an Rep roduction,1997,3:203-213.
[16] SUZUKIK T,OGRA Y.M etabolic pathw ay for selenium in the body:speciation by HPLC-ICP MS with enriched Se[J].Food Additives and Contam inants,2002,19(10):974-983.
[17] LASOTA B.Re lationships between the content of trace elem ents and activity o f GSH-PX in semen and blood of boars and the bio logical value of semen used to artifical insem ination[J].Rozprawy-Akadem ia Rolnicza w Szczecinie,2002(1):1-53.
[18] SHAL INI S,BANSAL M P.Ro le of selenium in regulation o f spermatogenesis:invo lvement o f activator protein 1[J].Biofactors,2005,23(3):151-162.
[19] H AFEM AN D G,SUNDE R A,HOEKESTRA W G.Effect of dietary selenium on ery throcy te and liver glutathione peroxidase in the rat[J].Journalof Nutrition,1974,104:580-587.
[20] SHALIN IS,BANSAL M P.D ietary selenium deficiency as w ell as excess supp lementation induces multiple defects in m ouse epididymal spermatozoa: understanding the role of selenium in male fertility [J].International Journal o f Andrology,2007,31: 438-449.
[21] CALV IN H I.Selective incorporation of selenium-75 into a polypeptide of the rat sperm tail(1)[J]. Journal of Experience Zoo logy,1978,204:445-452.
[22] URSINI F,HEIM S,K IESS M,et al.Dual function of the selenoprotein PHGPx during sperm maturation[J].Sc ience,1999,285:1393-1396.
[23] THOMPSON K M,H AIBACH H,EVENSON JK, et al.Liver selenium and testis phospholipid hydroperoxide glutathione peroxidase are associated with grow th during selenium repletion of secondgeneration Se-deficien tm ale rats[J].Journal of Nutrition,1998,128:1289-1295.
[24] LEI X G,EVENSON J K,THOMPSON K M,et al.Glutathione peroxidase and phospholipid hyd roperoxide glutathione peroxidase are differentially regulated in rats by dietary selenium[J].Journal of Nutrition,1995,125:1438-1446.
[25] SCHRIEVER S C,BARNES K M,EVENSON JK, et al.Selenium requirem ents are higher for glutathione peroxidase-1 mRNA than Gpx1 activity in rat testis[J].Experimental Biology and Medicine, 2009,234(5):513-521.
[26] BECKETT G J,ARTHUR JR.Selenium and endocrine systems[J].Journal of Endocrinology,2005, 184:455-465.
[27] COHEN D R,CURRAN T.Analysis o f dim erization and DNA binding functions in Fos and Jun by domain-swapping:involvem ent of residues outside the leucine zipper/basic region[J].Oncogene, 1990,5(6):929-939.
[28] PAHL H L.Ac tivators and target genes of Rel/NF-κB transcription factors[J].Oncogene,1999,18 (49):6853-6866.
[29] KIM I Y,STADTM AN T C.Inhibition of NF-κB DNA binding and nitric oxide induction in hum an T cells and lung adenocarcinoma cells by selenite treatment[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94: 12904-12907.
[30] SHALIN I S,BANSAL M P.Role of selenium in spermatogenesis:differential expression of cjun and cfos in tubular cells ofm ice testis[J].Molecular and Ce ll Biochem istry,2006,292(1/2):27-38.
[31] SHALINIS,BANSAL M P.Co-operative ef fect of glutathione dep letion and selenium induced oxidative stress on AP1 and NFκB expression in testicular cellsin vitro:insights to regulation of spermatogenesis [J].Biological Research,2007,40(3):307-317.
[32] KAUSHAL N,BANSAL M P.Inhibition of CDC2/ Cyclin B1 in response to selenium-induced oxidative stress during spermatogenesis:potential ro le of Cdc25c and p21[J].Molecular and Cell Biochem istry,2007,298(1/2):139-150.
[33] DOREE M,HUNT T.From Cdc2 to Cdk1:w hen did the cell cycle kinase join its partner[J].Journal o f Cell Science,2002,115:1-4.
[34] 何若钢,李秀宝,段福君,等.酵母硒对长白公猪繁殖及生化参数的影响[J].猪与禽,2008,28(1):82-84.
*Correspond ing au thor,p rofessor,E-m ail:pig2pig@sina.com
(编辑 菅景颖)
