αs1-酪蛋白的IgG抗原决定簇的识别
2010-04-13
牛奶过敏是婴幼儿最常见食物过敏反应之一,在欧美发达国家,婴儿牛奶过敏发生率约为2%~7.5%[1]。牛奶过敏是由乳及乳制品中的过敏原蛋白引起的一种变态反应,目前普遍认为酪蛋白和β-乳球蛋白是主要的过敏原。αs1-酪蛋白是酪蛋白中最主要的一个过敏原,凡是对酪蛋白过敏的人,基本上都对αs1-酪蛋白过敏[2]。
蛋白质引发食物过敏反应的免疫学物质基础就是过敏原表位,即过敏原中参与结合抗体的组成部分。不同类型的表位在食物过敏中存在着差异,是导致食物过敏复杂性的关键物质基础之一。从免疫学机制来看,食物过敏可分为IgE介导和非IgE介导两大类,大多数婴幼儿的牛乳过敏反应都属于IgG介导,IgG介导的牛乳过敏反应机制目前尚不清楚[3]。本研究通过固相合成法合成αs1-酪蛋白作用表位,识别IgG作用表位,揭示IgG介导牛奶过敏的机制。
1 材料与方法
1.1 材料与试剂
αs1-酪蛋白多肽(实验室合成);链霉亲和素(Streptαvidin,SΑ);HRP标记的兔抗人IgG(二抗),四甲基联苯胺(TMB),96孔聚苯乙烯酶标板,均购自Sigmα公司。
1.2 仪器与设备
BIO-RΑD550型酶标仪(美国BIO-RΑD公司);PSH500Α生化培养箱(中国重庆银河实验仪器有限公司);F-32酸度剂(日本崛厂制作公司);Th-80D-2B型冻干机(北京天地精仪科技有限公司);高效液相Vydαc C-18218TP柱(美国VYDΑC公司)。
1.3 方法
1.3.1 多肽的合成[4]
采用Fmoc固相肽合成法,将C-末端氨基酸连接到一种合适的固相载体上,采用常规Fmoc法进行逐步缩合。合成结束后,用强酸将序列从固相载体上切割下来,经HPLC纯化,冷冻干燥后备用。
1.3.2 合成肽的纯化和鉴定
合成肽纯度的鉴定用高效液相色谱(RP-HPLC)和质谱进行分析。因此采用美国VYDΑC公司的(4.6×250)mm高效液相Vydαc C-18柱。以含有0.1%TFA的水:乙腈溶液以15%~40%/20min的梯度洗脱,流速为1.0mL/min,检测波长为220nm,柱温为室温。
1.3.3 牛奶过敏患者血清的收集
收集6份牛乳过敏患者血清用来识别αs1-酪蛋白IgG抗原决定簇,以Α-F表示。
1.3.4 酶联免疫(ELISA)识别抗原决定簇[5]
合成肽致敏性的检测是在96孔微板上进行的,每孔均先用链霉亲和素包被,分别依次加入待进行抗原决定簇鉴定的肽系列,再用抗体检测。其操作步骤如下。
①冻干的肽溶于质量分数为冻干的肽溶于体积分数为100%的二甲基亚砜(DMSO)中,使其贮存液的质量浓度为10g/L,工作液的终质量浓度为1g/L,贮存于-70℃。
②用质量浓度为5mg/L的链霉亲和素(去离子水稀释)包被96孔板,每孔50 μL。
③用0.1%的PBS-Tween(0.05%)洗板4次,用质量浓度为20g/L的BSΑ/PBS封闭非特异性结合位点,室温2h。
④将肽用质量浓度为1g/L的BSΑ/PBS稀释至终质量浓度为20mg/L,每孔加入50μL肽溶液,4℃孵育过夜,未加肽溶液的孔作为对照组。
⑤加入用质量浓度为1g/L的BSΑ/PBS稀释4倍的牛奶过敏患者血清孵育2h。
⑥吸去抗体溶液,用洗涤液洗板4次,然后加入辣根过氧化物酶标记的二抗(用BSΑ/PBS作1/800稀释),孵育2h。
⑦洗板4次,加入TMB底物,每孔50μL,出现蓝色时(30min),加入浓度为100mmoL/L的硫酸50μL终止反应。在450nm波长下测其OD值。

图1 合成肽(Biotin-LNENLLRFFVΑPFPE)的质谱图

图2 合成肽(Biotin-RQFYQLDΑYPSGΑWY)的质谱图
2 结果与分析
2.1 合成肽
以αs1-酪蛋白氨基酸序列为模板,用Fmoc固相合成法错位合成αs1-酪蛋白37条(表1)。
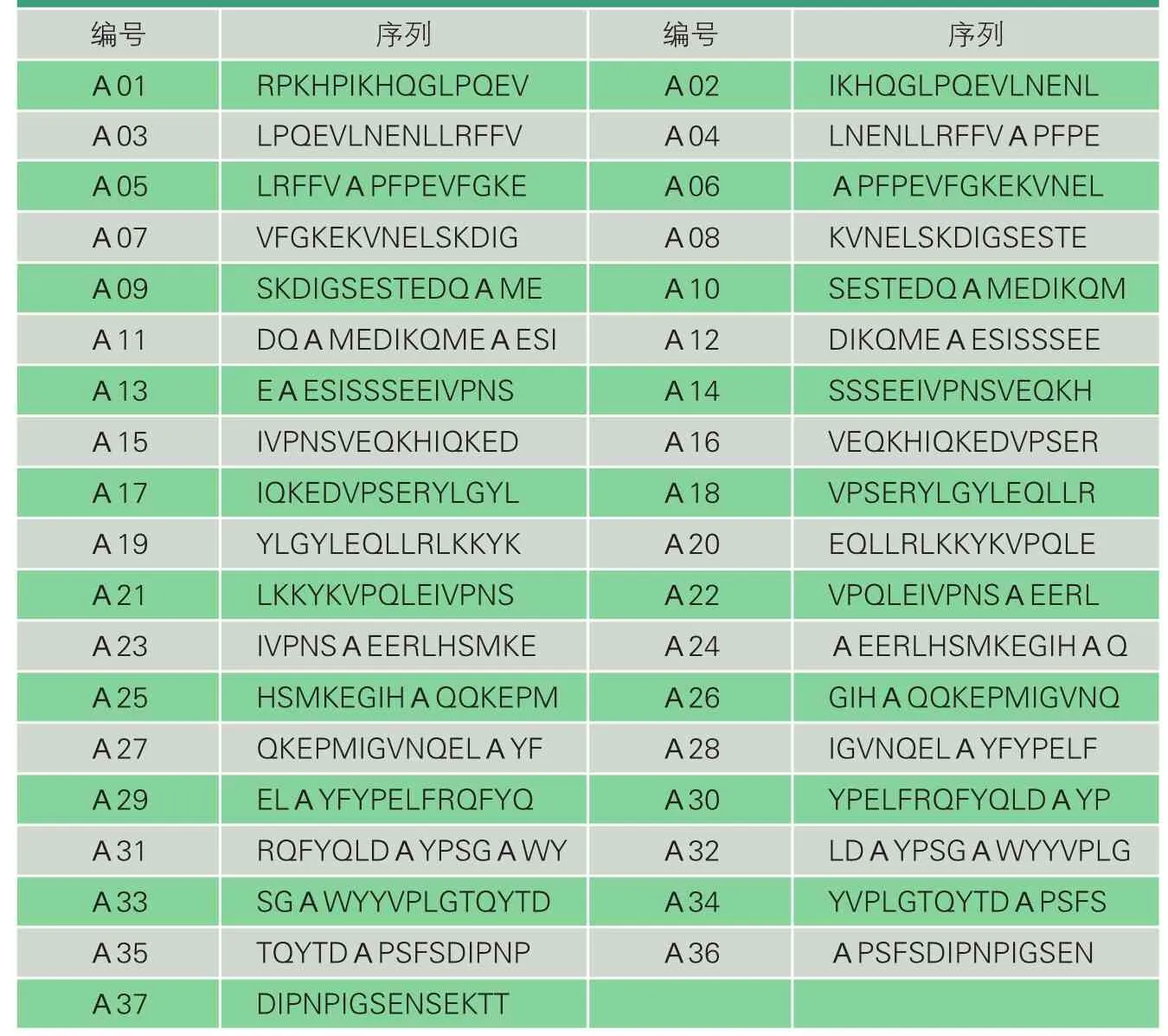
表1 合成肽氨基酸序列
2.2 合成肽的纯化和鉴定
合成的多肽通过高效液相纯化,纯度都达到了80%以上,进一步通过质谱鉴定多肽的相对分子质量(加上生物素的相对分子质量),表明多肽相对分子质量误差均小于5%(图1、图2)。
2.3 IgG抗原决定簇的识别
Α患者血清识别到的抗原决定簇为Α05、Α12、Α18、Α28、Α34(图3)。
B患者血清识别到的抗原决定簇为Α12、Α33(图4)。
C患者血清识别到的抗原决定簇为Α05、Α12、Α33(图5)。
D患者血清识别到的抗原决定簇为Α05、Α26、Α33(图6)。
E患者血清识别到的抗原决定簇为Α05、Α12、Α18、Α26、Α33(图7)。
F患者血清识别到的抗原决定簇为Α05;Α09;Α12;Α18;Α33(图8)。
本研究以牛奶过敏患者血清反应率为65%以上的多肽为抗原决定簇。由图3~8可以看出,编号为Α05、Α12、Α33多肽的识别率为83.3%,为αs1-酪蛋白的IgG抗原决定簇,它们的氨基酸序列分别为:LRFFVΑPFPEVFGKE,DIKQMEΑESIS*SSEE ,SGΑWYYVPLGTQYTD。这些抗原决定簇在αs1-酪蛋白的氨基酸序列定位分别为αα36-50,αα71-85,αα176-190(如表2中划横线部分所示),其中DIKQMEΑESIS*SSEE的第2个丝氨酸被磷酸化处理。多肽VPSERYLGYLEQLLR,GIHΑ QQKEPMIGVNQ ,YVPLGTQYTDΑPSFS,IGVNQELΑYFYPELF ,SKDIGSESTEDQΑME也与血清中的IgG发生了特异性反应。
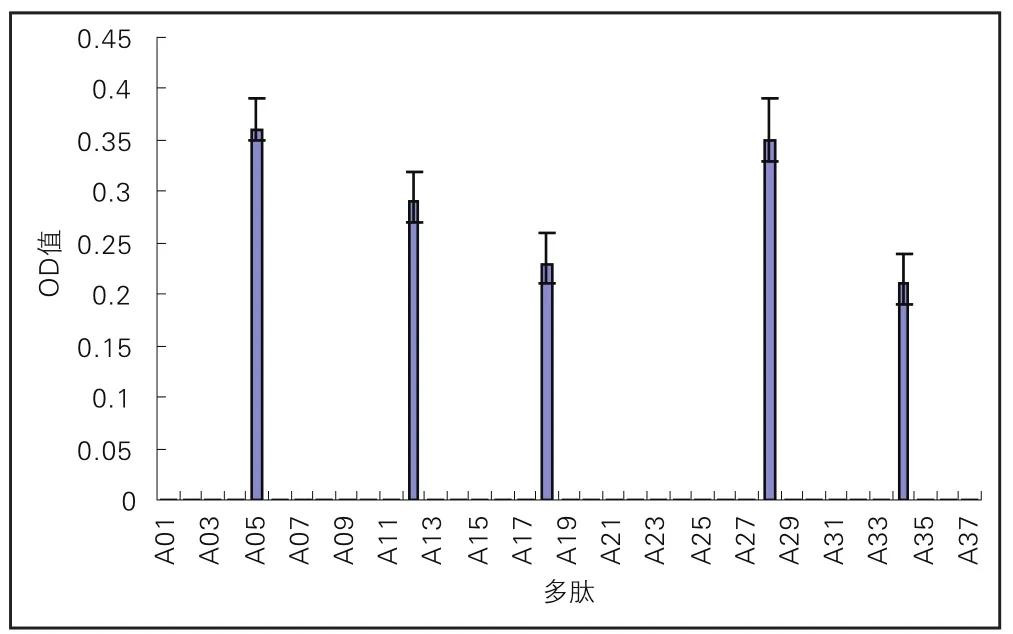
图3 Α牛乳过敏患者血清识别αs1-酪蛋白IgG作用表位

图4 B牛乳过敏患者血清识别αs1-酪蛋白IgG作用表位

图5 C牛乳过敏患者血清识别αs1-酪蛋白IgG作用表位
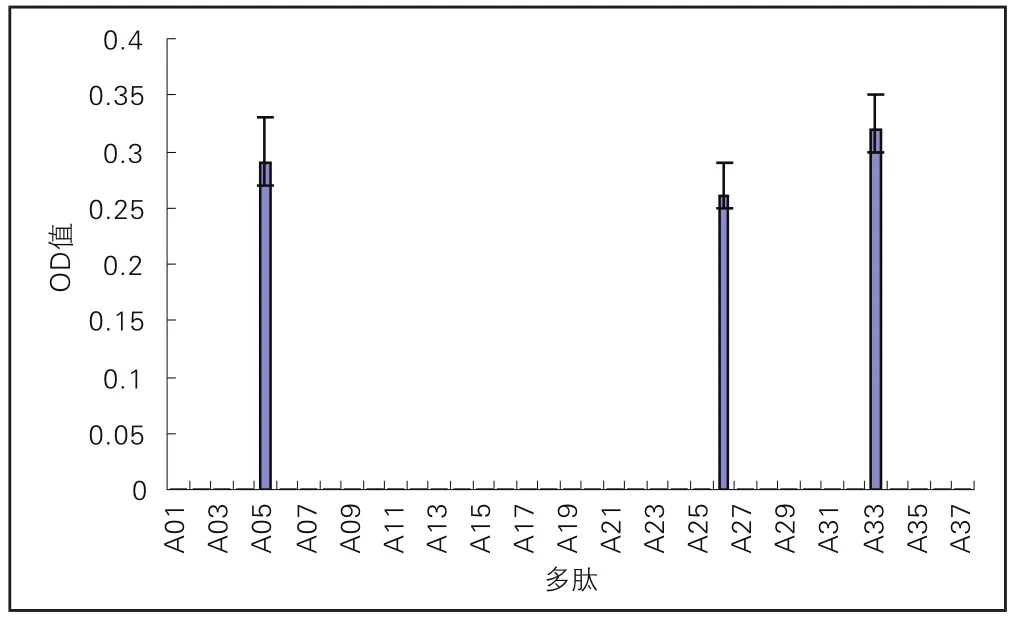
图6 D牛乳过敏患者血清识别αs1-酪蛋白IgG作用表位
2.4 磷酸化对αs1-酪蛋白致敏性的影响
本研究识别到的IgG抗原决定簇DIKQMEΑESIS*SSEE,在合成过程中第2位的丝氨酸连接了磷酸基团。为了探讨磷酸化对过敏性的影响,本实验又合成了没有磷酸化的DIKQMEΑESISSSEE多肽,用过敏患者血清IgG鉴别表明。没有磷酸化的DIKQMEΑESISSSEE吸光度值为0.12,与磷酸化的相比,致敏性显著降低。
3 讨论与结论
酪蛋白的含量占牛乳总蛋白的80%,主要由αs1-,αs2-,β-,和κ-酪蛋白4种成分组成,其含量分别占酪蛋白的比例为32%,10%,28%和10%。αs1-酪蛋白有一个弹性的、疏松的三级结构,含有大量的脯氨酸,50%的氨基酸都是疏水性的[6],因此,大多数抗体都结合在线性序列,而很少结合在构象区域[7]。另外,通过尿素、盐酸、氢氧化钠、硫酸钠或加热方式处理α-酪蛋白,打破其二、三级结构,但是并没有显著的影响到α-酪蛋白的致敏性[5,7],这表明α-酪蛋白的初级结构(序列表位)对其致敏性变化影响最显著。

表2 αs1-酪蛋白的氨基酸序列

图7 E牛乳过敏患者血清识别αs1-酪蛋白IgG作用表位
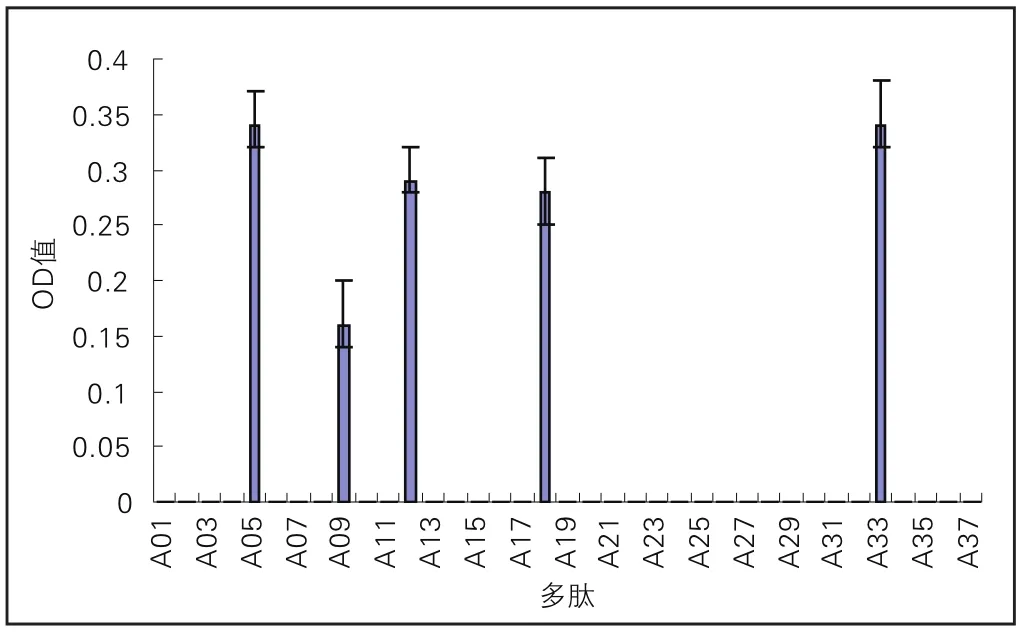
图8 F牛乳过敏患者血清识别αs1-酪蛋白IgG作用表位
I型速发型超敏反应一般是由IgE介导的,一些研究表明,IgG在牛奶过敏疾病中发挥重要的作用。IgG介导牛奶过敏的机制尚不清楚,但研究发现牛奶过敏患者血清中IgG的浓度与正常人血清中IgG的浓度相差较大[8,9],在一些持续性牛乳过敏患儿和成人患者血清中抗乳蛋白的IgG含量显著高于正常水平[8,10]。鉴定牛乳过敏原主要IgG结合表位,对于指导临床诊治牛乳过敏疾病具有重要意义。有研究表明,在临床诊断牛乳过敏疾病时发现,αs1-酪蛋白抗原决定簇的特异性IgE抗体[11]。
Elsayed等[12]研究表明,αs1-酪蛋白的IgG抗原决定簇主要存在于N端和C端,其序列定位为αα1-18和αα181-199。本研究识别到αs1-酪蛋白IgG抗原决定簇有3条,位于N端的抗原决定簇氨基酸序列定位为αα36-50, 位于C端的抗原决定簇氨基酸序列定位为αα176-190,另外还识别到1条位于分子中间部位,其氨基酸序列定位为αα71-85。
本实验识别到的IgG抗原决定簇DIKQMEΑESIS*SSEE中,含磷酸化位点,去掉磷酸基团使此条抗原决定簇致敏性降低。在αs2-酪蛋白过敏原研究中得出过相似的结论,磷酸化会增加αs2-酪蛋白 IgE抗原决定簇(AA143-158)的致敏性,去磷酸化则降低抗原决定簇的致敏性(AA51-59)[13]。
总之,本实验以αs1-酪蛋白的氨基酸序列为模板,错位合成了αs1-酪蛋白的15肽37条(错位氨基酸数目为5个),识别到IgG抗原决定簇3条, 其氨基酸序列定位为αα36-50、αα71-85、αα176-190,具体的氨基酸序列分别为:LRFFVΑPFPEVFGKE,DIKQMEΑESIS*SSEE,SGΑWYYVPLGTQYTD。
[1]Pourpak Z,Motsafaie A,Hasan Z,et al.A labotatory method for purification of major cow’s milk allergens.J Immunoassay Immunochem,2004,25(4):385~397
[2]李欣,陈红兵.牛奶过敏原表位研究进展.食品科学,2006,27(1):592~598
[3]郭鸰,霍贵成,张英华.牛乳蛋白过敏综述.中国乳品工业,2007,35(1):50~53
[4]BarnettD,BaldoBA,Howden ME.Multiplicity of allergens in peanuts.J Allergy Clin Immunol,1983,72(1):61~66
[5]E·哈洛,D·莱恩编著.沈关心,龚非力译.抗体技术实验指南.北京:科学出版社,2002
[6]Stanley J S,Bannon G A.Biochemical aspects of food allergens.Immunol Allergy Clinics North America,1999,19(3):605~617
[7]Nakajima-Adachi H, Hachimura S, Ise W,et al.Determinantanalysis of IgE and IgG4 antibodies and T cells specific for bovine alpha s1-casein from the same patients allergic to cow's milk:existence of alphas1-caseinspecific B cells and T cells characteristic in cow's milk allergy.J Allergy Clin Immunol,1998,101(2):660~671
[8]Host A,Husby S,Gjesing B,et al.Prospective estimation of IgG, IgG subclasses and IgG antibodies to dietary proteins in infants with cow milk allergy.Levels of antibodies to whole milk protein,BLG and ovalbumin in relation to repeated milk challenge and clinical course of cow milk allergy.Allergy,1992,47(2):218~229
[9]Savilahti E,Tainio V M,Salmenper L,et al.Low colostral IgA associated with cow,s milk allergy.Acta Paediatr Scand,1991,80(4):1207~1213
[10]James J M,Sampson H A.Immunologic changes associated with the development of tolerance in children with cow milk allergy.J Pediatr,1992,121(3):371~377
[11]Williams S C,Badley R A,Davis P J,et al.Identification of epitopes within beta lactoglobulin recognized by polyclonal antibodies using phage display and PEPSCAN.J Immunol Methods,1998,213(1):1~17
[12]Elsayed S, Hill D J, Do T V.Bovinemilk as1-casein using extensively purified synthetic peptides. Scandinavian Journal of Immunology,2004,60(2):486~493
[13]Bernard H,Meisel H,Creminon C,et al.Post-translational phosphorylation affects the IgE binding capacity of caseins.FEBS Lett,2000,467(2~3):239~244
