基因工程药物开发热点
——成纤维细胞生长因子家族
2010-04-06李校堃肖倩韩静肖健
李校堃, 肖倩, 韩静, 肖健
·述评·
基因工程药物开发热点
——成纤维细胞生长因子家族
李校堃, 肖倩, 韩静, 肖健
成纤维细胞生长因子(f1ibroblast growth factor,FGF)是一类具有广泛生物学活性的肽类物质,是多能信号分子,具有参与细胞增殖、分化和游走等功能。FGF 具有很强的促细胞生长作用和广泛的生物学作用,能影响多种细胞的生长、分化及功能,如血管内皮细胞、平滑肌细胞、心肌细胞、成纤维细胞、神经元、星形胶质细胞、卵泡粒层细胞等。FGF 在人发育的各个时期大量表达,在体内和体外均具有活性,参与血管新生、促有丝分裂、细胞分化、细胞迁移、组织创伤修复等。FGF 同时也是重要的有丝分裂促进因子,是形态发生和分化的诱导因子,在正常生理和病理过程中参与生长发育和组织损伤的修复过程。大部分 FGF 通过结合细胞表面的磷酸激酶 FGF 受体发挥生物学功能,FGF 可以与肝素和硫酸肝素糖蛋白(HSPG)结合,这种结合能增强 FGF 和受体的结合作用。最近人们也发现 FGF19、FGF21 和 FGF23 亚家族具有调节内分泌激素的功能,如对胆汁酸、胆固醇、葡萄糖、维生素 D 和磷酸盐起到内稳调节器的作用,这种作用的发生主要依赖于靶向组织中 klotho 蛋白质的存在。
与成纤维细胞生长因子信号异常相关的人类疾病在国内外早有报道。发挥异常调控作用的成纤维细胞生长因子信号能促进病理条件的形成,其作用机制是通过使其配体突变,增加或减少其本身的作用。例如:FGF23 在常染色体显性遗传低磷性佝偻病中功能增加,FGF10 在 LADD 综合征中功能降低,FGF3 在耳聋患者中功能降低,而 FGF8 在卡尔曼综合征患者中功能降低。使用外源的 FGFs、抗体或小分子进行治疗是目前较先进的治疗手段,FGFs 应用越来越广泛。重组 FGF7 开始用于治疗化疗引起的口腔黏膜炎。希望在将来,FGFs 能应用到如肾脏病治疗,调节葡萄糖和磷酸盐平衡,干细胞研究,组织修复和生物工程研究及促进血管生成。对成纤维细胞生长因子及其受体在结构生物学中相互作用的进一步研究,将促进新的治疗方法的应用和推广[1]。
1 成纤维细胞生长因子在创伤、烧伤中的应用[2]
成纤维细胞生长因子 FGF 具有较为突出的促血管内皮细胞、表皮细胞、软骨细胞、神经纤维、胶原的生长作用,在临床医学和整形美容领域均具有广阔的应用前景和推广价值,因此,通过基因工程方法获得并规模化生产高纯度、高活性的 FGF对治疗各类创伤及溃疡具有重要的意义。
我们科研团队是国内最早开始 FGF 新药研究和开发的课题组,在 20 多年 FGF 研究当中,我们主要的工作如下:
⑴研究并阐明了 FGF 在加速创面修复、内脏缺血性损伤主动修复和防止过度纤维化发生中的分子机制,探讨了干细胞诱导分化与融合技术在促进和加速创面愈合及提高愈合质量方面的内在联系。
⑵通过对 FGFs 突变体结构功能的深入研究,首次在国内外开展 rhaFGF 和 rhbFGF 的临床研究,完成大规模的烧伤、慢性难愈性创面(如糖尿病患者的慢性创面、褥疮、瘘道和慢性溃疡)、慢性肉芽创面及整形手术后创伤愈合三期临床实验,首次进行 FGFs 的人体剂量效应关系、药代动力学及安全性评价,为基因工程药物临床药理学研究提供重要经验,研究结果被 The Lancet、Wound Repair Regen 等国际杂志报道。
⑶课题组研究发现,rhaFGF、rhbFGF 在有效剂量范围内可促进表皮细胞生长、新毛细血管增生及胶原蛋白和弹性纤维的合成,无明显的毒副作用。抗感染药物与 FGFs 联合应用,可主动促进创面受损血管、神经组织以及表皮的增生,增强创面的抗感染能力,有助于加速创伤修复,提高修复质量,为蛋白多肽药物在临床的合理用药提供借鉴。
⑷通过研究 FGFs 药物融合在不同生物材料中对其结构功能的影响,对 FGFs 生物材料进行分子修饰及表面处理,解决了大分子蛋白药物稳定性、缓释性问题,同时探讨了蛋白药物复合组织工程材料的制备、分子机制及药理研究。首次用rhaFGF 和 rhbFGF 对生物胶原海绵进行肝素化修饰及壳聚糖铰链处理,形成一种具有 rhaFGF 和rhbFGF 生物活性的组织工程材料。同时,利用大鼠糖尿病模型证实了该材料能有效抵抗糖尿病皮肤溃疡局部氧化损伤、促进血管增生、加快创面修复。在动物实验基础上,完成多中心双盲临床实验并获得国家三类药器械材料生产批文[国药管械(试)字 2002 第 3040040 号]。
此外,我们还系统性地开展了 FGFs 急性毒性、溶血试验、刺激性、长期毒性、遗传毒性及生殖毒性等系列毒理学试验及安全性评价,首次证实了生长因子 FGFs 在有效剂量内应用的安全性,未发现有过度增生现象及诱导肿瘤发生现象,为FGFs 下一步的临床应用研究与药物开发奠定实验基础。
我们首次在国内开展外用 FGFs 的临床药理研究。迄今累计观察临床病例 3600 多例(bFGF 3000 例,aFGF 600 多例)。研究观察病例涉及大面积烧伤、慢性难愈合创面(如糖尿病患者的慢性创面、褥疮、瘘道、慢性溃疡)、慢性肉芽创面以及整形手术后创伤愈合等。研究结果表明,FGFs 对来源于中胚层和外胚层的细胞(如上皮细胞、真皮细胞、成纤维细胞、血管内皮细胞、角膜细胞、神经细胞、胶质细胞、骨细胞等)具有促进修复和再生的作用,对神经损伤的修复,如老年性痴呆、缺血性脑病、脑中风后遗症、神经性耳聋等中枢及外周神经病变的修复,均有明显促进作用,是目前疗效突出的促创面愈合新药。
与此同时,我们也进行了大量系统的临床前及I、II、III、IV 期临床试验,并成功获得了三个国家食品药品监督管理局颁发的国家基因工程一类新药证书。通过对多个适应证进行临床试验,我们发现,FGFs 不仅适于慢性创面(包括慢性肉芽创面、溃疡和褥疮等)和新鲜创面(包括外伤、手术伤如宫颈糜烂术后等)、烧伤创面(包括浅 II 度、深 II 度、肉芽创面)和复合创伤(伴有神经、血管及骨组织创伤),还适用于糖尿病足坏疽等难愈创面的愈合。
一类新药 FGFs 先后在解放军 304 医院、北京积水潭医院、中山大学附一院、上海第二军医大学等 60 余家医院(其中 30 余家三级甲等医院)进行了广泛的临床验证。主要表现有:
⑴FGF 治疗浅 II 度烧伤,观察组织上皮生长情况,比传统用药提前 4 ~ 6 d 愈合;
⑵慢性久治不愈的创面用 bFGF 后明显缩短愈合时间,为难愈性疾病的临床治疗提供新的手段;
⑶FGF 应用于久治不愈的瘘道、瘘管,也表现出明显的疗效。
外用重组牛碱性成纤维细胞生长因子 rbbFGF分别在珠海亿胜生物制药有限公司和长春长生生物科技股份有限公司进行产业化,其系列产品“贝复舒”、“贝复济”以及“见林”已上市多年。外用重组人碱成纤维细胞生长因子(rhbFGF)在南海朗肽制药有限公司进行产业化,其产品“盖扶”于2004 年上市。外用冻干重组人酸性成纤维细胞生长因子(rhaFGF)已获得新药证书,于 2006 年在上海万兴生物制药有限公司实施产业化。其中,rbbFGF 和 rhbFGF 新药产业化项目分别于 2002年和 2005 年被国家发改委列入“高新技术产业化示范工程项目”。
2 成纤维细胞生长因子受体为靶点开发的药物
成纤维细胞生长因子受体功能获得的突变与大量疾病有密切联系,比如颅缝早闭症、矮化综合征以及癌症。大部分 FGF 受体的变异是与配体无关的,只有小部分突变表现在受体与配体结合的位点,如 FGF 受体 2 的突变就发生在胞外功能区252 位的丝氨酸由色氨酸取代及 253 位的脯氨酸被精氨酸取代。这些突变会使配体的亲和力增强,导致阿佩尔综合征的出现,同时突变也会提高不相称配体的结合力。引人注目的是引起骨骼综合征的突变通过体细胞的突变,对癌症的发展起到了作用。此外 FGFR1-FGFR3 的突变经常出现在同源的残基上,并以此来解释多重病理的原因。
2.1 成纤维细胞生长因子受体 1(FGFR1)
至少有三种家族遗传病与 FGFR1 的突变有关:卡尔曼综合征、骨骼发育异常和法伊弗综合征。病理状态的 FGFR1 信号同样出现在各种恶性肿瘤中。胶质母细胞瘤,脑肿瘤显示了 FGFR1 激酶领域的功能增加,FGFR1 在恶性前列腺细胞中异常的活跃,在 8p11 骨髓增生综合征(EMS)中,与 FGFR1 激酶结构域结合的不同蛋白发生易位,造成激酶二聚体的形成。
2.2 成纤维细胞生长因子受体 2(FGFR2)
大量的颅缝早闭综合征的患者包括克鲁宗综合征和法伊弗综合征患者,FGFR2 激酶结构域的突变已经得到了鉴定。这些突变通过切断位于激酶结构域铰链区的一个自动抑制的分子信号来持续地激活 FGF 受体。多数导致骨骼畸形的变异同样也在子宫内膜癌中观察到,FGFR2 胞外结构域的突变导致配体无关的、二硫键介导的共价受体二聚化和激化某些疾病的病理进程,比如克鲁宗综合征。FGFR2c 配体依赖型胞外结构域的变异使得突变后的受体可以与 FGFR2b 的配体结合,这种突变导致法伊弗综合征和阿佩尔综合征的形成。与这些综合征相关的变异同样会导致白质病症,包括胼胝体发育不全和脑室扩大。有趣的是,通过显性负效应,可溶性 FGFR2 能抑制成骨细胞分化,这一作用在阿佩尔综合征中可以被观察到。值得注意的是,FGFR2c 中单核苷酸多态性与乳腺癌的BRCA2 的突变有关。
2.3 成纤维细胞生长因子受体 3(FGFR3)
受体跨膜区的突变,比如 FGFR3 的 380 位点中甘氨酸被精氨酸取代,这种变异促进了位于跨膜双螺旋之间的非共价交互作用,并且这种变异几乎发生在所有软骨发育异常的病例中,这也是侏儒症通常的基因形式。FGFR3 激酶结构域的变异增加了受体二聚化的催化活性,其作用通过切断位于激酶结构域铰链区一个自动抑制的分子信号来实现。一系列的成纤维细胞突变影响到 FGFR3 激酶结构域的 3 个密码子(Ile538、Asn540 和Lys650),从而导致了临床上三种严重性的矮化症:软骨发育不良、II 型致死性发育不全和伴有迟发育及黑棘皮症的严重软骨发育不全(SADDAN 综合征)。此外 FGFR3 的过度表达和功能获得突变也出现在骨髓瘤中,这是一种难以治愈的 B 细胞恶性肿瘤。FGFR3 的功能获得变异是膀胱癌中最易于观察到的变异,它在皮肤肿瘤中也被观察到。大多数癌症中发现的 FGFR3 变异与骨骼异常相关的 FGFR2 变异是相一致的。冠状动脉左前降支对角支综合征中 FGFR2 与 FGFR3 的激酶结构域发生功能丧失的变异,而在黑素瘤中 FGFR2 的激酶结构域发生功能丧失的变异。
2.4 成纤维细胞生长因子受体 4(FGFR4)
FGFR4 在癌症中作为一个预知性的标志在临床上具有潜在的价值。FGFR4 中 388 位的精氨酸与增强前列腺癌的进攻性以及通过增加细胞的动能和侵袭力来增强癌症的转移,在临床预知能力弱的情况下,FGFR4 中的小等位基因片段可以起到对头颈部鳞状细胞癌的预知作用,在复发的乳腺癌中 FGFR4 高表达,而此时他莫昔芬治疗的效率是非常低的。
2.5 成纤维细胞生长因子受体的潜在治疗作用
直接抑制 FGFRs 或许具有临床价值(表 1),舒尼替尼是一个酪氨酸受体抑制剂,并且它已获得食品药品监督管理局的批准,用于恶性肾肿瘤有肾细胞癌和胃肠间质肿瘤,它和甲磺酸伊马替尼不同,具有抗 FGFRs 的作用。Su5402、PD173074 和去甲二氢愈创木酸是 FGFRs 的小分子抑制剂,它们对伴有 FGFR3 无秩序表达的多发性骨髓瘤有抑制作用。此外,PD173074 具有诱导存在 FGFR2变异的子宫内膜癌细胞周期停滞的能力。除小分子的抑制剂之外,FGFR3 的抗体在多发性骨髓瘤和膀胱癌小鼠模型中得到证明,它可以有效地导致细胞凋亡。这些情况可以证明 FGFR 抑制剂能有效地治疗恶性肿瘤。FGFR1 的 766 位的酪氨酸磷脂酶结合位点突变会减弱电肌肉刺激,因此,对FGFR-PLCγ1 相互作用区域的干扰作用可以作为治疗 EMS 的一种有效策略。酪氨酸激酶抑制剂的磷脂酶 Cγ 抑制剂的应用同样可以减缓对酪氨酸激酶抑制剂的抗药性。

表 1 FGF 信号选择性抑制剂
3 成纤维细胞生长因子旁分泌家族新药开发
FGF 的旁分泌家族包括 FGF1 和 FGF2;FGF3、FGF7、FGF10 和 FGF22;FGF4,FGF5 和FGF6;FGF8、FGF17 和 FGF18;FGF9、FGF16 和FGF20。它们对 HSGAG 的高亲和力导致它们在表达的局部发挥作用(表 2)。关于 FGF 旁分泌配体对血管发生、细胞保护及组织修复的潜在治疗作用正在探究中(表 3)。比如,重组 FGF7 已用于临床治疗因放化疗引起的黏膜炎,重组 FGF1、FGF2和 FGF4 被用于治疗心血管病的可行性正在探究中;重组 FGF18 用于关节炎治疗正处于早期阶段。在癌症中很多的 FGF 旁分泌配体由于解除了管制,它们的过度表达刺激增生和血管的生长,这种作用又促进了癌症的发展。
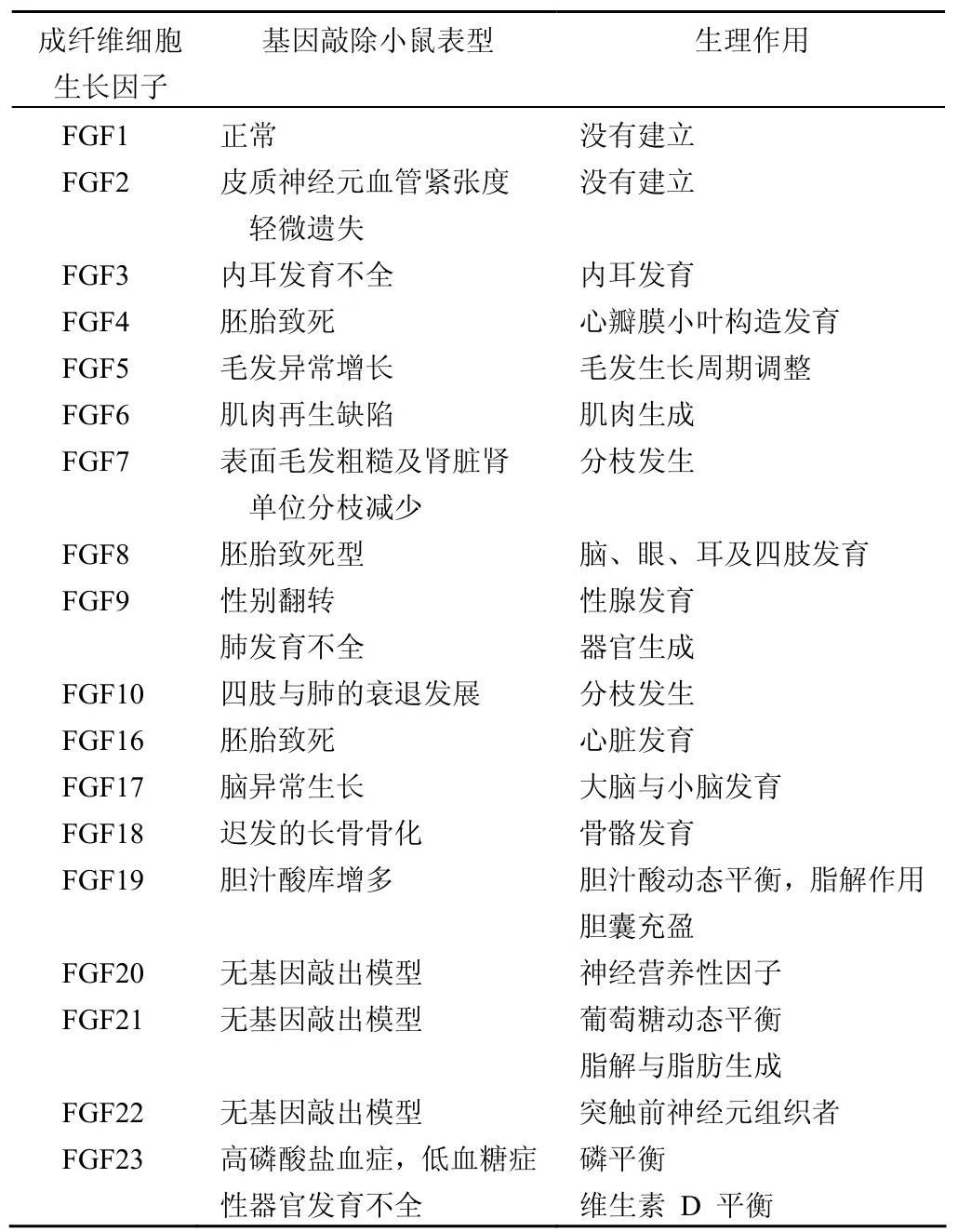
表 2 FGF 的生理学
3.1 FGF1 亚家族
FGF1 敲除和 FGF2 敲除的小鼠是有存活能力和繁殖能力的,并且 FGF1 敲除小鼠从表面上看完全正常,FGF1 和 FGF2 在生理学上的作用仍待探究。但是 FGF1 和 FGF2 在血管紧张度的维持上很有可能发挥着重要的作用,因为 FGF1 和 FGF2 的给予能够降低大鼠的血压,还能够恢复自发性高血压大鼠氧化亚氮合酶的活力。另外,从FGF2 敲除小鼠中分离出的血管对于血管收缩药的反应会减弱。但是 FGF2 敲除的小鼠经历了由于降低平滑肌收缩而引起的低血压之后,它们仍然能调节血压。
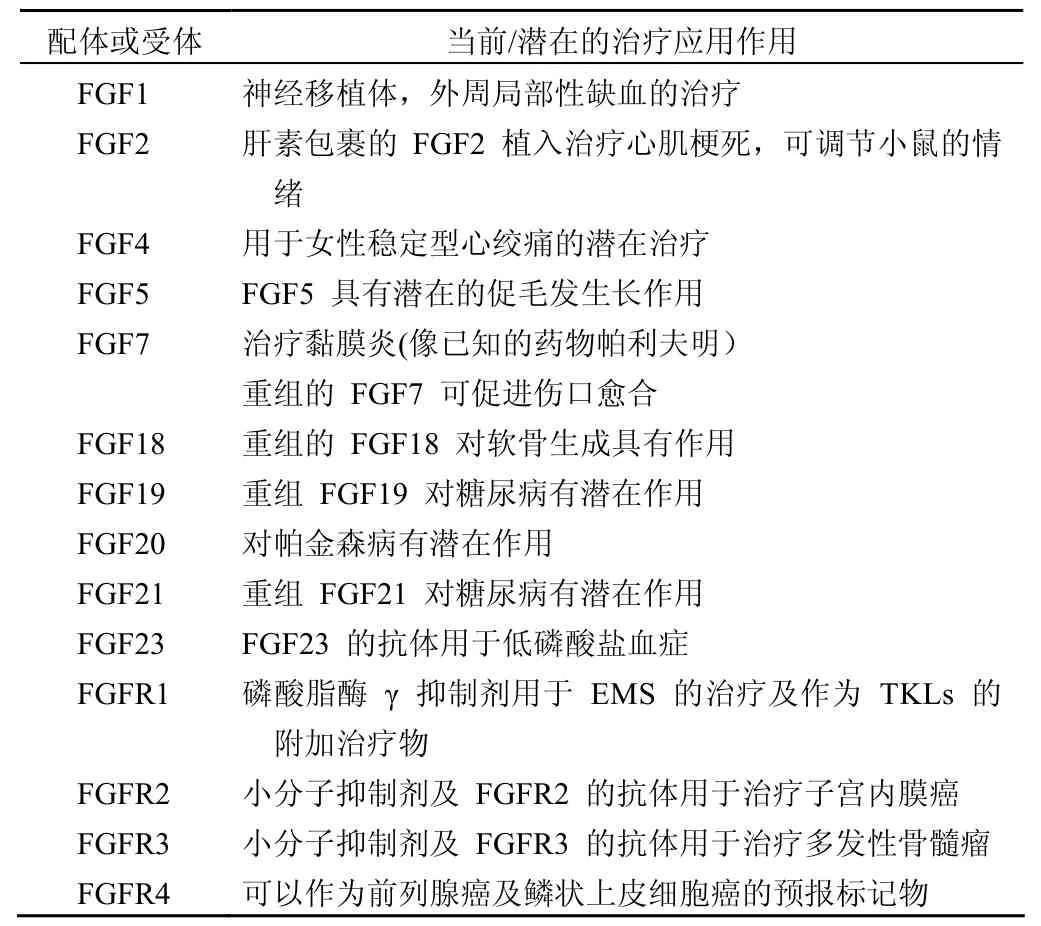
表 3 FGF 及 FGF 受体的应用
FGF2 生成血管的生物功能已经众所周知。外源性的 FGF2 刺激体内内皮细胞的迁移和增殖,具有抗细胞凋亡的活性,能刺激平滑肌细胞和成纤维细胞的有丝分裂发生,从而诱导血管外膜主侧支的发育。但是,FGF2 的过表达并不能导致血管的自发缺损,并且正常的血管化作用在同时敲除 FGF1和 FGF2 的小鼠中仍然存在,这些作用在生理学上的关联性还不清楚。显然,在生长因子介导的血管发生作用中存在一种高水平的补偿作用。
FGF2 其他可能的生理学上的作用包括炎症和哮喘:在炎症发生的过程中半胱天冬酶 1的应激作用导致了 FGF2 的释放,因为 FGF2 能使气道平滑肌细胞增殖以触发哮喘的发生。有趣的是,FGF1对于人类前脂肪细胞是一种增生的因子,并且可能对于所有的脂肪形成的调节都起重要的作用。
人类 FGF1 的病理生理学作用可能是由心脏缺血患者心包液的增长水平显示出来的。用 FGF1孵育内皮细胞导致了微血管的分枝,而配体也有抗细胞凋亡的作用,暗示了它在血管损伤修复功能方面的可能机制。
3.1.1 FGF1 的治疗潜力 FGF1 对心血管疾病具有潜在的治疗作用。I 期试验显示在冠状动脉旁路移植手术中,向心肌注射 FGF1 会促进支动脉和毛细血管的增生。FGF1 对外周循环也具有积极的作用。向腿部注射编码 FGF1 的质粒(Nv1FGF),在 I 期试验中可以改善末期下肢局部出血,在最近一个 II 期试验研究中,发现它可以减少重症患者的截肢率。有趣的是,在注射 Nv1FGF 或安慰剂之后,末端血压和氧分压没有大的变化,所以 FGF1的作用方式可能不是血管原性的。TAMARIS(治疗血管发生的动脉病治疗的随机国际研究)的临床III 期试验已经进行到对 Nv1FGF 的评价,而且将进一步阐明 FGF1 作用于全身的可能的机制。
FGF1 可以修复神经损伤。它能够使大鼠横断的脊髓恢复功能,还可以使六个月大的男孩由于臂神经丛撕裂导致瘫痪的四肢恢复部分运动功能。FGF1 给药对于慢性的横断的脊髓炎患者是有帮助的,并且它与腓肠神经移植物联合用药对于半身麻痹患者有部分恢复行走能力的作用。
3.1.2 FGF2 在治疗心脏血管疾病方面的潜力 FGF2 的快速灌注剂能够减少心肌局部缺血的缺血面积,改善踏车行为并且减少绞痛的频率。但是在 FGF 开始血运重建的实验中,在开始的几个月里,FGF2 的治疗相对于安慰剂组有一些改善作用,但是相对于安慰剂组持久的改善,FGF2 的改善是不能持久的。于是我们采取另一种治疗方案,向局部缺血的心肌植入含有吸附了 FGF2 的肝素颗粒,它能够减少局部缺血的面积和改善缺血相伴随的症状,并在接下来的三年中都会保持积极的作用。不足的是,这种治疗方法需要开胸手术,尽管它是在 I 期临床试验中使用 FGF2 能够起到持续有益作用的为数不多的几个成功方法之一。
经检测,FGF2 在外周循环中也有效。遭受跛脚痛苦的患者的内部血管接受了 FGF2 治疗,与接受安慰剂的患者相比,他们的小腿血流量有所改善。但是,在应用重组 FGF2 治疗间歇性跛行的血管发生研究中,并未发现有直接的改善,例如波峰所走的时间在统计学上最终是有重要意义的(表 2)。
3.1.3 FGF2 在治疗肿瘤方面的潜力 沙立度胺是一种 FGF2 诱导血管发生的抑制剂,在 II 期临床试验中已经证明了它对于雄激素自主转移的前列腺肿瘤患者或者肾病肿瘤患者有疗效。舒拉明,一种多聚硫酸盐的 naphylurea,通过拟态的肝素干扰 FGF 信号系统,在膀胱、肾和前列腺的肿瘤治疗中都有效果。用舒拉明治疗前列腺癌还能增强其他化疗药物的活性,例如多柔比星,可能是通过减弱 FGF1 和 FGF2 的活力来激活抗癌药物的广谱耐药性。舒拉明的高剂量应用能够达到临床上所要求的有价值的作用效果,但是也会引起凝血病。舒拉明是众多类肝素药物中唯一一例有效的。最有效果的类肝素类是 PI-88,这是一种在最近的临床试验中被广泛研究的类肝素酶抑制剂。
干扰素 α 和 β 能够在肾、膀胱和前列腺的人类细胞列中对 FGF2 起到下调的作用,因此,这些干扰素的使用能够抑制 FGF2 的表达和膀胱癌细胞的生长。一些证据显示,FGF2 信号系统的抑制能够通过抑制血管形成来减慢肿瘤的生长。但是,普遍来看,FGF2 的水平与肿瘤微血管的密度并无联系,显示出干扰素介导通过 FGF2 的抗肿瘤作用的机制可能不是单单以血管形成为基础的。1995年,ECOG(东方联合肿瘤学组织)试验药物“1684”的成功介导干扰素 α 治疗黑色素瘤患者。但是,由于干扰素的高毒性,它用于转移性黑色素瘤的生化治疗计划并没有被采纳。通过 FGF2 和FGF 受体 1 的反义引物靶向作用的基因沉默在人类黑色素瘤的模型中能够引起肿瘤面积的显著减少,但是普遍来说,反义技术的应用仍然面临许多挑战。
3.1.4 FGF2 在治疗其他疾病方面的潜力 据报道,由抑郁引起疾病的患者下调了 FGF 的转录水平,这是由血清素重摄取的禁制因素被恢复引起的。在大鼠中,当它们群居生活失败后,它们的海马的 FGF2 和 FGFR1 的信使 RNA 水平就会下调,脑室内的 FGF2 的调节会起到类似于抗抑郁药的效果。这些数据显示 FGF 信号系统的处理会对情绪障碍的治疗产生有益的作用。
FGF2 在软骨的顺势疗法的淤滞中也被研究,重组 FGF2 已经在伤口愈合患者的溃疡治疗中起到一些作用,并且最近的 II 期研究也显示出重组FGF2(曲弗明)在牙周炎患者的牙槽骨再生方面产生作用。
3.2 FGF4 亚家族
FGF4 在生长发育方面有着广泛的作用,包括心瓣膜小叶的形成及四肢的发育。FGF4基因敲除小鼠的胚胎植入子宫膜后的致死率与营养细胞增殖需要 FGF4 有关。FGF5 在毛发毛囊生长周期中的某一阶段起负调节的作用。FGF5 基因敲除小鼠除了具有异常长的毛发之外,无其他任何缺陷,FGF5 基因功能缺失导致的突变可以用来解释犬和猫的毛发变长的遗传变异现象。FGF6 在肌肉生成方面发挥着一定的作用,FGF6 基因敲除小鼠在肌肉再生能力上存在缺损,并伴随有显著的肌纤症,继而出现冰冻粉碎样损伤。
FGF2 的研究主要在于制备重组蛋白,而FGF4 的研究主要在于开发基因治疗的治疗手段。Alferminogene tadenovec(Ad5FGF4)是 FGF4 编码的,包括复制缺陷人腺病毒血清 5 型。I、II 期临床试验显示用药后改善了踏车运动能力,但是III 期试验显示有高安慰剂效应而被中断。III 期血管原基因治疗试验(AGENT)显示了治疗方法的安全性,病毒样症状或肝脏毒性较罕见。通过对所有患者的复查发现,该疗法对患者并无重大的作用,但重新分析后发现有性别特异性反应,这是对一部分减少安慰剂的女性跟踪试验后发现的。贲门治疗学已经开始 AWARE(在那些无血管再生能力的心绞痛妇女中的血管再生能力)的 III 期试验,来研究妇女 Ad5FGF4 的性别特异性反应。
3.3 FGF7 亚家族
FGF7 也称角质细胞生长因子,特异的表达存在间充质细胞中。FGF7–/– 小鼠可以存活并有生育能力,与对照组相比只表现轻微异常,如毛发粗糙,以及肾单位减少 30%。皮肤受损后 FGF7 水平可以提高 150 倍,同样,膀胱和肾损伤后 FGF7 水平也有所提高。
人类 FGF3 纯合子缺失可以引起遗传性耳聋并导致内耳发育不全。FGF3 这种特异性作用是非常重要的:FGF3–/– 的人只表现出少量牙体缺损。FGF10(也称为 KGF2)敲除的小鼠缺乏肢体和肺结构,同时也表现出其他分支器官的缺陷。FGF22、FGF7 和 FGF10 都参与突触形成,并在囊泡聚集和轴突分枝过程中发挥作用。
十二指肠狭窄综合征是一种常染色体疾病,是由 FGF10 功能缺失突变引起的,表现为听力缺失,牙齿异常以及泪腺和唾液腺发育不全。FGF7 过表达与炎症性肠病的炎症发生有关,提示 FGF7 具有代偿性作用。FGF7 和 FGF10 在牛皮癣皮肤中都有过表达。有观点认为 FGF7 和 FGF10 可以发挥雄激素介质的作用,因此在前列腺癌中可以通过促进上皮细胞增殖而发挥作用。
palifermin 是稳定性的 FGF7 N 端剪切体,已经通过美国 FDA 批准用于治疗骨髓移植患者放化疗后的口腔黏膜炎。在高剂量放化疗前以及造血干细胞移植后连续 3 d 注射 palifermin,缓解黏膜炎患者半耐受性可达 6 ~ 9 d,并减少 20% ~ 62%的 IV 级黏膜炎发生率。这样可以显著提高患者的生活质量,因为 IV 级口腔黏膜炎的患者存在严重的进食障碍。更重要的是,palifermin 可以减少患者阿片类镇痛药的用量,这表明其具有镇痛作用。palifermin 副作用较轻微而且是暂时性的,这种副作用是由治疗癌症或使用放化疗引起的。palifermin主要是通过促细胞增殖发挥作用。研究表明palifermin 增加上皮细胞作用可以至少维持 1 周。
FGF7 作用的其他机制包括上调 NRF2,它可以激活编码抗氧化酶的基因。炎症因子在黏膜炎的发病过程中发挥重要作用,FGF7 可能通过降低1 型辅助性 T 细胞因子向 2 型辅助性 T 细胞因子的比例以及通过诱导白介素 13 降低肿瘤坏死因子-α 和 INFγ 的水平而影响黏膜炎的发病机制。
palifermin 的新适应证正在研究之中。palifermin 可以降低移植物抗宿主反应的发生率并且增强动物的免疫功能。然而,这些结果尚未在临床实验中证实,也许是因为在治疗干细胞移植过程中,使用了对细胞毒性作用的甲氨蝶呤,其可以抵消 palifermin 的促增殖作用。FGF7 对损伤上皮细胞的治疗有提高损伤修复反应的作用,提示 FGF7在组织修复中的重要应用价值。
Human Genome Science 公司曾用重组 FGF10(repifermin)治疗溃疡性结肠炎和黏膜炎,但是2004 年由于几个临床实验的失败停止了对它的研究。
3.4 FGF8 亚家族
FGF8 参与脑、四肢、耳朵、眼睛的发育,同时,与 FGF17 一起,对前脑的发育起重要作用。FGF8 敲除小鼠不经过原肠(胚)形成时期,FGF17敲除小鼠的大脑、小脑结构发育表现异常。FGF18敲除小鼠降低了成骨标志的表达,并且延迟了长骨的骨化作用。FGF8 的功能缺失性突变影响 FGF与受体的结合或使 FGF8 降解,导致了凯式综合征的发生。凯式综合征是一种以嗅觉丧失和性腺功能减退为特征的发育障碍症。
最近默克正在研究 FGF18 对骨关节炎(一种软骨组织退化病)的治疗作用。FGF18 有合成软骨的作用:静脉内单剂量注射 FGF18,可以导致软骨在肋、气管、脊柱、关节囊处沉积。在鼠的骨关节炎模型中,关节内注射 FGF18 可促进软骨的形成。现在,默克正将 I 期临床试验和临床前数据相结合来研究人类骨关节炎进程。在老鼠乳腺癌和前列腺癌模型中,抑制 FGF8 的单克隆抗体已显成效。
3.5 FGF9 亚家族
FGF9 基因敲除小鼠表现出雄、雌性之间的性征颠倒,且肺发育不良,从而导致出生后很快就死亡。重要的是,起从上皮细胞到间质细胞信号传导作用的 FGF9 亚家族,功能与从间质到上皮信号传导的 FGF7 亚家族相反。FGF9 刺激间充质细胞增殖,而这些间质细胞生成 FGF3、FGF7、FGF10 和FGF22 亚家族的配体。因此,缺乏 FGF9 会扰乱间质与上皮细胞间的信号通路,这些信号通路可以协助调节这些 FGFRb 结合的配体。减少间充质细胞增殖进而导致生成 FGF3、FGF7、FGF10 和FGF22 亚家族配体的下降,这就是导致肺发育不全的原因。FGF16 基因敲除小鼠表现出巨大的心脏缺陷病。
在 FGF20 中的单核苷酸多态性最近已发现与帕金森病变相关,在他们的研究中显示,提高FGF20 在体内的翻译会导致 α-突触核蛋白之一的表达提高,这是帕金森病的一个病原体。目前,FGF20 在帕金森病中的潜在治疗应用正在研发。对大鼠中脑多巴胺神经元来说 FGF20 是一种神经营养因子,而猴子的干细胞经外源性 FGF20 和FGF2 处理后在体外分化成多巴胺能神经元,该神经元被移植到灵长类帕金森病模型后,缓解了帕金森病的一些症状。因此,尽管 FGF20 在活体内帕金森病因中没有治疗效果,但是体外实验显示了配体在干细胞生物学中的潜在作用。
FGF20(商品名 velafermin)被 Curagen 等用来考察缓解口腔黏膜病变的效果。虽然 I 期临床试验结果理想,但是该项目在 2007 年 10 月的第二阶段试验因未能达到治疗目标而被终止。
3.6 内分泌 FGF 成员:FGF19, 21, 23
内分泌配体 FGF19、FGF21、FGF23 是目前FGF 家族中药理学研究最有希望的成员。FGF 依靠 α-klotho 或 β-klotho 在相应的靶组织产生信号。klotho 蛋白和内分泌 FGF、同族 FGF 的结合能促进 FGF 配体和受体的亲和力(图 1)。
我们发现磷代谢和骨密度异常的 KL 小鼠和FGF23 敲除小鼠类似。这两种小鼠的类似性使我们发现 FGF23 需要 α-klotho 去活化 FGF 受体。类似的推理包括 β-klotho 对FGF19 信号系统的重要性。类似的表型也可以在 FGFR4–/– 老鼠上看到,它缺乏 FGF19 的主要受体和主要肝受体。在活体实验中已经证实 FGF19 需要 β-klotho 才能产生信号传导。一些过度表达也显示 FGF19 有可能和
α-klotho 结合,但这是在没有生理学条件下发生的。FGF21 是 β-klotho 依赖内分泌配体。
3.6.1 FGF19 抑制 FGF19 信号传导或 FGF19突变体蛋白还没与人类代谢疾病有相关性,神经性厌食症患者血清中 FGF19 水平与正常人是一样的。FGF19 转基因小鼠能随年龄增长而发展出肝癌,这个发现引起临床上的关注。但发现有效无毒的 FGF19 用药剂量还是可能的。有趣的是,基因研究表明抗 FGF19 单克隆抗体能在裸鼠体内抑止结肠癌的生长,并防止 FGF19 转基因小鼠中肝癌的发生。一些肿瘤生长抑制物是通过下调 β-klotho信号传导来实现功能的。这些进一步证实 FGF19能促成肿瘤形成,具有控制其有丝分裂功能的药理作用。
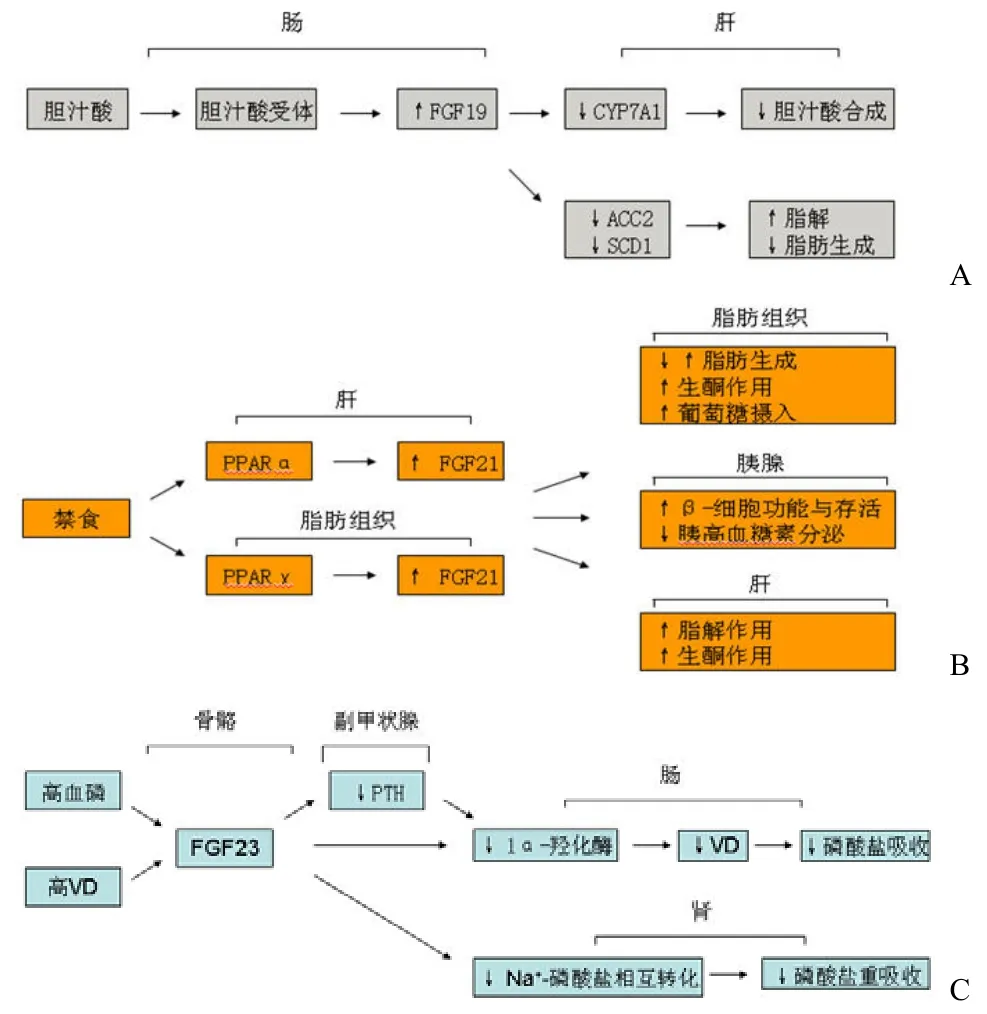
图 1 FGF19、FGF21 和 FGF23 生理学过程
如果最终证明 FGF19 对人类是安全的,那么FGF19 可能在治疗 2 型糖尿病及其相关疾病中成为一个重要的治疗选择。
3.6.2 FGF21 FGF21 在肝、胸腺、脂肪组织、胰岛 β-细胞表达。骨骼肌对 Akt 的活化反应诱导FGF21的表达。FGF21 代谢调节的功能首先发现能专一性促使脂肪细胞对葡萄糖摄入,这是通过上调葡萄糖转运载体 GLUT1 转录作用来完成的。不同糖尿病模型(ob-ob 小鼠,db-db 小鼠和 Zucker 肥胖糖尿病大鼠)连续 7 d 注射 FGF21 能降低血糖、甘油三酯、胰高血糖素和胰岛素水平。ob-ob 小鼠连续给药两周会减轻体重 20% 和改善高血糖症,这样的结果也在饮食诱导的肥胖症小鼠中发现。同样地,FGF21 转基因小鼠与对照组相比,显示具有改善胰岛素敏感性和血糖清除率,降低空腹葡萄糖水平、降低胰高血糖素水平、减轻体重、降低肝组织脂肪含量,增加棕色脂肪组织和小脂肪细胞的功能。FGF21 转基因小鼠与对照组动物相比,在多消耗 2 倍食物的情况下,能抵制食物诱导的肥胖症。实际上,FGF21 转基因小鼠与同窝出生的对照组相比明显较小,结果显示 FGF21 抑制STAT-5(信号转导和转录激活 5)-生长激素信号传导介质)。腺病毒载体导致的 FGF21 基因敲除小鼠会引起脂肪肝、血脂,降低血酮水平和增加胆固醇水平。这结果与猕猴实验资料一致,在猕猴实验中给药 FGF21 也减轻空腹血糖水平、甘油三酯、胰高血糖素和胰岛素。同时也观察到猕猴体重稍微减轻和改善脂蛋白的情况。给药 6 周后 HDL 水平比对照组高 80%。
FGF21 的另一个功能是保护 β-细胞功能。实验观察到小鼠在饥饿或生酮饮食下能诱导 FGF21在体内表达,同时禁食能诱导 FGF21 表达,但再喂养可以抑制这种表达,显然 FGF21 对禁食反应有作用。实际上,微点阵数据显示 FGF21 是酮症小鼠最明显的下调基因。
FGF21 调节禁食反应的分子机制仍在阐释中,目前已知过氧化物酶体增殖因子-α 激活受体(PPARα)调节 FGF21 活性。FGF21 也使禁食小鼠减少身体活动量和反应迟钝,表明 FGF21 也涉及到神经学上的禁食反应。
许多证据显示 FGF21 参与脂解作用。腺病毒介导的短发夹 RNA FGF21 敲除小鼠下调参与β-氧化以及甘油三酯积累的基因。尽管在 FGF21转基因小鼠中不会上调 PPARα 目的基因,增加的脂肪酶 mRNA 转录物数量可在肝中观察到。生酮介质能后转录下调 CPT1a(肉碱十六酰转移酶 1a)和 HMGDS2(羟甲基戊二酰-辅酶 A 合成酶 2)。有趣的是,与对照组相比,转基因小鼠尿液中肾上腺素较少,而不会通过儿茶酚胺促进 FGF21 的脂解活性。
FGF21 潜在的组织特异性活性使人们对研究它的受体特异性产生兴趣。FGFR1 和FGFR4 分别是白色脂肪组织和肝的主要 FGFR。实验表明FGF21 可以阻止 FGFR4 在体内过表达,但不能激活表达 β-klotho 的 H4IIE 肝实质细胞。这表明FGF21 活性对肝可能是间接的,暗示抑制 STAT5水平。因此,脂肪组织的 FGFR1 可能是 FGF21 的主要受体。
人体研究进一步阐明 FGF21 生物学概况。尽管生酮饮食会诱发 FGF21 在小鼠内表达,但在人体中却不是如此,人体生酮作用与 FGF21 无关且FGF21 水平只在长时间禁食 7 d 后增加。禁食时,FGF21 表达早期诱导发生在肝和脂肪细胞中,但在这些组织中不能特定地检测。在 76 个健康人中,人体中 FGF21 水平相差变化 250 倍,且与血清中甘油三酯、血糖、体重指数、年龄或性别无关。这些数据没有昼夜变化,且 FGF21 与胆汁酸的合成无关。人体中 PPARα 激动剂能诱导 FGF21 的表达。有趣的是,虽然急性空腹增加 FGF21 水平,但因神经性厌食症患有慢性营养不良而使 FGF21的表达水平下降。
FGF21 目前有巨大的治疗前景,不同于FGF19,它具有优良的安全性。FGF21 没有在细胞株上呈现出显著的有丝分裂潜力,且 FGF21 转基因小鼠到 10 个月的年龄时没有发现任何组织增生。此外,给药 FGF21 不会导致任何低血糖症或水肿,它们是目前糖尿病疗法两个常见的副作用。
FGF21 的生物学特征使这一配体有潜力解决2 型糖尿病的致病因素。在 2 型糖尿病的病原学中,饮食后胰高血糖素水平不适当地增加引起β 细胞凋亡和高血糖症,导致 β 细胞的逐渐缺失。研究已经表明,FGF21 增加 β 细胞存活,抑制胰高血糖素分泌。FGF21 能使血糖水平正常化并促进胰岛素敏感性,这种功能越来越被证实和引起人们重视。
FGF21 的药理性质尚待充分阐述,但通过激活一系列细胞反应,FGF21 具有长期保持配体存在的药效学活性。有趣的是,每天给药 FGF21 0.1 mg/kg使小鼠体内达到约 7.4 ng/ml 稳态水平情况下,仍能具有明显改善高血糖症的能力,而 FGF21 对减少重量方面的效应则需要增加剂量才能显现。
3.6.3 FGF23 最初发现 FGF23 主要存在于丘脑腹外侧核。同时发现佝偻病患者 FGF23 基因发生突变。此后,研究表明在体液中,FGF23 是维持磷平衡的主要调节物质。FGF23 主要在骨中表达,从骨进入血液循环中调节维生素 D 和肾脏中磷酸盐代谢,在 FGF23 过表达小鼠中,肾脏中磷酸盐重吸收受到抑制,主要是由于下调了肾脏近端管状上皮细胞表面 Iia 和 Iic 型磷酸钠复合转运体。FGF23 可以下调维生素 D 代谢酶活性,降低活化1,25-二羟维生素 D 水平。1,25-二羟维生素 D 可以增强肠道磷酸盐吸收,因此,FGF23 的作用也可以降低磷酸盐水平。
FGF23 也可以作用于甲状旁腺,抑制甲状旁腺素(PTH)分泌。PTH 可以增加磷酸盐从骨中的吸收并上调 1α 羟化酶水平,增加维生素 D 活化并提高肠道磷酸盐的吸收。更重要的是,FGF23 也可以维持甲状腺切除后大鼠血清磷的水平。
FGF23–/– 小鼠可以患高磷酸盐血症,1, 25-二羟维生素 D 水平升高,可导致低血糖,胸腺萎缩,生殖器发育不成熟以及血清中甘油三酯水平升高。FGF23–/– 小鼠的高磷酸盐血症和软组织钙化可以通过敲除编码 1α 羟化酶或维生素 D 的受体而缓解。这表明 1, 25-二羟维生素 D 水平升高是FGF23 缺陷小鼠高磷酸盐血症和钙化的原因。实际上,FGF23 可以通过维生素 D 受体依赖机制降低1α 羟化酶水平。高维生素 D 水平可以通过凋亡导致组织萎缩,因此,FGF23 可以通过抑制 1α 羟化酶来阻止维生素 D 诱导的凋亡。
FGF23 突变可以导致一系列疾病。常染色体显性所致的低磷酸盐血症佝偻病是由 FGF23 枯草杆菌蛋白酶前蛋白转化酶切割位点突变引起,这将使蛋白不易降解,因此,FGF23 生物活性的增加,将导致低磷酸盐血症。X 相关性低磷酸盐血症佝偻病是由 PHEX 非活性突变引起的,PHEX 基因可以编码 M13 家族非金属蛋白酶。这将通过一种未知的机制增加患者 FGF23 的水平。
肿瘤诱导的骨软化患者中 FGF23 水平与对照组相比高出 10 倍,肿瘤诱导的软骨病是一种肿瘤相关性肾脏磷酸盐消耗性综合征。这些现象以及肿瘤摘除后 FGF23 血清浓度降低表明 FGF23 在TIO 中磷酸盐消耗发病过程中发挥了重要作用。骨纤维异样增生症是一种正常骨组织被纤维化骨组织取代的疾病,骨纤维异样增生症患者循环系统中FGF23 的水平增高且与疾病严重程度呈相关性。
FGF23 信号减弱也可以导致疾病发生,家族性肿瘤钙沉着症是以高磷酸盐血症为特征的疾病,患者会发生钙化,多发生在关节中。虽然 FGF23–/–小鼠不发生大量钙化,但是 FGF23 的几个突变基因已经证明可以引起高磷酸盐血症性肿瘤钙化。这些错义突变可以破坏 FGF23 蛋白三维结构的稳定性并增加其降解的敏感性,因此,患者中 FGF23 浓度降低。
FGF23 在肾衰患者中可以增高 100 ~ 1000倍,可能是因为降低了肾清除率,也可能是在该疾病中起到补偿性作用。然而,慢性肾疾病中增高的FGF23 水平是有益还是有害尚有待讨论。无论如何,FGF23 水平与疾病的产生相关。透析治疗初期,血清 FGF23 水平增高提示慢性肾病患者一年死亡率显著增加。血清中 FGF23 水平可以提示继发性甲状旁腺功能亢进症的进展程度。
由于 FGF23 参与许多人类疾病的发生,因此将 FGF23 作为一个治疗靶点将具有很好的研究前景,很多研究已经证明了这种可能性。使用针对FGF23 的中和抗体可以使低磷酸盐血症小鼠血清中的磷酸盐和维生素 D 浓度正常化,这表明用FGF23 中和抗体治疗低磷酸血症的可能性。现已证明针对 FGF23 N 端和 C 端的中和抗体可以提高小鼠血清中磷酸盐和活化维生素 D 水平。其他可能的治疗途径包括使用 FGF23C 肽。FGF23 可以通过 C 端结合 klotho,因此,这些肽可以终止FGF-FGFR klotho 的结合以及减少 FGF-FGFR klotho 依赖的信号途径。目前,我们实验室正在研究可能的机制。FGF23 对慢性肾炎的作用尚不明了,但是该配体在此病中可能也起重要的药理作用。
4 结语
成纤维细胞生长因子有着广泛的生物学活性,它能促进神经再生,对神经元具有营养支持作用,在中枢神经系统创伤修复以及血管生成、创伤修复等方面亦具有重要的作用。FGFs 作为创伤愈合的组织修复因子已广泛应用于皮肤损伤、烧烫伤、溃疡(例如角膜溃疡、胃溃疡、十二指肠溃疡、溃疡性结肠炎等)、褥疮、整形美容后伤口等各种创伤创面的治疗。
FGF7 的促有丝分裂和细胞保护作用已经在临床上得到应用。其余的 FGFs,包括 FGF1、FGF2 和FGF4 已经开始了临床试验,希望最终能应用于治疗心血管疾病。FGF18 用于骨关节炎的治疗研究处于初期阶段;FGF5 抑制剂有望应用于治疗非自身免疫性脱发。FGFs 在情绪病中的准确作用有待进一步的研究,但部分治疗方案越来越关注 FGFs 的应用,其原因在于 FGFs 对于脑部的形成和神经的发育起作用。
以 PTKs 作为靶点的治疗已经较为常见。FGFR 特异性抑制剂在肿瘤治疗中的作用还有待观望。最近的研究表明,小分子 FGFR 抑制剂能引起肿瘤细胞死亡,这至少能证明 FGFR 抑制剂在抗肿瘤治疗中的前景。目前,拮抗 FGFR-PLCγ相互作用的抑制剂最具有开发潜力,因为联合使用该抑制剂和 RTK 抑制剂能延缓药物抗性的产生。
在内分泌配体中,凭借其在糖尿病动物模型中的良好疗效以及自身低毒的特点,FGF21成为家族中最有望开发成为药物的配体。由于 FGF23 与某些疾病相关,因而使得它成为诱人的治疗靶点。FGF23 抗体或者 FGF23 碳端多肽类似物最终有可能用于治疗人类低磷酸血液疾病。另一个研究热点是探讨 FGF23 在慢性肾病中含量增加的原因,进一步的研究可能是应用 FGF23 配体治疗肾病。
应用 FGF 治疗疾病这一策略在临床上相对较新,而 FGF 家族广泛的生物活性也有待充分阐明。因此,未来的研究还将致力于阐明其生物活性和发现更多的药理适应证。
[1] Beenken A, Mohammadi M. The FGF family: biology, pathophysiology and therapy. Nat Rev Drug Discov, 2009, 8(3):235-253.
[2] Li XK, Gong SL. Fibroblast growth factor: Basic and Clinical Study. Changchun: Jilin University Publishing House, 2007. (in Chinese)李校堃, 龚守良. 成纤维细胞生长因子基础与应用研究. 长春: 吉林大学出版社, 2007.
长江学者和创新团队发展计划;国家自然科学基金项目(30870755)
325035 温州,浙江省生物技术制药工程重点实验室/温州医学院药学院
李校堃,Email:xiaokunli@163.net
2010-08-11
10.3969/cmba.j.issn.1673-713X.2010.05.001
