三叶草遗传多样性的SRAP分析
2010-03-31李润芳惠荣奎邓瑞宁蔡明历
李润芳,惠荣奎,邓瑞宁,蔡明历,刘 焰
(华中农业大学植物科学技术学院,湖北武汉 430070)
红三叶(Tri folium pretense)、白三叶(T.repens)和杂三叶(T.hybridum)是豆科蝶形花亚科三叶草属植物,主要用作反刍动物的优良饲草饲料,在全世界栽培广泛[1],因其有固氮作用,耐寒耐瘠,可作为绿肥,在农牧生产中占有十分重要的地位[2]。其中红三叶因含有异黄酮而成为近年来倍受关注的药用植物[3]。目前,我国有关利用分子标记对三叶草种质资源研究的报道极少,仅有韩微波等[4]和安晓珂等[5]对三叶草的 RAPD反应体系进行优化的报道。SRAP即相关序列扩增多态性(sequence related amplified polymorphism)是一种新型的分子标记技术,最初是由美国加州大学蔬菜系 Li与Quiros博士于2001年建立,它通过独特的引物设计对ORF(open reading frames)进行扩增,该标记具有简便、稳定、高效、重复性好的特点。近年来,SRAP技术已开始应用于草种质资源遗传多样性研究,如在苜蓿(Medicago sativa)[6]、野牛草(Buchloe dactyloides)[7-8]、狗牙根(Cynodon dactylon)[9]和鸭茅(Dacty lis glomerata)[10]、垂穗披碱草(Elymus nutans)[11]等草种质均有报道,但有关三叶草SRAP标记遗传多样性的研究鲜见报道。不同种质的三叶草在药用成分含量、纤维产量和蛋白质品质等方面存在着明显的差异,仅凭三叶草的农艺性状如外观、叶型、株高、茎色等无法鉴定品种遗传基础的差异程度。因此,应用现代分子生物学技术尤其是分子标记技术对三叶草的遗传多样性和亲缘关系开展研究显得尤为重要。本研究将SRAP标记技术应用于三叶草种间及种内的遗传多样性及亲缘关系的研究,旨为三叶草的种质资源分类和遗传多样性提供分子水平上的依据。
1 材料与方法
1.1 试验材料本试验采用了11份三叶草材料,其中3份红三叶的染色体数目均为2n=14;1份杂三叶的染色体数目为2n=16;7份白三叶中,包括3份为叶型变异的材料,即变异植株上存在四出复叶、五出复叶或六出复叶,其中6份白三叶的染色体数目均为2n=32,而武汉野生白三叶中发现有1~3条B染色体[12]。以上供试材料均种植于华中农业大学标本园内,其染色体数目、名称及来源详见表1。

表1 供试材料染色体数目及来源
1.2 试验方法
1.2.1DNA提取 取田间嫩绿小叶未展开叶片约1 g,参照Paterson等[13]CTAB方法分别提取不同材料的总DNA,且用RNA酶去除RNA。
1.2.2PCR扩增 本试验所用的13条引物和PCR扩增参照林忠旭[14]的方法,5条正向引物与8条反向引物共组成40对(表2),引物由上海生工生物工程技术服务有限公司合成。PCR扩增在GeneAmp 9700热循环仪上进行。PCR的反应体系含DNA模板60 ng、引物用量各30 ng、dNTPs 各 200 μ mol/L、1 ×Reaction Buffer、MgCl2为1.5 mmol/L、T aq酶 1 U,总体积为 20 μ L。DNA扩增程序参照Li和Quiros[15]的方法。

表2 采用的SRAP引物名称及序列
扩增产物用6%PAGE胶分离,电泳缓冲液为0.5×TBE。电泳时,先用2 000 V电压预电泳至电流为30 mA,上样后用2 500 V恒压电泳1.5~2.0 h,电泳后银染。
1.2.3数据分析 根据PCR扩增结果,对每个样品获得的清晰且可重复出现的条带进行统计,按有带赋值为1,无带为0,输入EXCEL2003中建立1,0型数据矩阵,计算多态性位点百分率(percentage of polymorphic bands,PPB)。

利用NTSYS软件进行Jaccard遗传相似性系数分析,获得相似系数矩阵,用UPGMA(unweighted pair group method arithmetic average)进行聚类分析,构建亲缘关系树状图。
2 结果与分析
2.1 三叶草SRAP分析采用40对引物,共扩增出792条带,其中426条带具有多态性,多态性位点的百分率为53.8%,每对引物的多态性条带数为3~28,平均每对引物产生10.7条多态性带,表明三叶草属植物具有较高的遗传多样性。部分引物扩增结果见图1。
2.2 三叶草种间遗传关系11份材料的遗传相似系数为0.442~0.927,在阈值为0.568时,可将供试材料分为3个大类,可区分出白三叶、红三叶和杂三叶。7份白三叶的相似系数变化范围为0.804~0.927,平均相似系数为0. 854;3份红三叶的相似系数变化范围为0.759~0.837,平均相似系数为0.791。杂三叶与红三叶的亲缘关系相对较近,平均相似系数为0.576,与白三叶的亲缘关系相对较远,相似系数为0.509。拉迪诺白三叶和红三叶间的遗传相似性最低,亲缘关系最远。
2.3 三叶草种内遗传关系3份红三叶之间的遗传差异较大,11号巴东红三叶与9号澳大利亚红三叶、10号内蒙红三叶的遗传相似性系数分别为0.776和0.759(表3)。

图1 SRAP引物 Me14-Em6、Me3-Em12、Me3-Em13对11份三叶草DNA的PCR扩增电泳图

表3 不同三叶草的相似性系数
在白三叶的7份材料中,编号分别为1、2、3的海发、考拉和拉迪诺叶型正常植株的白三叶材料之间的遗传距离较近,它们首先聚类,其中1号材料与3号材料的遗传距离最近,相似系数为0. 927;4号材料武汉野生白三叶与上述3种白三叶的遗传距离较远;而编号分别为5、6、7的海发、考拉和拉迪诺白三叶叶型变异株出现了正常株所没有的特异性条带,且并未与它们各自的正常植株优先聚类(图2)。
3 讨论与结论
本研究7份白三叶草供试材料中,经检测海发、考拉、拉迪诺白三叶叶型正常株及它们的叶型变异株的染色体数目均为2n=32,而武汉野生白三叶中具有1~3条B染色体、染色体数目为2n=32+0~3B[12]。SRAP分子标记结果显示,生物学特征极为相似、染色体数目相同的海发、考拉及拉迪诺白三叶叶型正常株在DNA分子水平上存在一定的遗传多样性,但它们的相似系数较高,亲缘关系较近,优先聚类;而具有B染色体的武汉野生白三叶与上述3个白三叶品种的亲缘关系则相对较远。
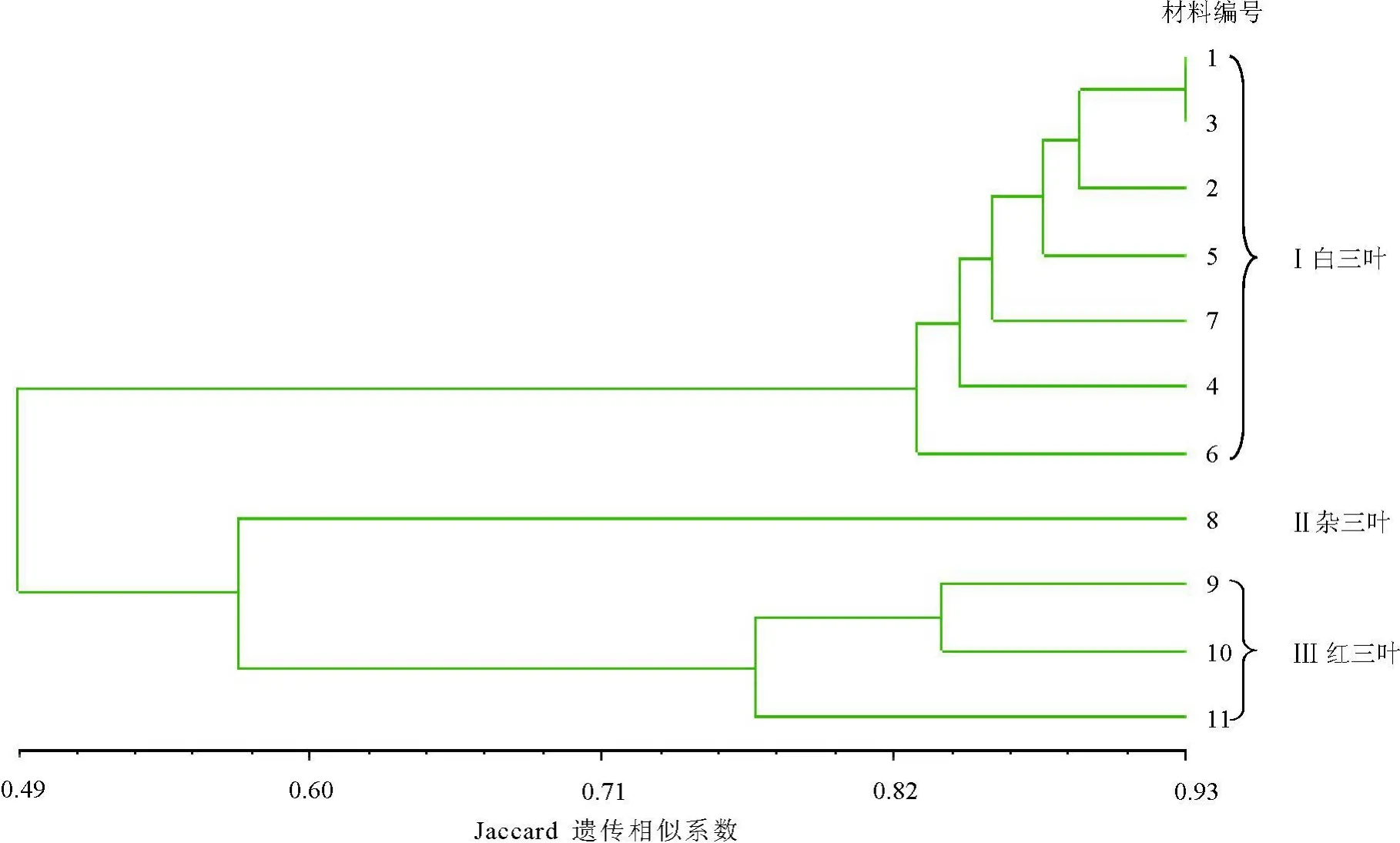
图2 基于SRAP标记的11份三叶草种质的聚类图
白三叶聚类分析结果还表明,海发白三叶正常叶型与考拉白三叶正常叶型优先于拉迪诺白三叶正常叶型聚类,在叶型变异材料中,海发叶型变异株与考拉叶型变异株也优先于拉迪诺叶型变异株聚类,说明海发白三叶与考拉白三叶的亲缘关系较近,而与拉迪诺白三叶较远。海发、拉迪诺、考拉白三叶的叶型正常株间的聚类优先于它们各自的变异株间的聚类,而且在它们的叶型变异株中均有特异带型出现,表明叶型变异株与叶型正常株在DNA分子水平上存在一定差异,这为探讨白三叶草叶型变异的原因提供了有益的证据。
红三叶的染色体数目有报道为2n=14、16、28、32[16-17],本研究所用的3份红三叶供试材料染色体数目均为2n=14[12]。SRAP分子标记结果表明,虽然它们的染色体数目相同,但澳大利亚红三叶与内蒙野生红三叶的遗传距离较近,与巴东红三叶的遗传距离相对较远,其相似性系数分别为0.776和 0.759。
本研究将SRAP技术应用于三叶草种质资源的遗传多样性研究,引物多态性条带较为丰富,得到了较好的扩增效果,证明三叶草属植物种间、种内均存在一定的遗传多样性,为三叶草的种质资源分类、遗传多样性以及亲缘关系的研究提供理论依据。
[1]杨珍,何丽君,王明玖,等.高加索三叶草×白三叶胚萌发条件的探索[J].草业科学,2009,26(1):50-54.
[2]张鹤山,刘洋,王凤,等.18个三叶草品种耐热性综合评价[J].草业科学,2009,26(7):44-49.
[3]黄胜阳,屠鹏飞.红车轴草异黄酮化合物的分离鉴定[J].北京大学学报(自然科学版),2004,40(4):544-549.
[4]韩微波,唐凤兰,张月学,等.三叶草 RAPD反应条件的优选[J].黑龙江农业科学,2006(1):10-12.
[5]安晓珂,赵来喜,郭树春,等.野火球 RAPD反应体系优化研究初报[J].中国草地学报,2008,30(3):74-77.
[6]Vandemark G J,Ariss J J,Bauchan G A,et al.Estimating genetic relationshipsamong historical sources of alfalfa germplasm and selected cultivars with sequence related amplified polymorphisms[J].Euphytica,2006,152:9-16.
[7]Budak H,Shearman R C,Parmaksiz I,etal.Molecular characterization of buffalograss germplasm using sequence-related amplified polymorphism markers[J].Theoreticaland Applied Genetics,2004,108(2):328-334.
[8]Budak H,Shearman R C,Parmaksiz I,et al.Comparative analysis of seeded and vegetative biotype buffalograsses based on phylogenetic relationship using ISSRs,SSRs,RAPDs,and SRAPs[J].Theoretical and Applied Genetics,2004,109(2):280-288.
[9]易杨杰,张新全,黄琳凯,等.野生狗牙根种质遗传多样性的SRAP研究[J].遗传,2008,30(1):94-100.
[10]曾兵.鸭茅种质资源遗传多样性的分子标记及优异种质评价[D].雅安:四川农业大学,2007.
[11]陈智华,苗佳敏,钟金城,等.野生垂穗披碱草种质遗传多样性的SRAP研究[J].草业学报,2009,18(5):192-200.
[12]李润芳.三叶草的细胞学、分子标记及多倍体诱导研究[D].武汉:华中农业大学,2007.
[13]Paterson A H,Curt L B,Wendel J F.A rapid method for extraction of cotton(Gossypiumspp.)genomic DNA suitable for RFLP and PCR analysis[J].Plant Molecular Biology Reporter,1993,11:112-127.
[14]林忠旭.棉花分子标记遗传连锁图构建和产量、纤维品质相关性状定位[D].武汉:华中农业大学,2005.
[15]Li G,Quiros C F.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theoretical and Applied Genetics,2001,103:455-461.
[16]张赞平,吴立宏,康玉凡.红三叶和白三叶草的核型分析[J].中国草地,1993(3):65-66.
[17]赵传孝,杨根凤.一些牧草和饲料作物的染色体数目[J].草原与牧草,1985(3):48-51.
