冬凌草甲素对 HL-60细胞 p53表达及细胞周期的影响
2010-03-30赵国英赵铭锋郭金将张海鸿
赵国英 赵铭锋 郭金将 张海鸿 王 晖
1滨州医学院附属医院儿科 滨州市 256603;2滨州医学院附属医院病理科
冬凌草甲素对 HL-60细胞 p53表达及细胞周期的影响
赵国英1赵铭锋2郭金将1张海鸿1王 晖1
1滨州医学院附属医院儿科 滨州市 256603;2滨州医学院附属医院病理科
目的 探讨冬凌草甲素对HL-60细胞p 53表达及细胞周期的影响。方法 通过PI染色,流式细胞仪检测细胞周期和凋亡峰,并以 RT-PCR检测p53基因的表达。结果 流式细胞仪分析显示,冬凌草甲素处理后使细胞周期发生变化:G1期、S期细胞的比例减少,G2/M期细胞的比例增加,凋亡的细胞数比例增多,且随着药物浓度的增加而逐渐增加。RT-PCR检测结果显示,20μmol/L冬凌草甲素作用后,与对照组相比,HL-60细胞 p53 mRNA水平显著升高,且随时间延长表现得更为明显。结论 冬凌草甲素能使细胞周期发生变化和p 53基因的上调,从而诱导细胞发生凋亡。
HL-60细胞;冬凌草甲素;细胞周期;p 53
白血病是儿童最常见的恶性肿瘤,近年来其疗效有很大提高,但仍有部分患儿对化疗不敏感和耐药,寻找新型治疗白血病的药物成为临床研究热点之一。研究证明,冬凌草甲素具有广泛的抗肿瘤作用,并对白血病细胞生长具有明显抑制作用[1~3],但其诱导白血病细胞凋亡的相关机制目前尚未明确。研究冬凌草甲素对白血病细胞的细胞周期变化及其对 p53基因表达的影响,对进一步探索冬凌草甲素促进白血病细胞凋亡相关机制具有重要意义。
1 材料与方法
1.1 实验材料 人白血病细胞株 HL-60细胞为山东大学血液病中心实验室冻存。冬凌草甲素 (Oridonin)购自上海卓康生物科技有限公司,规格 20 mg/支(C≥98%);RPMI-1640为美国 Hyclone公司产品;小牛血清为杭州四季青生物制品厂产品;二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)为 AMRESCO产品;膜联蛋白 V(Annexin V)凋亡检测试剂盒购于 Biovision公司,coll细胞分离液、磷酸盐(PBS)缓冲液 、PI(碘化丙啶)、Hoechst染液为 Sigma公司产品。
1.2 实验方法
1.2.1 细胞培养:HL-60细胞株复苏后悬浮生长于 RPMI-1640培养液中,内含 10%小牛血清,1 mmol/L谷胺酰胺及青链霉素各 100 U/L。于 37℃、5%CO2的饱和湿度孵箱中培养,每 2~3 d传代 1次,取对数生长期的细胞接种于含不同浓度冬凌草甲素的培养体系中进行实验,将细胞终浓度调至 2×105/L。
1.2.2 细胞形态学观察:收集经不同浓度(5、10、15、20、25μmol/L)的冬凌草甲素分别诱导处理 24、48和 72 h的 HL-60细胞,离心洗涤,制成细胞涂片,干燥后瑞氏-姬姆萨染色,光学显微镜下观察细胞形态。观察细胞处理后细胞膜细胞质及细胞核的变化,尤其观察凋亡小体形成等。
1.2.3 细胞周期检测:收集不同浓度冬凌草甲素作用 72 h后的 HL-60细胞,70%冷乙醇固定过夜,PBS清洗,200μl RNaseA 37℃水浴消化 30min,800μl PI避光染色 30 min,上流式细胞仪进行细胞周期和凋亡峰检测。未加药组为对照组。
1.2.4 RT-PCR检测 P53基因 mRNA的表达:收集对照组和药物作用组 (冬凌草甲素 20μmol/L作用48 h)细胞,Trizol裂解(GIBCO公司)提取细胞总RNA,特定蛋白分析仪测定 RNA纯度(A260/A280>1.75)。加入随机引物及 M-MuLV逆转录酶(MBI,FERMENTAS)合成 cDNA链。取 cDNA0.1 μg,加入 10×Bu ffer 2.5μl,25 mmol/LMgCl21μl,10 mmol/L dNTP 0.5 μl,20 pmol/μl的上下游引物各 0.5 μl,TaqDAN聚合酶 (Promega,5 u/μl)0.5 μl,灭菌双蒸水将反应体系补足至 25μl。ThermoPX2型 PCR仪进行扩增,以 β-actin作为内参照。
p53反应条件为:预变性 95℃ 2 min;变性 94℃45 s,退火 51.9℃ 1min,延伸 72℃ 90 s;最后延伸10 min,共 35个循环。β-actin反应条件为:预变性95℃ 2 min;变性 94℃ 45 s,退火 58℃ 1 min,延伸72℃ 1min;最后延伸 10min,共 35个循环。各引物序列分别为:p53上游引物为 :5'-TCTGGGACAGCCAAGTCTGT-3',下游引物为 5'-GGAGTCTTCCAGTGTGATGA-3',扩增产物为 435 bp;β-actin上游引物为:5'-CGCTGCGCTG-GTCGTCGACA-3',下游引物为5'-GTCACGCAC-GATTTCCCGCT-3',扩增产物为 619 bp。
扩增产物行 1.7%琼脂糖凝胶电泳,于 BIORAD Gel 2000凝胶成像仪上成像 Quantity One软件作半定量分析。
1.2.5 统计学分析:所得数据经 SPSS 10.0 forwindows软件处理,结果用±s表示。数据用方差分析和 Dunnett检验进行统计学分析,P<0.05表示差异有统计学意义。
2 结果
2.1 细胞形态学变化 空白对照组的 HL-60细胞光镜下细胞呈圆形,胞核居中占整个细胞绝大部分,染色质呈紫红色,胞浆量少;5μmol/L的冬凌草甲素处理的细胞形态学改变不明显;10μmol/L及其以上浓度的冬凌草甲素处理的 HL-60细胞形态有明显改变,甚至出现凋亡小体。以 20μmol/L的冬凌草甲素处理细胞 48 h后,大部分细胞出现凋亡的形态学变化。表现为:细胞皱缩、体积缩小,多数细胞染色质浓集、细胞核固缩,细胞内出现典型的凋亡小体,表现出现特异性的凋亡形态,见图 1、2。

图1 经 20μmol/L的冬凌草甲素处理 48 h的 HL-60细胞光镜下形态学改变 (W right-Giemsa染色,×1000)
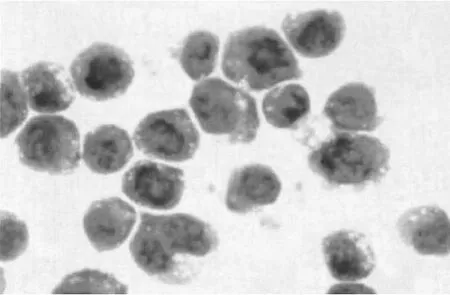
图2 未经冬凌草甲素处理的HL-60细胞光镜下形态(Wright-Giemsa染色,×1000)
2.2 冬凌草甲素对 HL-60细胞周期的影响 冬凌草甲素处理后在细胞周期 G1峰前出现亚二倍体峰,即亚 G1期峰(凋亡峰),该期细胞数占检测细胞的百分比,即为细胞发生凋亡的比例。亚G1期峰随着药物浓度的增加而逐渐明显,10~25μmol/L的冬凌草甲素各组凋亡率分别为(4.6±0.48)%,(13.7±1.8)%,(25.7±1.46)%,(32.1±1.63)%,亚 G1期峰随着药物浓度的增加而逐渐明显。
正常状态下的 HL-60细胞大多数处于 G1期,S期次之,G2/M期最少。冬凌草甲素处理后使细胞周期发生变化:G1期、S期细胞的比例减少,G2/M期细胞的比例增加,且随着药物浓度的增加而逐渐明显。结果表明,冬凌草甲素能够诱导 HL-60细胞发生凋亡,且随着药物浓度的增加而逐渐增加,见表 1。
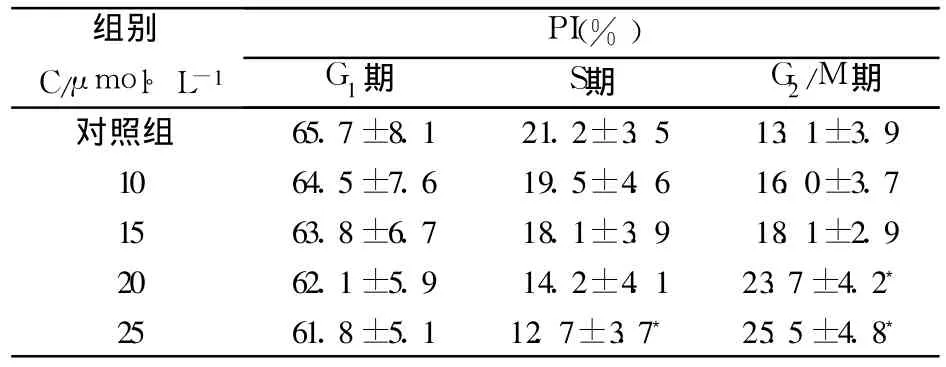
表1 不同浓度的冬凌草甲素对 HL-60细胞的PI检测
2.3 冬凌草甲素对 HL-60细胞 p53基因 mRNA表达的影响 RT-PCR结果显示,与对照组相比,冬凌草甲素作用后,HL-60细胞 p53 mRNA水平显著升高,且随时间延长表现得更为明显,见图 3。

图3 冬凌草甲素不同作用时间下HL-60细胞 p53mRNA的表达
3 讨论
凋亡受抑是急性白血病(acute leukemia,AL)发生、发展及化疗耐药、治疗失败的主要原因。故诱导凋亡疗法是消灭白血病细胞的一条新途径。近年来中药治疗急性白血病有很大的进展,许多植物成分在体外有诱导肿瘤细胞凋亡的作用,但临床应用尚在研究中。
冬凌草甲素(rebescensine A)是从冬凌草中进一步提取出来的一种四环二萜类化合物。其活性成分及药理作用机制比较复杂,总结文献资料[4,5]其抗癌作用机制可能与以下因素有关:①抗突变作用;②降低肿瘤细胞的钠泵转运活性;③增强其他抗肿瘤药物的疗效。既往研究资料显示冬凌草甲素对急性白血病 HL-60细胞具有明显的生长抑制作用,经冬凌草甲素处理后的 HL-60细胞,其端粒酶活性下降,bcl-2表达水平下调,部分细胞出现凋亡现象[3]。我们研究也证实了冬凌草甲素对 HL-60细胞的生长抑制作用,并且在 10~25μmol/L范围内的冬凌草甲素对 HL-60细胞生长抑制作用有浓度-时间依赖性。20μmol/L的冬凌草甲素处理细胞 48 h后,大部分细胞出现凋亡的形态学变化(见图 1、图 2)。在膜联蛋白 V-FITC及 PI染色,流式细胞仪分析中发现:在相同作用时间下,HL-60细胞凋亡率随药物作用剂量的增高而升高,并且在冬凌草甲素对 HL-60细胞周期影响的试验中亦得到证实。
凋亡的过程受到多种因子调控,p53是其中一个重要调控因子,在维持细胞正常生长、抑制恶性增殖过程中起着重要作用。p53作为一个转录因子对DNA损伤做出反应,并诱导下游蛋白如 p21、Mdm2和 Bax的表达,这些下游蛋白可以调节细胞周期和凋亡。正常的 p53在细胞里的功能有多种,包括DNA结合功能、细胞循环过程的控制、DNA修复、细胞调亡控制、参与细胞分化和基因的可塑性调控[6]。但目前研究最多的有两种,一种是抑制细胞分裂,让其停留在细胞周期的 G1期,另一种是使细胞凋亡,此两种功能与 p53转录的能力均有一定程度的联系。
p53介导凋亡的机制可能是通过以下几点:①在凋亡过程中线粒体膜失去完整性,接着细胞色素C释放入胞浆,引起 caspase断裂激活。抗凋亡蛋白Bcl-2和促凋亡蛋白 Bax可调节细胞色素 C释放。Bax显示在它的促进子内有某些 p53结合位点,它对 DNA损伤的上调反应并增加p53[7]。p53介导的细胞凋亡能被 Bcl-2/Bcl-x抑制。②活性氧 (ROS)是线粒体损伤和凋亡的有力的激活剂。许多蛋白能增加 ROS的产生,因此氧化应激能被 p53诱导[8,9]。③Fas通过 FasL三聚化作用被激活继而导致caspase激活。Fas过度表达能引起凋亡且被认为是p53依赖的,但是机制尚不清楚[10]。p53可以上调Fas并诱导 Fas介导的死亡[11]。p53它通过停止细胞生长和诱导细胞凋亡而发挥其肿瘤抑制者的功能[12,13]。它是细胞生长的“监控器”,是细胞生长重要的负调节蛋白,在细胞受到射线或某些药物作用发生 DNA损伤的情况下,p53蛋白能阻止细胞周期停滞在 G1期,使细胞有足够的时间修复损伤,恢复正常状态,重新进入细胞周期[14,15]。若损伤不能修复,它可启动细胞的程序性死亡过程引起细胞凋亡,从而保证有癌变倾向的细胞不再存活下去。在正常细胞里 p53的表达量很低,因此它不足以使细胞停止生长或死亡。然而当细胞受到某种损伤如 DNA损伤或缺氧后,p53的表达会急剧升高,从而使细胞停止在 G1期,使受损细胞修复或发生凋亡。wtp53是 G1期 DNA损伤的检查点,充当“安全卫士”监视着细胞基因组的完整性[16]。滕理送等[17]用电穿孔法将正向携带野生型 p53基因 cDNA全长的反转录病毒重组质粒(Dol p53)导入 p53基因突变的人肠癌细胞 SW1116,wtp53的表达使 SW1116细胞的G418抗药性克隆形成减少,细胞生长速度较对照细胞明显减慢,细胞增殖周期 G1期增加、S期下降。我们的实验研究中冬凌草甲素处理后细胞周期发生的变化:G1期 S期细胞的比例减少,G2/M期细胞的比例增加,亦证实这一观点。结果表明,冬凌草甲素能够诱导 HL-60细胞发生凋亡,且随着药物浓度的能够诱导 HL-60细胞发生凋亡,且随着药物浓度的增加而逐渐增加。
本实验研究表明,冬凌草甲素作用后,HL-60细胞 p53mRNA水平显著升高,且随时间延长表现得更为明显,本研究揭示,冬凌草甲素在诱导 HL-60细胞凋亡的过程中伴有 p53基因上调和 G1期 S期细胞的比例减少,G2/M期细胞的比例增加,表明此基因参与冬凌草甲素诱导 HL-60的细胞凋亡,并提示冬凌草甲素的凋亡诱导作用可能部分通过 p53途径实现。同时也说明,冬凌草甲素可能是一种潜在的白血病治疗药物,这些资料为进一步进行临床前的动物实验以及冬凌草甲素广泛应用于临床提供了更有力的理论及实验依据。
[1] 吴孔明,张覃沐,王庆瑞,等.冬凌草甲素对肿瘤细胞钠泵活性的影响[J].肿瘤防治研究,1994,21:208-209.
[2] 杨胜利,韩绍印,张巧,等.冬凌草甲素抗突变性研究[J].癌变·畸变·突变,2001,13(1):8-10.
[3] 申家英,杨 波.冬凌草甲素对HL-60细胞的生长抑制作用及其对细胞端粒酶活性的调节[J].白血病·淋巴瘤,2003,12(4):224-226.
[4] Suzuki A,Ito T,Kawano H,et al.Survivin initiates procaspase3/P21 complex fomation as a result of interaction with CDK 4 to resist Fasm idiated cell death[J].Oncogene,2000,19(10):1346-1353.
[5] Ikehara M,Oshita F,Kaneda Y,et al.Expression of survivin correlated with vessel invasion isamarker of poor prognosis in small adeno-carcinoma of the lung[J].Oncol Rep,2002,9(4):835-838.
[6] Hofseth LJ,Hussain SP,Harris CC.p53:25years after its discovery[J].Trends Pharmacol Sci,2004,25(4):177-181.
[7] Lotem J,Peled-KM,Groner Y,et al.Cellular oxidativestress and the control of apoptosis by wild-type p53 cytotoxiccompounds and cytokines[J].Proc Natl Acad Sci USA,2006(93):9166-9171.
[8] Johnson TM,Yu Z,Ferrans VJ,et al.Reactive oxygen speciesare downst ream mediators of p53 dependent apoptosis[J].Proc Natl Acad Sci USA,1999(15):11848-11852.
[9] Owen-shaub LB,Zhang W,Cusack JC,et al.W ild type human p53 and a temperat ure sensitivemutant induced Fas/Apo-1expression[J].Mol Cell Biol,2003(15):3032-3040.
[10] Evan G,Littlewood T.A matter of life and cell death[J].Science,2003,281(5381):1317-1322.
[11] King KL,Cidlowski JA.Cell cycle regulation and apoptosis[J].Annu Rev Physiol,1998(60):601-617.
[12] Ko LJ,Prives C.P53 puzzle and paradigm[J].Genes Dev,1996(10):1054-1072.
[13] Gottlieb TM,Oren M.P53 in growth control and neoplasia[J].Biochim Biophys Acta,2005(1287):77-102.
[14] El-Deiry WS,Tokino T,Velculescu VE,etal.WAFI,a potential mediator of p53 tumor suppression[J].Cell,2003(75):817-825.
[15] Zhang H,Hannon GJ,Beach D,et al.p21-containing cyclinkinases exist in bot h active and inactive states[J].Genes Dev,2004(8):1750-1758.
[16] Baror RL,Ruth M,Segel Lee A,et al.Generation of oscillations by the p53 Mdm2 feedback loop:a theoretical and experimental study[J].Proc Natl Acad Sci USA,2000,97:1125-1128.
[17] 滕理送,郑树,曹江,等.野生型 p53基因对人肠癌细胞的抑瘤效应[J].中华实验外科杂志,1997,14(3):146-147.
Effects of rebescensine A on HL-60 cell expression of p 53 and cell cycle changed
ZHAO Guoying1ZHAO Mingfeng2GUO Jinjiang1ZHANG Haihong1WANG Hui1
1 Department of Pediatrics Affiliated Hospital of Binzhou Medical University,Binzhou 256603;2 Departnent of Pathology,Affiliated Hospital of Binzhou Medical University
ObjectiveTo investigate the effects of rebescensine A on HL-60 cell expression of p53 and cell cycle.MethodsHL-60 cells in culturemedium in vitro were given different concentrations of rebescensine A.Propidium Idide(PI)binding and flow cytometry were used to detect cell cycle and apoptotic peak;And RT-PCR was used to observe the expression of p53.Resu ltsMarked morphological changes of cell apoptosis were observed.Cell cycle changed after the cells treated by rebescensine A:The ratio of G1and S-phase cells decreased,G2and M-phase cells increased and apoptotic cells count increased along with the increasing concentrations of rebescensine A.Theup-regulated of p 53mRNA were showed by RT-PCR and changed more obviously with prolongation in HL-60 cells treated by rebescensine A 20μmol/L.ConclusionRebescensine A could change the cell cycle ofHL-60 cells,and the up-regulated of p 53 gene,which induced apoptosis.
HL-60 cells,rebescensine A,cellcycle,p53
R562.2
A
1001-9510(2010)01-0012-04
2009-10-13)
