高效液相色谱法测定刺玫果中金丝桃苷的含量
2010-03-24钟方丽王晓林敬采月
钟方丽,王晓林*,敬采月
(吉林化工学院化学与制药工程学院,吉林 吉林 132022)
高效液相色谱法测定刺玫果中金丝桃苷的含量
钟方丽,王晓林*,敬采月
(吉林化工学院化学与制药工程学院,吉林 吉林 132022)
目的:建立刺玫果中金丝桃苷含量测定的方法。方法:采用高效液相色谱法测定,色谱柱为Shim-pack VP-ODS C18(4.6mm×150mm,5μm);以甲醇(A)和0.2%磷酸溶液(B)进行梯度洗脱,流速为1.0mL/min;进样量20μL;检测波长360nm;柱温40℃。结果:金丝桃苷进样质量浓度在4.76~76.16μg/mL范围内呈良好的线性关系,r=0.9993。平均回收率为98.06%,RSD为1.72%。结论:采用高效液相色谱法测定刺玫果中金丝桃苷的含量,方法简便、准确,可以用于刺玫果的质量控制。
刺玫果;金丝桃苷;高效液相色谱法
刺玫果系蔷薇科蔷薇属植物山刺玫(Rosa davurica Pall.)的成熟果实,又名野蔷薇果,是一种经济价值极高、药食同源的野生果类。广泛分布于东北及内蒙、山西等省。《中药大辞典》谓其有健脾理气、养血调经的作用[1]。刺玫果含有大量的维生素、氨基酸、黄酮类和鞣质类化合物[2],现代药理学表明,黄酮类物质可加快血液流速,降低血液黏度,用于治疗脑血栓、脑动脉硬化及冠心病等,其中黄酮类成分——金丝桃苷对心肌缺血、脑缺血损伤均有保护作用,还具有调节免疫作用[3]。
目前,以天然刺玫果为主要成分的保健药物、保健食品、功能性饮料日益被人们所重视并广泛开发[4]。尚未见有关刺玫果中金丝桃苷含量测定的研究,本实验采用HPLC法测定刺玫果中金丝桃苷的含量,建立刺玫果中金丝桃苷的含量测定方法,为刺玫果的质量控制、综合利用与开发提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
刺玫果由延吉市林业局提供,经吉林化工学院生药学教研室鉴定为蔷薇科蔷薇属植物山刺玫(Rosa davurica Pall.)的成熟果实。
金丝桃苷标准品(批号111521-200303) 中国药品生物制品检定所;甲醇(色谱纯) 天津大茂化学试剂公司;水为重蒸馏水;其余所用试剂均为分析纯。
1.2 仪器与设备
LC-20AB 型液相色谱仪、SPD-M20A 二极管阵列检测器 日本岛津仪器有限公司;Shim-pack VP-ODS C18色谱柱;BP211D 型电子天平 Sartorius公司;RT-08手提式高速中药粉碎机 大德乐机械有限公司;JBT/CYCL型超声波药品处理机 济宁金百特电子有限责任公司。
1.3 方法
1.3.1 色谱条件
色谱柱为Shim-pack VP-ODS C18(4.6mm×150mm,5μm);流动相:A为甲醇,B为0.2%磷酸溶液(V/V),程序为0~20min,10% A;20~40min,40%~70% A;40~55min,70%~90% A;55~60min,90%~10% A[5-7];流速:1.0mL/min;柱温:40℃;进样量:20μL;检测波长为 360nm。
1.3.2 标准品溶液的制备
精密称取金丝桃苷标准品适量,加甲醇配制成95.20μg/mL的溶液,作为标准品溶液[8-9]。
1.3.3 供试样品溶液的制备
精密称取2.50g刺玫果药粉,加入20mL甲醇,超声提取30min,过滤,收集提取液,滤渣加15mL甲醇,超声提取20min,过滤,合并两次提取液,过滤,转移至50mL容量瓶中并用甲醇稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,取续滤液,作为供试品溶液。
2 结果与分析
2.1 色谱条件的选择
2.1.1 检测波长的选择
文献报道,采用高效液相色谱法测定金丝桃苷含量时,一般分别在350[6]、355[10]、360[11]、370nm[12]的检测波长条件下测定,本实验采用二极管阵列紫外检测器对金丝桃苷的标准品溶液在波长200~500nm范围内进行检测,发现金丝桃苷在360nm波长处有特征吸收峰,金丝桃苷在360nm处灵敏度较高,峰形较好,根据实验结果和参考文献[8]确定360nm为检测波长。
2.1.2 流动相条件的选择
本实验选择的流动相为甲醇-0.2%磷酸溶液[6],实验中分别考察等度洗脱和梯度洗脱两种方式,等度洗脱主要考察甲醇-0.2%磷酸溶液配比分别为35:65、40:60、50:50时金丝桃苷峰的出峰时间和峰型情况,结果配比为35:65时峰型较差,配比为50:50时出峰时间太短为3.287min,配比为40:60时出峰时间为6.8min,峰型较好,故选择甲醇-0.2%磷酸溶液(40:60)为流动相,虽然采用等度洗脱的方式出现的色谱峰型良好,标准品出峰时间在6.8min左右,但由于刺玫果为天然植物,成分复杂,在这样短的时间内可能会有一些物质没有分开而堆积到一起,金丝桃苷峰与其他组分不能有效分离,这样就不能保证实验的真实性和可靠性,于是在等度洗脱的基础上又进行梯度洗脱,而梯度洗脱金丝桃苷出峰时间约为26min左右,峰型良好,与其他组分能够有效分离,故以甲醇(A)和0.2%磷酸水溶液(B)为流动相进行梯度洗脱,并且对流动相的配比进行探索,结果以甲醇(A)和0.2%磷酸水溶液(B)为流动相进行梯度洗脱,程序为0~20min,10% A;20~40min,40%~70% A;40~55min,70%~90% A;55~60min,90%~10% A,在此条件下样品与标准品均分离较好,整个洗脱时间为65min,出峰时间约为26min左右,故选择在上述流动相条件下进行研究。
2.1.3 分离柱的选择
根据参考文献[10],选择的色谱柱为Shim-pack VPODS C18(4.6mm×150mm,5μm)。
2.2 供试品溶液制备方法的选择
采用70%乙醇加热回流提取,甲醇超声提取两种方法处理样品,结果发现,两种方法所测出的金丝桃苷含量相差很少,但是甲醇超声提取方法较70%乙醇加热回流提取操作简单、损失较少,故确定超声提取方法作为供试品溶液处理方法。
2.2.1 提取次数的选择
精密称取5.0302g刺玫果粉末,分别提取1、2、3、4次,每次加入20mL甲醇,每次超声提取30min,过滤,收集各次提取液,将各次提取液分别置于50mL容量瓶中,加甲醇定容,进行含量测定。由图1可知,第1、2次提取液测得的金丝桃苷峰面积分别为3703.5、1942.4,经计算提取率达97.5%,结果表明超声提取2次刺玫果中的金丝桃苷几乎提取完全。

图1 超声提取次数对金丝桃苷提取效果的影响Fig.1 Effect of ultrasonic extracting times on extraction efficiency of hyperin
2.2.2 提取时间的选择
在提取次数对提取效果的影响实验的基础上,进一步考察提取时间对提取效果的影响,精密称取5.0280g刺玫果粉末,提取2次,每次加入20mL甲醇,第1次提取30min,第2次分别提取10、20、30、40min,将第2次的提取液分别置于50mL容量瓶中,加甲醇定容。用微孔过滤器(0.45μm)过滤,取滤液作为供试品溶液,进行含量测定。由图2可知,超声提取20min,金丝桃苷含量与30min和40min很接近,故超声时间定为20min。

图2 超声提取时间对金丝桃苷提取效果的影响Fig.2 Effect of ultrasonic extracting time on extraction efficiency of hyperin
2.2.3 提取溶剂用量的选择
在提取次数、提取时间对提取效果影响的基础上,考察甲醇用量对提取效果的影响,精密称取5.0178g刺玫果粉末,提取2次,第1次加入20mL甲醇,提取30min,第2次分别加入甲醇10、15、20、25mL,提取20min,将第2次的提取液分别置于50mL容量瓶中,加甲醇定容,用微孔过滤器(0.45μm)过滤,取续滤液作为供试品溶液,按2.1节色谱条件进行含量测定。

图3 溶剂量对金丝桃苷提取效果的影响Fig.3 Effect of different volume of solvent on extraction efficiency of hyperin
由图3可知,溶剂用量为15、20、25mL时测得的金丝桃苷的量相差不大,因此选用15mL提取。最终确定供试品溶液的制备方法[6,13]为超声2次,第1次加入20mL甲醇,超声30min,第2次加入15mL甲醇,超声20min,合并提取液,过滤,转移至50mL容量瓶中并用甲醇稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,作为供试品溶液。
2.3 方法学考察
2.3.1 线性范围考察
精密吸取金丝桃苷标准品溶液(95.20μg/mL)0.5、1.0、2.0、4.0、6.0、8.0mL,分别置10mL容量瓶中,加甲醇稀释至刻度,摇匀,即得质量浓度4.76、9.52、19.04、38.08、57.12、76.16μg/mL的梯度溶液。分别精密吸取20μL,进行测定,记录峰面积,以金丝桃苷标准品进样质量浓度C(μg/mL)为横坐标,峰面积A为纵坐标,绘制标准曲线[14]。得回归方程A=453.11C-331.80,r=0.9993,结果表明金丝桃苷进样质量浓度在4.76~76.16μg/mL范围内呈良好的线性关系。
2.3.2 精密度实验
精密吸取质量浓度为19.04μg/mL的标准品溶液,连续进样5次,测定金丝桃苷吸收峰面积,RSD为1.06%,结果说明精密度良好。实验结果见表1。
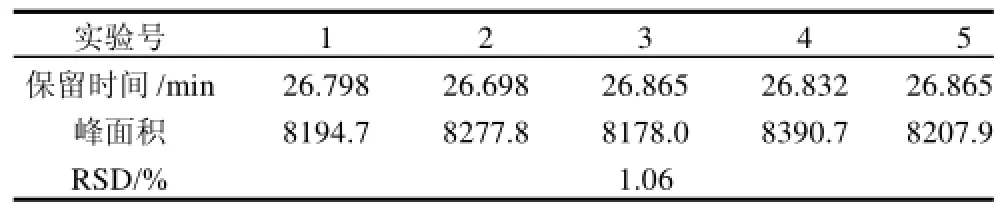
表1 精密度实验Table 1 Precision test of this method
2.3.3 稳定性实验
取同一供试样品溶液,分别于0、2、4、6、8h进行测定,记录金丝桃苷吸收峰的峰面积,结果RSD为0.72%。结果表明样品溶液在8h内稳定。实验结果见表2。

表2 稳定性实验Table 2 Stability test of this method
2.3.4 重复性实验
取同一批刺玫果药粉,按1.3.3节方法制备5份供试品溶液,依法测定金丝桃苷的含量,记录金丝桃苷吸收峰的峰面积,结果RSD为1.60%。说明此方法重复性较好(表3)。

表3 重现性实验数据Table 3 Reproducibility test of this method
2.3.5 加样回收率实验
取已知含量(139.51μg/g)的样品5份,精密称定,分别精密加入金丝桃苷标准品溶液3.6mL,按1.3.3节方法制备5份供试品溶液,按1.3.1节色谱条件测定,结果表明平均回收率为98.06%,RSD为1.72%实验结果(表4)。

表4 回收率实验结果Table 4 Results of recovery experiments
2.4 样品测定

图4 金丝桃苷标准品溶液色谱图Fig.4 HPLC chromatogram of hyperin reference solution

图5 供试品溶液色谱图Fig.5 HPLC chromatogram of hyperin sample solution
分别取标准品溶液,供试品溶液各20μL,注入液相色谱仪,记录色谱图,结果见图4、5。在此条件下供试品溶液中金丝桃苷的保留时间约为26min左右,分离度大于1.5,理论板数按金丝桃苷峰计算为7862,说明色谱条件适合本品的测定。
取3份刺玫果样品,按1.3.3节方法制备供试品溶液,测得金丝桃苷的含量分别为133.91、139.51、141.01μg/g。
3 结 论
本实验建立的含量测定方法操作合理简便,方法精密度高,重复性及线性关系良好,回收率较好,可为含刺玫果的中药制剂和功能性食品的含量测定提供依据。
[1]江苏新医学院. 中药大辞典: 上册[M]. 上海: 上海科学技术出版社, 1985.
[2]张国贞, 李芳兰, 张金梅. 野生刺玫果营养成分分析及评价[J]. 食品研究与开发, 2001, 22(6): 38-40.
[3]李艳, 曹学丽, 付鹏, 等. 贯叶金丝桃苷活性成分及其分离纯化与检测方法的研究进展[J]. 药学进展, 2007, 32(1): 15-20.
[4]郭向红, 张鹏, 匡海学, 等. 刺玫果口服液中没食子酸甲酯葡萄糖苷的含量测定[J]. 中医药信息, 1999, 16(3): 53-54.
[5]易剑锋. HPLC法测定金花葵花中金丝桃苷的含量[J]. 宜春学院学报, 2007, 29(4): 72-73.
[6]郑一敏, 胥秀英, 傅善权, 等. HPLC测定金荞麦中的金丝桃苷[J]. 华西药学杂志, 2008, 23(6): 724-725.
[7]李丹, 程岚, 康廷国. 高效液相色谱法测定山楂叶提取物中金丝桃苷的含量[J]. 时珍国医国药, 2006, 17(3): 372-373.
[8]郑一敏, 胥秀英, 杨艳红, 等. HPLC法测定柿蒂中金丝桃苷与齐墩果酸的含量[J]. 药学实践杂志, 2005, 23(3): 163-165.
[9]傅善权, 郑一敏, 杨艳红, 等. 高效液相色谱法测定青果中金丝桃苷的含量[J]. 天然产物研究与开发, 2005, 17(增刊1): 67-68.
[10]李东峰, 赵军, 王建华. 高效液相色谱法测定山楂中金丝桃苷的含量[J]. 新疆医科大学学报, 2008, 31(12): 1679-1680.
[11]赵艳普. HPLC测定照山白浸膏片中金丝桃苷的含量[J]. 中成药, 2008, 30(3): 456-457.
[12]陈岳蓉, 刘海青. 反相高效液相色谱法测定地榆中金丝桃苷的含量[J]. 时珍国医国药, 2008, 19(2): 455-456.
[13]郑一敏, 胥秀英, 杨艳红, 等. HPLC测定菟丝子中的金丝桃苷与槲皮苷的含量[J]. 华西药学杂志, 2005, 20(3): 261-262.
[14]胡伟, 陈飞虎, 吴繁荣, 等. HPLC法测定鬼针草药材中金丝桃苷的含量[J]. 安徽医科大学学报, 2008, 43(6): 712-713.
Determination of Hyperin in Rosa davurica Pall. by HPLC
ZHONG Fang-li,WANG Xiao-lin*,JING Cai-yue
(School of Chemistry and Pharmaceutical Engineering, Jilin Institute of Chemical Technology, Jilin 132022, China)
Objective: To establish a determination method for hyperin in Rosa davurica Pall.. Methods: A HPLC method was developed using Shim-pack VP-ODS C18(4.6 mm × 150 mm, 5 μm) column as the stationary phase and CH3OH-0.2% H3PO4as the mobile phase. The flow rate of mobile phase, injection volume of the sample and the column temperature were 1.0 mL/min, 20 μL and 40 ℃, respectively. The UV detection wavelength was 360 nm. Results: A good linear relationship between integral value of peak area and hyperin concentration in the range of 4.76-76.16 μg/mL (r = 0.9993) was observed. The average recovery rate of hyperin was 98.06% with the RSD of 1.72%. Conclusion: The HPLC determination of hyperin in Rosa davurica Pall. was characteristics of convenience and accuracy, which can be used for the quality control of Rosa davurica Pall..
Rosa davurica Pall.;hyperin;HPLC method
TQ244.2
A
1002-6630(2010)24-0281-04
2010-02-08
吉林省教育厅重点计划项目(吉教科合字[2006]第122号)
钟方丽(1970—),女,教授,博士,主要从事天然产物化学成分及其生物活性的研究。E-mail:fanglizhong@sina.com
*通信作者:王晓林(1969—),男,副教授,硕士,主要从事天然产物有效成分的提取及纯化工艺研究。E-mail:wangxiaolin69@eyou.com
