海洋多黏类芽孢杆菌L1-9菌株抗菌蛋白的分离纯化及其抗菌作用
2010-03-23马桂珍王淑芳暴增海吴少杰夏振强李世东
马桂珍,王淑芳,暴增海,吴少杰,夏振强,李世东
(1.淮海工学院 江苏省海洋生物技术重点建设实验室,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港 222005;3.中国农业科学研究院植物保护研究所,北京 100081)
海洋多黏类芽孢杆菌L1-9菌株抗菌蛋白的分离纯化及其抗菌作用
马桂珍1,2,王淑芳1,暴增海1,2,吴少杰1,夏振强1,李世东3
(1.淮海工学院 江苏省海洋生物技术重点建设实验室,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港 222005;3.中国农业科学研究院植物保护研究所,北京 100081)
通过硫酸铵分级沉淀、DEAE Sepharose Fast Flow柱层析、Sephadex G-200柱层析,以小麦蠕孢病菌和金黄色葡萄球菌为指示菌采用抑菌活性追踪和SDS-PAGE跟踪检测,从分离自连云港海域、对多种病原真菌具有抑菌作用的多黏类芽孢杆菌L1-9菌株发酵液中分离纯化得到一种对金黄色葡萄球菌和小麦蠕孢病菌的菌丝生长及孢子萌发具有抑制作用的抗菌蛋白,分子质量约31kD。
海洋多黏类芽孢杆菌L1-9菌株;抗菌蛋白;纯化
植物病害的防治主要依靠化学防治,化学防治所带来的环境污染、农产品残留以及病原物产生抗药性等副作用已引起人们的高度重视,化学农药的大量使用作为种植业的源头污染已经严重威胁着食品安全。应用有益微生物防治植物病害弥补了化学防治的不足,也是保障食品安全的有效途径,已经成为植物病害防治的重要手段,受到人们的广泛关注。
多黏类芽孢杆菌(Paenibacillus polymyxa)中很多菌株作为重要的生物防治资源,用于多种植物病害的生物防治,该菌对人畜安全、无环境污染、对植物非致病性,美国环境保护署(EPA)已将其列为可商业上应用的微生物种类之一[1],我国农业部也将其列为免做安全鉴定的一级菌种[2]。Nielsen等[3]筛选到一株多黏类芽孢杆菌,该菌能产生细胞壁水解酶,抑制一些病原真菌生长;多黏类芽孢杆菌BRF-1菌株的无菌代谢产物抑制黄瓜尖孢镰刀菌和番茄枯萎病菌分生孢子萌发和菌丝生长,对黄瓜枯萎病和番茄枯萎病具有明显的防治效果,对大豆具有明显的防病促生作用,其生物防治机制主要是分泌拮抗物质[4];W3菌株培养液和去菌液对番茄植株抗灰霉病有较强的诱导作用[5],徐玲等[6]将筛选到的多黏
类芽孢杆菌菌株HY96-2研制成了0.1×108CFU/g多黏类芽孢杆菌细粒剂(KDLD),已登记并在生产上应用,对番茄青枯病具有良好的防治效果。多黏类芽孢杆菌已经成为重要的生防资源,用于植物病害的生物防治。现已报道的多黏类芽孢杆菌均分离自土壤,而有关分离自海洋环境的多黏类芽孢杆菌的研究较少。
L1-9菌株是从连云港海域海泥中分离获得的对多种植物病原真菌和细菌有抗菌作用的多黏类芽孢杆菌优良菌株[7],该菌株能产生几丁质酶、葡聚糖酶、蛋白酶和纤维素酶等细胞壁水解酶[8]。本实验从L1-9菌株代谢产物中分离纯化抗菌蛋白,为明确该菌株的生物防治作用机理提供参考。
1 材料与方法
1.1 菌株
海洋多黏类芽孢杆菌(Paenibacillus polymyxa)L1-9菌株分离自连云港海域海泥,本实验室保存;
供试细菌:金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli),由本实验室保存;供试病原真菌:小麦赤霉病菌(Fusarium graminearum)、小麦孺孢病菌(Helminthosporium sativum)由中国农业科学院植物保护研究所提供。
1.2 培养基
L1-9菌株菌种培养及保藏培养基:海水配制的PDA培养基。
植物病原真菌菌种活化及抑菌实验用培养基:PDA培养基;大肠杆菌(E. coli)、金黄色葡萄球菌(S. aureus)使用的培养基:牛肉膏蛋白胨培养基。
L1-9菌株种子液制备培养基:马铃薯200g、葡萄糖20g、海水1000mL,自然pH值。
L1-9菌株发酵培养基(g/100mL):豆饼粉1、玉米粉1.5、麦麸1、大米粉0.5、KH2PO40.07、MgSO40.03、CaCO30.1,海水配制,自然pH值。
1.3 方法
1.3.1 L1-9菌株的活化与培养
将保藏的菌株划线接种于海水配制的PDA培养基斜面上,25℃恒温培养24h。
1.3.2 L1-9菌株种子液的制备
挑取活化后的L1-9菌株5环,接入装有50mL种子液培养基的250mL三角瓶中,28℃、180r/min振荡培养24h,得到种子液。
1.3.3 L1-9菌株发酵液的制备
按5%的接种量将种子液接种到装有70mL发酵培养基的250mL三角瓶中,28℃、180r/min振荡培养36h,发酵液在4℃、12000r/min(离心力为15984×g)条件下离心20min,去沉淀,上清液即为发酵液。
1.3.4 硫酸铵的分级沉淀
取L1-9菌株发酵上清液缓缓加入固体硫酸铵至30%饱和度,4℃静置2h ,10000r/min(离心力为11100×g),4℃离心30min ,分别收集上清液和沉淀。向收集的上清液中继续加入固体硫酸铵,依次按照同样的方法调节到40%、50%、60%、70%和80%硫酸铵饱和度。分别收集每一个饱和度的沉淀蛋白,用适量的0.05mol/L pH7.2的PB缓冲液溶解,装入透析袋中用相同浓度的PB缓冲液流动透析冰浴过夜。以小麦蠕孢病菌为指示菌,用挖孔法和滤纸片法测定各组分的抑菌活性。
1.3.5 DEAE Sepharose Fast Flow离子交换柱层析
对发酵液硫酸铵沉淀后的沉淀复溶物进行DEAE Sepharose Fast Flow离子交换层析[9]。先用0.05mol/L pH7.2的PB缓冲液洗脱平衡柱床,将浓缩的样品上样,用100%的PB缓冲液洗脱一个柱体积,然后用0~1mol/L的NaCl溶液进行梯度洗脱,洗脱速度为1.5mL/min,仪器检测到波长280nm处的A280nm≥0.03时,自动部分收集器按每管4mL收集,冻干浓缩,检测其抑菌活性。
1.3.6 Sephadex G-200凝胶层析
将经过DEAE离子交换柱层析洗脱收集到的样品液浓缩,用Sephadex G-200柱层析进行进一步纯化。
先用0.05mol/L pH7.2的PB缓冲液充分平衡至A280nm基线。将1~1.5mL的样品液上样,用相同缓冲液洗脱,洗脱速度为0.5mL/min。波长280nm处的A≥0.03时,自动部分收集器按每管2mL收集,分段收集合并吸收峰,冻干浓缩后分别进行活性检测和纯度检测。
1.3.7 SDS-PAGE凝胶电泳检测纯度
SDS-聚丙烯酰胺凝胶电泳( SDS-PAGE) 参照文献[10]的方法。蛋白含量的测定采用考马斯亮蓝G-250染色法,以牛血清白蛋白作为标准。浓缩胶和分离胶浓度分别为4%和12%。
1.3.8 抑菌活性的检测
1.3.8.1 对病原真菌的抑制作用
采用平板打孔法。在PDA平板中央接种直径为5mm的受试病原菌菌苔,距培养皿边缘15mm处,对称打直径为5mm的孔,每个孔内滴200μL L1-9菌株的无菌发酵液,25℃恒温培养4d后,观察病原真菌的菌落生长状况,测量抑菌带宽度。
1.3.8.2 对细菌的抑制作用
采用牛津杯法和滤纸片法。将在细菌培养基斜面上培养24h的供试指示细菌用0.85%的无菌生理盐水洗下,制备成浓度为5×106个/mL菌悬液,取0.2mL菌悬液滴在平板培养基表面中央,用无菌涂布棒涂布均匀。在
距离培养皿边缘1.5cm处的含菌平板四周摆放牛津杯(滤纸片),每个牛津杯(滤纸片)中注入50μL供试样品,以等量的PD培养基和PB缓冲液为对照。28℃培养箱中恒温,培养24h后观察测定抑菌圈直径。
1.3.8.3 对孢子萌发的抑制作用
将培养7d的小麦蠕孢病菌用10mL无菌水洗下孢子,4层纱布过滤去除菌丝,室温下5000r/min离心5min,沉淀(孢子)用无菌水稀释,至浓度为106个/mL。在孢子悬浮液中加入等体积的抑菌蛋白溶液,混均后取20μL涂布在无菌玻片中央,将载玻片置于装有2层滤纸的灭菌培养皿内保湿,22℃恒温培养,分别在2、4、6、8h和10h观察孢子萌发情况,每处理低倍镜下检查100~120个孢子,计算孢子萌发率,测定芽管长度。用PB缓冲液稀释孢子作为对照,每处理重复3次。

1.3.9 抗菌蛋白酶活性检测
[8]的方法,采用平板透明圈法,检测抗菌蛋白的几丁质酶、蛋白酶和葡聚糖酶活性。
2 结果与分析
2.1 L1-9菌株发酵液的抑菌作用
平板抑菌活性实验表明,L1-9菌株无菌代谢产物对供试的植物病原真菌有很强的抑菌活性,100μL无菌代谢产物在PDA培养基上对小麦赤霉病菌(Fusarium graminearum)、小麦孺孢病菌(Helminthosporium sativum)以及金黄色葡萄球菌(Staphylococcus aureus)均有明显的抑菌活性,而CK(添加PD液体培养基)则无抑菌活性(图1);发酵液对于大肠杆菌(Escherichia coli)没有抑菌活性。

图1 细菌L1-9菌株发酵液的抑菌活性检测结果Fig.1 Antimicrobial effects of the fermentation supernatant of strain L1-9
2.2 硫酸铵沉淀的结果
用不同饱和度的硫酸铵沉淀L1-9菌株代谢产物,分段收集沉淀,透析后对沉淀物质抑菌活性检测结果表明:抑菌活性随硫酸铵饱和度的提高而增加,当饱和度提高到70%时达到最大值,继续增加硫酸铵的饱和度时抑菌活性下降,说明该抗菌物质存在于70%饱和度的硫酸铵中。
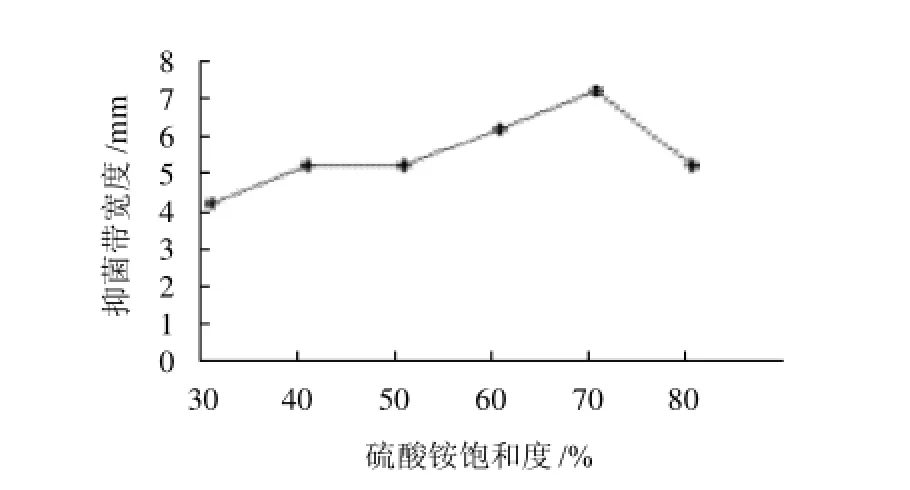
图2 不同饱和度硫酸铵沉淀蛋白对小麦蠕孢病菌的抑菌活性Fig.2 Anti-Fusarium graminearum effects of ammonium sulfateprecipitated fractions of the fermentation supernatant of strain L1-9
2.3 DEAE离子交换柱层析纯化抗菌蛋白及活性蛋白检测
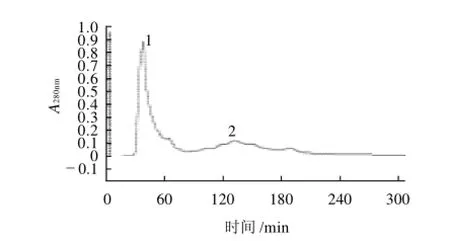
图3 抗菌蛋白的DEAE离子交换层析图Fig.3 Elution profile of redissolved ammonium sulfate-precipitatedfractions of the fermentation supernatant of strain L1-9 on DEAE Sepharose Fast Flow column
如图3所示,发酵上清液经硫酸铵沉淀并透析除盐后,所得到的粗蛋白经DEAE离子交换层析分离,出现了明显的峰1,该处蛋白对应的吸光度达到0.9,将峰1单独收集,NaCl溶液继续洗脱得到的峰2,该处蛋白对应的吸光度未超过0.2,并且峰2包含多种杂蛋白。

图4 DEAE柱层析峰1对金黄色葡萄球菌和小麦孺孢病菌的抑制作用Fig.4 Antimicrobial effects of peak 1 obtained from DEAE Sepharose Fast Flow column fractionation
如图4所示,以金黄色葡萄球菌(S. aureus)和小麦孺孢病菌(H. sativum)为指示菌进行抑菌活性检测,峰1具有抑菌活性,峰2对供试菌没有抑制作用。
2.4 Sephadex G-200柱层析结果
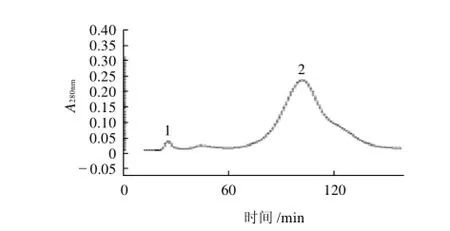
图5 抗菌蛋白的Sephadex G-200 凝胶柱层析图Fig.5 Elution profile of peak 1 on Sephadex G-200 column
如图5所示,DEAE离子交换柱层析收集到的峰1经过冻干浓缩,用Sephadex G-200分子筛层析柱进行进一步纯化。洗脱后出现两个峰,峰1处蛋白的吸光度为0.05,峰2处蛋白的吸光度明显高于峰1,达到了0.25,按峰收集。
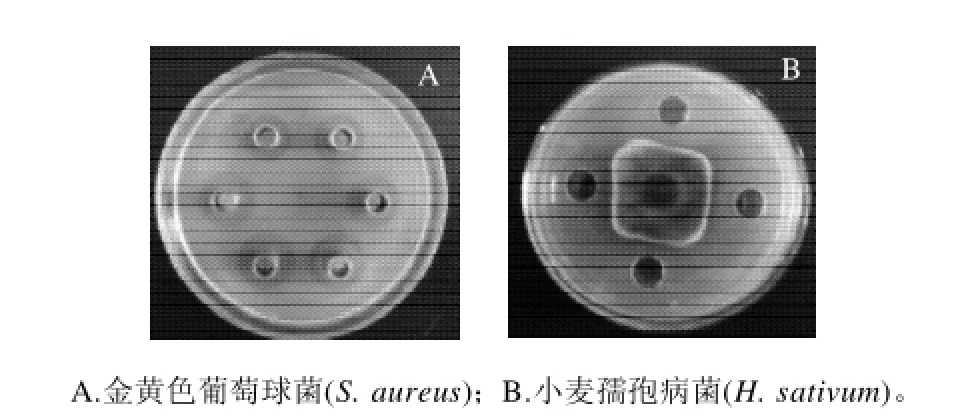
图6 Sephadex G-200层析峰2收集液对细菌和病原真菌的抑制作用Fig.6 Antimicrobial effects of peak 2 obtained from Sephadex G-200 column fractionation
如图6所示,分别检测峰1和峰2的抑菌活性,峰1没有抑菌活性,峰2具有抑菌活性。
2.5 SDS-PAGE凝胶电泳检测抗菌蛋白纯度和分子质量

图7 抗菌蛋白各纯化阶段电泳图谱Fig.7 Electrophoresis profile of target protein-containing products during separation and purification
由图7可见,经硫酸铵沉淀得到的具有抑菌活性的粗蛋白含有多种蛋白组分,表明L1-9菌株的代谢产物除含有抗菌蛋白外,同时还含有多种不同分子质量的杂蛋白,而粗蛋白DEAE柱层析后有抑菌活性的峰1也出现了多条条带,峰1继续使用Sephadex G-200层析纯化后的有活性的峰2经SDS-PAGE检测呈现单一条带,表明已分离得到了电泳纯的抗菌蛋白,其表观分子质量约31kD。
2.6 抗菌蛋白对小麦蠕孢病菌分生孢子萌发的影响
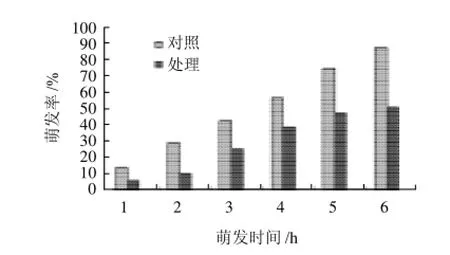
图8 纯化后的蛋白组分对小麦孺孢病菌分生孢子萌发的抑制作用Fig.8 Inhibitory effect of the purified target protein against the spore germination of Helminthosporiu sativum

图9 抗菌蛋白对小麦孺孢病菌分生孢子芽管长度的影响结果Fig.9 Inhibitory effect of the purified target protein against germ tube length of Helminthosporiu sativum

图10 抗菌蛋白处理后小麦孺孢病菌分生孢子萌发情况(10×40)Fig.10 Conidiophore sprouting of Helminthosporiu sativum with and without treatment with the purified target protein examined under electron microscope (10×40)
从图8~10可以看出,以无菌培养液为对照,经过蛋白组分处理的小麦孺孢病菌的分生孢子萌发率明显下降,6h时对照的萌发率达到了90%,而处理的萌发
率仅为51.4%。抗菌蛋白不仅降低孢子的萌发率,同时也抑制芽管的伸长,处理的芽管生长较慢,明显短于对照,6h对照的芽管长度为22.3μm,处理的仅为12.9μm。
2.7 抗菌蛋白的酶活性检测结果
酶活性检测结果表明,从L1-9菌株的代谢产物中分离的到的抗菌蛋白,在几丁质酶、葡聚糖酶和蛋白酶检测平板上均未形成透明圈,表明该蛋白不具有3种酶的活性,为一种非酶类的抗菌蛋白。
3 讨论与结论
通过硫酸铵分级沉淀、DEAE Sepharose Fast Flow柱层析、Sephadex G-200柱层析,以小麦蠕孢病菌和金黄色葡萄球菌为指示菌采用抑菌活性追踪和SDS-PAGE跟踪检测,从分离自连云港海域对多种病原真菌具有抑菌作用的多黏类芽孢杆菌L1-9菌株发酵液中分离纯化到1种分子质量约31kD的抗菌蛋白,该蛋白不具有几丁质酶、葡聚糖酶和蛋白酶活性,为一种非酶类的抗菌蛋白,对金黄色葡萄球菌具有明显的抑制作用,并抑制小麦蠕孢病菌的菌丝生长、孢子萌发及芽管的伸长。以往的研究表明,该菌株能够产生几丁质酶、葡聚糖酶、蛋白酶和纤维素酶[8],而本实验分离的到的抗菌蛋白却不具有上述几种细胞壁降解酶活性,这可能是由于同种微生物在不同的培养基上产生的代谢产物不同,同时几丁质酶、葡聚糖酶、蛋白酶和纤维素酶是诱导酶,微生物在含有相应底物的培养基上能够产生相应的酶类,本实验所用的发酵培养基中不含有上述酶类的底物,因而未能产生相应的细胞壁降解酶。说明该菌株具有不同的抑菌机理和良好的应用前景。
多黏类芽孢杆菌能产生多种形式的抗菌因子,菌株不同,其产生的抗菌物质及生理活性物质也不同,按其物质类型可分为多肽抗生素类[11]、植物激素[12]、拮抗蛋白(非酶)类[13]、酶类等。姚乌兰等[14]从多黏类芽孢杆菌WY110菌株中分离得到一种对水稻稻瘟病菌具有拮抗活性的蛋白P2,其分子质量为26kD,该蛋白具有葡聚糖酶活性。Beatty等[15]研究表明,多黏类芽孢杆菌PKB1 菌株产生的抗菌物质为多种组分的抗菌肽,其分子质量分别为883、897、948D和961D的短肽。BS04 菌株产生4个分子质量分别为1144、1126、1104、1086D的短肽[16]。BRF-1菌株的抗菌蛋白表观分子质量约35.14kD[17],LM-3菌株产生的抗菌蛋白分子质量介于6kD和14.2kD之间[9],L1-9菌株的抗菌蛋白分子质量约为31kD,与所报道的抗菌蛋白不同,有可能为一种新的非酶类抗菌蛋白。张道敬等[18]从多黏类芽孢杆菌H Y96-2发酵液乙酸乙酯部分分离得到了8个化合物,对所分离得到的化合物进行了初步的生物活性测试,发现化合物Ⅴ和Ⅵ有一定的抗菌活性。
目前用于微生物农药开发的微生物主要来自于陆源微生物。然而,经过半个世纪以来全球性的筛选,从陆源微生物中发现新型生物活性物质或新化合物的概率已大大降低,海洋高压、高盐、低营养、低温的独特环境不仅造就了一些特殊种类的微生物,而且即使与陆地相同的微生物种类,在海洋这种特殊的生境中生活,也会产生完全不同于陆地微生物的新颖抗菌活性物质,因而海洋微生物已经成为寻找新的抗菌活性物质的重要生物资源[19],受到国内外的广泛关注。我国田黎等[20]对海洋细菌B-9987菌株产生的抑菌物质及对几种植物病原真菌的作用进行了研究,为海洋细菌在植物病害生物防治上的应用提供了理论依据。
本实验对L1-9菌株的抗菌蛋白进行分离纯化,有关抗菌蛋白的氨基酸序列分析以及该菌株产生的小分子抗菌物质的分离纯化正在进行,今后将进一步深入开展抑菌作用机理、抗菌蛋白编码基因的克隆、高效生防工程菌株的构建等研究工作。
参考文献:
[1] ELIZABETH B. Surface colonization of lodgepole pine (Pinus contorta var. latifolia) roots by Pseudomonas fluorescens and Paenibacillus polymyxa under antibiotic conditions[J]. Plant and Soil, 2002, 241(2): 187-196.
[2] 杨少波, 刘训理. 多黏类芽孢杆菌及其产生的生物活性物质研究进展[J]. 微生物学通报, 2008, 35(10): 1621-1625.
[3] NIELSEN P, SORENSEN J. Multi-target and medium-independent fungal antagonism by hydrolytic enzymes in Paenibacillus polymyxa and Bacillus pumilus strains from barley rhizosphere[J]. FEMS Microbiol Ecol, 1997, 55: 183 -192.
[4] 陈雪丽, 王光华, 金剑, 等. 多黏类芽孢杆菌BRF-1和枯草芽孢杆菌BRF-2对黄瓜和番茄枯萎病的防治效果[J]. 中国生态农业学报, 2008, 16(2): 446-450.
[5] 童蕴慧, 郭桂萍, 徐敬友, 等. 拮抗细菌对番茄植株抗灰霉病的诱导[J]. 中国生物防治, 2004, 20(3): 187-189.
[6] 徐玲, 王伟, 魏鸿刚, 等. 多黏类芽孢杆菌HY96-2对番茄青枯病的防治作用[J]. 中国生物防治, 2006, 22(3): 216-220.
[7] 马桂珍, 孔德平, 王增池, 等. 抗植物病原真菌海洋细菌的抗菌作用研究[J]. 吉林农业大学学报, 2009, 31(1): 8-12.
[8] 夏振强, 暴增海, 周超, 等. 抗真菌海洋细菌L1-9菌株的几种胞外酶活性测定[J]. 河南农业科学, 2009(7): 74-77.
[9] 宋永燕, 李平, 郑爱萍, 等. 生防细菌LM-3的鉴定及其抗菌蛋白的研究[J]. 四川大学学报: 自然科学版, 2006, 43(5): 1110-1115.
[10] LAEMMLI U K. Ceavage of structural proteins during the assembly of the head of bacteriaophage T4[J]. Nature, 1970, 227: 680 -685
[11] LEBUHN M, HEULIN T, HARTMANN A. Production of auxin and other indolic and phenolic compounds by Paenibacillus polymyxa strains isolated from different proximity to plant roots[J]. FEMS Microbiol Ecol, 1997, 22: 325-334.
[12] TIMMUSK S, NICANDER B, GRANHALL U, et al. Cytokinin production by Paenibacillus polymyxa[J]. Soil Biol Biochemistry, 1999, 31: 1847-1852.
[13] KAVITHA S, SENTHILKUMAR S, GNANAMANICKAM S, et al. Isolation and partial characterization of antifungal protein from Bacillus polymyxa strainVLB16[J]. Process Biochemistry, 2005, 40(10): 3236-3243.
[14] 姚乌兰, 王云山, 韩继刚, 等. 水稻生防菌株多黏类芽孢杆菌WY110抗菌蛋白的纯化及其基因克隆[J]. 遗传学报, 2004, 31(9): 878-887.
[15] BEATTY P H, JENSEN S E. Paenibacillus polymyxa produces fusaricidin-type antifungal antibiotics active against of blackleg disease of canola[J]. Can J Microbiol, 2002, 48: 159-169.
[16] 谢晶, 葛绍荣, 陶勇, 等. 多黏类芽孢杆菌BS04拮抗成分分离纯化及其特性[J]. 化学研究与应用, 2004, 16(6): 775-777.
[17] 陈雪丽, 郝再彬, 王光华, 等. 多黏类芽孢杆菌BRF-1 抗菌蛋白的分离纯化[J]. 中国生物防治, 2007, 23(2): 156-159.
[18] 张道敬, 龚春燕, 魏鸿刚, 等. 多黏类芽孢杆菌HY96-2的化学成分[J]. 华东理工大学学报: 自然科学版, 2008, 34(1): 71-73.
[19] KHACHATOURIANS G G. Agricultural use of antibiotics and the evolution and transfer of antibiotic-resistant bacteria[J]. Can Med Assoc, 1998, 159(9): 1129-1136.
[20] 田黎, 顾振芳, 陈杰, 等. 海洋细菌B-9987菌株产生的抑菌物质及对几种植物病原真菌的作用[J]. 植物病理学报, 2003, 33(1): 77-80.
Isolation, Purification and Biological Activity Assessment of an Antimicrobial Protein from Marine Paenibacillus polymyxa Strain L1-9
MA Gui-zhen1,2,WANG Shu-fang1,BAO Zeng-hai1,2,WU Shao-jie1,XIA Zhen-qiang1,LI Shi-dong3
(1. Jiangsu Key Laboratory of Marine Biotechnology, Huaihai Institute of Technology, Lianyungang 222005, China;2. Jiangsu Marine Resources Development Research Institute, Lianyungang 222005, China;3. Plant Protection Institute of the Chinese Academy of Agricultural Sciences, Beijing 100081, China)
An antimicrobial protein was obtained from the fermentation broth of a Paenibacillus polymyxa strain isolated from the sea area near Lianyungang (numbered L1-9), which has antagonic effect against a variety of pathogenic fungi, after ammonium sulfate precipitation and DEAE Sepharose Fast Flow ion exchange and Sephacryl G-200 filtration chromatographic separation. This protein was found to have the ability to inhibit the growth of Staphyloccocus aureus and the mycelial growth and spore germination of Helminthosporium sativum and possess a molecular weight of about 31 kD.
marine Paenibacillus polymyxa strain L1-9;antimicrobial protein;purification
Q815
A
1002-6630(2010)17-0335-06
2010-06-29
江苏省自然科学基金项目(BK2009165);连云港市科技局农业攻关项目(CN0825);
农业部生物防治重点开放实验室开放课题(KLBC-09-01);江苏省海洋生物技术重点建设实验室开放课题(HS08009)
马桂珍(1963—),女,教授,博士,主要从事植物病害生物防治研究。E-mail:guizhenma@sohu.com
