牛乳铁素对几种免疫细胞因子的影响
2010-03-23胡志和刘传国庞广昌陈庆森
胡志和,刘传国,李 娜,庞广昌,陈庆森
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
牛乳铁素对几种免疫细胞因子的影响
胡志和,刘传国,李 娜,庞广昌,陈庆森
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
通过对灌胃牛乳铁素(LfcinB)后小鼠血清中细胞因子IL-2、IL-4、IL-6、IL-10和TNF-α水平的变化,评价其免疫调节作用。结果表明,灌胃牛乳铁素后3h采血,分离其血清,用ELISA试剂盒检测细胞因子,与阴性对照组相比,对细胞因子IL-2和TNF-α产生极显著促进作用(P≤0.01),对抗炎细胞因子IL-4有极显著的抑制作用(P≤0.01),对IL-6有显著的抑制作用(P≤0.05),对抗炎细胞因子IL-10的分泌影响也极显著(P≤0.01),并且IL-10随TNF-α的增强而增强,起到平衡作用。因此,口服牛乳铁素对实验小鼠具有免疫增强和调节作用。
牛乳铁素;细胞因子;免疫调节
牛乳铁素(LfcinB)来源于牛乳铁蛋白的第17~41位氨基酸,由25个氨基酸残基组成,氨基酸序列为:FKCRRWQWRMKKLGAPSITCVRRAF,包括5个精氨酸、3个赖氨酸和2个色氨酸残基,具有强碱性,pI大于8.5,相对分子质量3100,由2个Cys通过形成分子内二硫键使LfcinB分子呈不完全的桶状,其中的11个氨基酸(RRWQWRMKKL)具有与完整的LfcinB相同的抗菌活性,而且这11个氨基酸残基中富含Trp/Arg的区域(RRWQWR)是保持抗菌活性所必须的[1-3],碱性的Arg残基和疏水的Trp残基,形成了两性分子结构。对含有25个氨基酸残基的LfcinB也是两性分子结构;Trp残基和带正电荷的Arg、Lys残基是相互分开的。以上结构特征与LfcinB功能是分不开的,对LfcinB结合膜和抗菌活性尤其重要的是Trp和Arg,它们引导整个分子结合在界面上,而非渗入到双层膜之内,并在那里通过结合DNA和RNA分子继续作用。总之,Lfcin的各种活性似乎都与其分子的特殊部分Trp/Arg有关[4]。LfcinB带有强正电荷的阳离子型抗菌肽,可能通过趋化性来达到调节免疫反应和消炎的功能[5]。有研究者认为,可能是LfcinB能自发穿过细胞膜进入细胞,选择性地同某些与免疫效应有关的基因结合,从而促进或抑制这些基因的表达,调控免疫反应[6]。另有研究表明,LfcinB能够进入细胞质或核中,可以作为第二信使启动某一信号转导通路,调控基因表达。影响细胞功能,如促进骨髓细胞增殖、中性淋巴细胞激活、促进细胞分化等[7]。口服乳铁素可增加外周血液和产肿瘤鼠的小肠中NK细胞、CD4+T细胞和CD8+T细胞的数量,乳铁素通过老鼠的小肠上皮细胞可诱导IL-18的分泌[8-10],从而增强Th1
细胞的功能和增加NK细胞的活性。
本研究通过检测灌胃乳铁素后免疫低下小鼠部分免疫细胞因子分泌的变化,探讨乳铁素在免疫调节方面的作用。
1 材料与方法
1.1 实验动物
Balb/c小鼠((6~8周龄,18~22g),雌雄各半) 中国医学科学院肿瘤研究所实验动物中心提供的二级种(批准号:京动字8910 M 047)。
1.2 试剂
药用环磷酰胺(批号为012034) 上海华联制药有限公司;牛乳铁素(纯度≥95%) 实验室自制;IL-2、IL-4、IL-6、IL-10和TNF-α定量ELISA检测试剂盒 美国Rapidbio公司。
1.3 仪器与设备
UV-2100型分光光度计 美国Unico公司;Mμltiskan MK3酶标仪 Thermo Labsystems公司;KDC-2046低速冷冻离心机 科大创新有限公司。
1.4 方法
1.4.1 免疫低下模型的建立
根据文献[11]的方法建立免疫低下模型,选择腹腔注射80mg/kg bw的环磷酰胺后第3天的Balb/c小鼠为免疫低下模型。
1.4.2 实验分组及处理
1.4.2.1 不同剂量的牛乳铁素对IL-2分泌的影响
取小鼠50只,雌雄兼用,随机分为5组,每组10只。设3个实验组,分别以400、40、4μg/mL的牛乳铁素每天灌胃,灌胃剂量为20mL/kg bw,同时设阴性对照组和完全空白组,给这两组每天灌胃生理盐水,灌胃剂量为20mL/kg bw,连续灌胃15d。末次灌胃后次日,给实验组和阴性对照组小鼠一次性腹腔注射80mg/kg bw的环磷酰胺,注射剂量为10mL/kg bw;之后实验组按照原剂量灌胃牛乳铁素;阴性对照组灌胃生理盐水;而完全空白组仅灌胃生理盐水,剂量为20mL/kg bw,连续3d。第3天,在灌胃乳铁素或生理盐水后3h,摘眼球取血,每只小鼠取血0.6~0.8mL置入1.5mL离心管中,静置1h左右,于2000r/min离心10min,取上清。用IL-2定量ELISA法检测试剂盒检测,同时确定牛乳铁素较适合的灌胃剂量。
1.4.2.2 不同作用时间同等剂量的牛乳铁素对IL-4、IL-6、IL-10和TNF-α分泌的影响
取60只小鼠,随机分为6组,设为完全空白组、阴性对照组,其他4组为牛乳铁素实验组。首先给阴性对照组和4个实验组的小鼠一次性腹腔注射80mg/kg bw的环磷酰胺,注射剂量均为10mL/kg bw;之后实验组灌胃40μg/mL牛乳铁素,剂量为20mL/kg bw,阴性对照组灌胃生理盐水,剂量为20mL/kg bw,连续灌胃3d;完全空白组灌胃生理盐水,剂量为20mL/kg bw,连续3d。第3天,实验组分别在灌胃后1、2、3h和4h,摘眼球取血。完全空白组和阴性对照组在第2小时和第3小时之间取血。每只小鼠取血0.6~0.8mL置入1.5mL离心管中,静置1h左右,于2000r/min离心10min,取上清。检测IL-4、IL-6、IL-10和TNF-α的变化。
1.4.3 细胞因子定量检测
采用ELISA试剂盒检测,送至天津华生源科技有限公司完成。具体操作步骤见试剂盒操作说明。
1.4.4 数据处理
采用SPSS 17.0软件处理,以x±s表示,用t检验进行显著性检验。
2 结果与分析
2.1 不同剂量牛乳铁素对IL-2的影响

图1 不同剂量牛乳铁素对小鼠IL-2分泌的影响Fig.1 Effect of lactoferricin on IL-2 in mice
由图1可知,随着每天摄入牛乳铁素质量浓度的增加,IL-2到达一个峰值之后略有下降趋势,以40μg/mL为最佳值。与阴性对照组相比,3个剂量组对IL-2都具有极显著的影响(P≤0.01)。
2.2 不同作用时间下牛乳铁素对IL-4分泌的影响
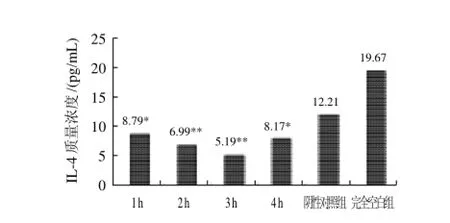
图2 不同作用时间下牛乳铁素对小鼠IL-4分泌的影响Fig.2 Effect of lactoferricin on IL-4 in mice
由图2可知,牛乳铁素对IL-4水平的影响随着时间的变化而变化,在1~3h范围内,对IL-4的分泌抑制作用增强,之后逐渐减弱,在3h时达到最强。因此,牛乳铁素对小鼠IL-4的分泌具有抑制作用。与阴性对照组相比,在2h和3h抑制作用极显著(P≤0.01),1h和4h抑制作用则受到显著影响(P≤0.05)。
2.3 不同作用时间下牛乳铁素对IL-6分泌的影响

图3 不同作用时间下牛乳铁素对小鼠IL-6分泌的影响Fig.3 Effect of lactoferricin on IL-6 in mice
由图3可知,牛乳铁素对IL-6的分泌具有抑制作用。在1~3h范围内,对IL-6分泌的抑制作用增强,之后逐渐减弱,在3时达到显著水平(P≤0.05)。而在1、2h和4h,虽有抑制作用,但不显著。
2.4 不同作用时间下牛乳铁素对IL-10分泌的影响

图4 不同作用时间下牛乳铁素对小鼠IL-10分泌的影响Fig.4 Effect of lactoferricin on IL-10 in mice
由图4可知,灌胃牛乳铁素对IL-10的分泌具有促进作用。在灌胃后1~3h内,其作用逐渐增强。在3h时IL-10质量浓度达到最强,是阴性对照组的63倍多,是完全空白组的近12倍。随后其作用开始减弱。并且,与阴性对照组相比,1~4h内均达到极显著差异(P≤0.01)。
2.5 不同作用时间下牛乳铁素对TNF-α分泌的影响

图5 不同作用时间下牛乳铁素对小鼠TNF-α分泌的影响Fig.5 Effect of lactoferricin on TNF-α in mice
由图5可知,牛乳铁素对小鼠TNF-α的分泌具有促进作用。在灌胃牛乳铁素后1~3h内,随着时间延长,牛乳铁素对小鼠TNF-α分泌的影响也随之增大,在3h时达到最高。随后,其作用开始减弱。在3h时牛乳铁素对小鼠TNF-α分泌的影响达到极显著水平(P≤0.01),在2h和4h时牛乳铁素对小鼠TNF-α的影响达显著水平(P≤0.05)。
3 讨 论
乳铁素作为乳铁蛋白的活性中心,具有乳铁蛋白的各种生理活性。在免疫研究方面,发现乳铁蛋白能够与靶分子和靶细胞作用,起到调节免疫反应的作用。通过抑制前炎症细胞因子的产生起到抗炎作用[12-14],并能够上调抗炎细胞因子的作用[15]。乳铁蛋白通过调节T细胞和B细胞的增殖、分化和激活,直接或间接增强免疫反应[16-17]。Hartog等[18]研究发现,口服乳铁蛋白抑制炎症反应在一定浓度范围内(0.1~1mg/(mouse/day))有效,而高浓度(5~25mg/(mouse/day))时作用不明显。Tomita等[19]指出,口服乳铁蛋白能够增强肠内上皮细胞IL-18、上皮内淋巴细胞肠系膜淋巴结细胞的IL-10和INF-γ的分泌。能够增加肠黏膜中CD4+细胞、CD8+细胞和自然杀伤细胞数量。同时还能增强小肠中NOD-2、IFN-β和IL-12p40的表达。在全身免疫系统中,口服乳铁蛋白能增加淋巴结和脾中细胞的数量,增加腹膜巨噬细胞和脾的NK细胞的活性,增强Th1型细胞因子(IL-12和INF-γ)的产生。

图6 口服乳铁蛋白对宿主保护作用机理的推演Fig.6 Protective mechanism of oral administration of lactoferricin on host
然而,食用乳铁蛋白后,在胃-肠道中部分被水解,产生包括乳铁素(LfcinB)在内的肽类[20]。乳铁蛋白及其水解产物能否进入血液循环发挥作用。根据Wakabayashi等[21]研究结果,摄入的乳铁蛋白一般不会直接进入血液。而Fischer等[22]研究表明,乳铁蛋白摄
入后,可以完整分子的形式通过小肠被转运到外周血,并在口服10~20min后停留在肝脏、肾脏、胆囊、脾脏等器官。但它又是如何作用于肠道免疫系统,影响其宿主防御呢?根据Tomita等[19]对口服乳铁蛋白作用机理推演(图6),乳铁蛋白摄入后,部分被胃肠道中的蛋白酶水解成乳铁素等肽类,乳铁蛋白及其水解产物与肠细胞和肠上皮中的免疫细胞(包括树突细胞、淋巴细胞)上的受体结合,或被细胞吞噬,并激活细胞内的信使核糖核酸的形成基因,通过细胞因子和体液因子及免疫细胞的迁移使肠道免疫系统作用于病灶。然而,乳铁素作为乳铁蛋白食用后产生的水解产物,在其中的作用如何呢?
细胞因子的产生,与乳铁蛋白的活性中心——乳铁素的结构和氨基酸的组成有密切关系,通过乳铁素的氨基酸组成(FKCRRWQWRMKKLGAPSITCVRRAF)可以看出,在牛乳铁素的25个氨基酸中有5个精氨酸(R),占其氨基酸的1/5,因此,在该活性中心,精氨酸有着非常重要的作用。精氨酸可有效促进细胞免疫功能,使胸腺增大和细胞计数增多;刺激T淋巴细胞的增殖;增强巨噬细胞的吞噬能力和自然杀伤细胞对肿瘤细胞的溶解功能,促进脾脏单核细胞合成IL-2并提高IL-2的活性及IL-2受体的活性;降低前列腺素G2的水平,进一步促进IL-2合成,最终发挥免疫防御和免疫调节作用[23]。本实验的研究结果也证实,乳铁素确实能够提高IL-2的水平。另外,乳铁素对细胞因子的产生作用,与摄入的剂量有关,这一点在文献[11]已经得到验证,与Roberts等[24]研究结果一致。
在灌胃乳铁素后,通过不同时间段内采集的血样,检测细胞因子IL-4、IL-6、IL-10和TNF-α的变化,可以发现,牛乳铁素被摄入后,只是在一定的时间内发挥作用,有作用的最佳时间段,随着时间延长,其作用逐渐减弱(图5)。摄入后对免疫细胞因子分泌的影响,根据图6的推演,乳铁素与树突细胞、淋巴细胞或肠细胞上的受体结合,通过表达MHCⅡ分子,将抗原呈递给T细胞,促进T细胞的增殖与分化,形成Th1和Th2细胞,由Th1细胞分泌IL-2。通过IL-2刺激巨噬细胞,产生TNF-α,使其表达水平升高(图5)。TNF-α可刺激造血肝细胞、中性粒细胞发挥免疫增强作用(图7)。为了抑制炎症因子TNF-α过分表达,避免造成组织伤害,Th2细胞分泌IL-10抑制TNF-α的分泌,其抑制关系参见图7[25]。从图4、5可以看出,在灌胃后第3h,IL-10和TNF-α都显示出高水平的表达,二者的变化规律一致,从而说明了图7所显示的抑制关系。
从图2、3可以看出,乳铁素对IL-4和IL-6的产生具有抑制作用。由图7可知,IL-4和IL-6可通过Th2细胞产生,也可通过其他细胞产生。而IL-4和IL-6都具有增强Th2细胞的作用,Th2细胞主要分泌抗炎细胞因子(IL-4、IL-10、IL-13、TGF-β等)抑制Th1、巨噬细胞、中性粒细胞等细胞作用,起抗炎作用或抑制免疫的作用。从这一角度分析说明,口服乳铁素具有增强免疫的作用。

图7 细胞因子网络示意图Fig.7 Network of immunological cytokines
[1] BELLAMY W, TAKASE M, WAKABAYASHI H, et al. Antibacterial spectrum of lactoferricin B, a potent bactericidal peptide derived from the N-terminal region of bovine lactoferrin[J]. Appl Bacteriol, 1992, 73(6): 472-479.
[2] HAUKLAND H H, VORLAND L H. Post-antibotic effect of the antimicrobial peptide lactoferricin on Escherichia coli and Staphylococcus aureus[J]. J Antimicro Chemothera, 2001, 48: 569-571.
[3] VOGEL H J, SCHIBLI D J, JING Weiguo, et al. Towards a structurefunction analysis of bovine lactoferricin and related tryptophan- and arginine-containing peptides[J]. Biochem Cell Biol, 2002, 80(1): 49-63.
[4] 李铁晶, 陈智斌, 付红, 等. 牛乳铁素结构和功能研究进展[J]. 中国乳品工业, 2005, 33(7): 36-39.
[5] 冯兴军, 王建华, 杨雅麟, 等. 乳铁蛋白肽(Lactoferricin)作用机制研究进展[J]. 中国生物杂志, 2004, 24(1): 23-26.
[6] 石芳, 翟朝阳. 乳铁多肽: 一种具有潜在抗菌能力的活性多肽[J]. 生物化学, 2004, 24(4): 312-314.
[7] MAEKAWA T, FUJIHARA M, OHTSUKI K. Characterization of human lactoferricin as a potent protein kinase CK2 activator regulated by A-kinase in vitro[J]. Biol Pharm Bull, 2002, 25(1): 118-121.
[8] IIGO M, KUHARA T, USHIDA Y, et al. Inhibitory effects of bovine lactoferrin on colon carcinoma 26 lung metastasis in mice[J]. Clin Exp Metastasis, 1999, 17(1): 35-40.
[9] WANG Wenping, IIGO M, SATO J, et al. Activation of intestinal mucosal immunity in tumor bearing mice by lactoferrin[J]. Jpn J Cancer Res, 2000, 91(10): 1022-1027.
[10] LIGO M, KUHARA T, USHIDA Y, et al. Orally administered lactoferrin exerts an antimetastatic effect and enhances production of IL-18 in the intestinal epthielium[J]. Nutr Cancer, 2001, 38: 192-199.
[11] 胡志和, 刘传国, 庞广昌, 等. 乳铁素免疫调节功能评价[J]. 食品科学, 2009, 30(15): 200-204.
[12] KRUZEL M L, HARARI Y, MAILMAN D, et al. Differential effects of prophylactic, concurrent and therapeutic lactoferrin treatment on LPS-induced inflammatory responses in mice[J]. Clin Exp Immunol, 2002, 130(1): 25-31.
[13] CHOE Y H, LEE S W. Effect of lactoferrin on the production of tumor necrosis factor-alpha and nitric oxide[J]. J Cell Biochem, 1999, 76(1): 30-36.
[14] CROUCH S P, SLATER K J, FLETCHER J. Regulation of cytokine release from mononuclear cells by the iron-binding protein lactoferrin[J]. Blood, 1992, 80(1): 235-240.
[15] TOGAWA J, NAGASE H, TANAKA K, et al. Oral administration of lactoferrin reduces colitis in rats via modulation of the immune system and correction of cytokine imbalance[J]. J Gastroenterol Hepatol, 2002, 17(12): 1291-1298.
[16] ZIMECKI M, MAZURIER J, SPIK G, et al. Human lactoferrin induces phenotypic and functional changes in murine splenic B cells[J]. Immunology, 1995, 86(1): 122-127.
[17] ZIMECKI M, MAZURIER J, MACHNICKI M, et al. Immunostimulatory activity of lactotransferrin and maturation of CD4―CD8―murine thymocytes[J]. Immunol Lett, 1991, 30(1): 119-123.
[18] HARTOG A, LEENDERS I, van der KRAAN P M, et al. Anti-inflammatory effects of orally ingested lactoferrin and glycine in different zymosan-induced inflammation models: Evidence for synergistic activity [J]. International Immunopharmacology, 2007, 7(13): 1784-1792.
[19] TOMITA M, WAKABAYASHI H, SHIN K, et al. Twenty-five years of research on bovine lactoferrin applications[J]. Biochimie, 2009, 91(1): 52-57.
[20] KUWATA H, YAMAUCHI K, TERAGUCHI S, et al. Functional fragments of ingested lactoferrin are resistant to proteolytic degradation in the gastrointestinal tract of adult rats[J]. J Nutr, 2001, 131(8): 2121-2127.
[21] WAKABAYASHI H, KUWATA H, YAMAUCHI K, et al. No detectable transfer of dietary lactoferrin or its functional fragments to portal blood in healthy adult rats[J]. Biosci Biotechnol Biochem, 2004, 68(4): 853-860.
[22] FISCHER R, DEBBABI H, BLAIS A, et al. Uptake of ingested bovine lactoferrin and its accumulation in adult mouse tissues[J]. International Immunopharmacology, 2007, 7(10): 1387-1393.
[23] 江汉湖. 食品免疫学导论[M]. 北京: 化学工业出版社, 2006: 206-207.
[24] ROBERTS A K, CHIERICI R, SAWATZKI G, et al. Supplementation of an adapted formula with bovine lactoferrin: 1. Effect on the infant faecal flora[J]. Acta Paediatr, 1992, 81(2): 119-124.
[25] 庞广昌. 食品免疫论[M]. 北京: 科学出版社, 2008: 549.
Effect of Bovine Lactoferricin on Cytokines
HU Zhi-he,LIU Chuan-guo,LI Na,PANG Guang-chang,CHEN Qing-sen
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
In order to figure out whether bovine lactoferricin (LfcinB) has immuno-regulation function, cytokines such as IL-2, IL-4, IL-6, IL-10 and TNF-α in blood sera from mice orally administered with LfcinB were tested using ELISA kits. The results indicated that IL-2 and TNF-α levels in lactoferricin treatment mice at 3 h post-administration were both even higher (P ≤ 0.01) than those in negative control mice, whereas the levels of anti-inflammatory cytokines, IL-4 (P ≤ 0.01) and IL-6 (P ≤0.05) revealed a significant decrease, and IL-10 level which is positively correlated with TNF-α level and plays a balancing role also changed notably. Therefore, oral administration of lactoferricin has the potential to provide the function of immune enhancement and regulation.
lactoferricin;cytokine;immuno-regulation function
R151.2
A
1002-6630(2010)17-0245-05
2009-12-23
天津市科技支撑计划重点项目(07ZCKFNC00200)
胡志和(1962—),男,教授,硕士,主要从事专用功能食品研究与开发。E-mail:hzhihe@tjcu.edu.cn
