稠李属果实色素理化性质研究
2010-03-23王振宇郝秀梅
王振宇,任 健,张 宁,郝秀梅
(1. 东北林业大学林学院,黑龙江 哈尔滨 150040;2. 哈尔滨工业大学食品科学与工程学院,黑龙江 哈尔滨 150090)
稠李属果实色素理化性质研究
王振宇1,2,任 健1,张 宁1,郝秀梅1
(1. 东北林业大学林学院,黑龙江 哈尔滨 150040;2. 哈尔滨工业大学食品科学与工程学院,黑龙江 哈尔滨 150090)
研究紫叶稠李小果、紫叶稠李大果和稠李果色素的光谱特性和理化性质,结果表明,紫叶稠李小果、紫叶稠李大果和稠李果色素对光、热有较好的耐受性,对pH值、氧化剂、还原剂较为敏感。相对而言,紫叶稠李小果色素的耐光、耐热和耐氧化还原能力强于紫叶稠李大果和稠李果色素;而稠李果色素耐氧化还原能力强于紫叶稠李大果色素,但耐光能力不如紫叶稠李大果色素。除Fe2+、Fe3+、Cu2+外,其余金属离子对3种色素均无不良影响。食品添加剂中柠檬酸对3种色素有增色作用,抗坏血酸和苯甲酸钠有减色作用,蔗糖和葡萄糖对3种色素无明显影响。
紫叶稠李;稠李;色素;理化性质
色素可以分为天然色素和人工合成色素。人工合成色素大多属于偶氮类型化合物,其中有些在人体内可代谢生成β-萘胺和α-氨基-萘酚,对人体有很大毒副作用[1]。因此,不少合成色素在各国允许使用的程度被大大限制,尤其是在食品、医药和化妆品行业中,越来越多的国家开始禁止使用合成色素[2-3]。与合成色素相比,天然色素具有以下突出优点[4]:1)绝大多数天然色素无毒副作用。2)一般天然色素保留了很多天然物质,具有一定的营养价值和保健功能。3)天然色素的着色比较自然,更接近于天然物质的颜色等。目前,我国允许使用的食品天然色素仅有40余种[4],尚有大量的天然色素未被研究,因此开发天然色素已经成为世界实用色素发展的总趋势。
稠李(Padus racemosa)和紫叶稠李(Padus virginiana),为蔷薇科(Rosaceae)稠李属植物,果熟期为7~8月,味涩,微甜[5-6]。稠李果近球形,较小,径约0.7~0.8cm,成熟时呈紫黑色;紫叶稠李小果球形,径约0.5~0.6cm,成熟时呈紫红色;紫叶稠李大果,径约1~1.2cm,成熟时呈紫黑色。稠李果、紫叶稠李小果和紫叶稠李大果均含有大量天然红色素。目前,对稠李的研究多为稠李叶片的成分和稠李苗木繁育方面[7-9],而对其果实丰富的色素资源的开发和研究却未
见报道。本实验对紫叶稠李小果、紫叶稠李大果和稠李果色素的理化性质进行研究,旨在为稠李属果实色素的开发利用提供一定参考。
1 材料与方法
1.1 材料与试剂
紫叶稠李小果、紫叶稠李大果、稠李果于2009年8月采于黑龙江省松花江完达山脉,-40℃速冻保存。
无水乙醇、柠檬酸、葡萄糖、蔗糖、苯甲酸钠、抗坏血酸、Na2SO3、Na2HPO4等均为分析纯。
1.2 仪器与设备
HR1707榨汁机 飞利浦公司;DK-98-11A型电热恒温水浴锅 天津市泰斯特仪器有限公司;FA2004电子分析天平 上海天平仪器厂;PHS-3C精密pH计 上海雷磁仪器厂;T6新世纪紫外-可见分光光度计 北京普析仪器公司;光照培养箱 哈尔滨市东联电子技术开发有限公司。
1.3 方法
1.3.1 色素的提取
紫叶稠李小果、紫叶稠李大果和稠李果解冻后打浆,用体积分数为60%的乙醇溶液(pH2)作提取溶剂,料液比1:4(m/V)常温提取两次,第2次提取溶剂用量减半,每次提取24h,提取液抽滤后合并,50℃减压浓缩得各色素浓缩液(均约为所用溶液的1/4)。
1.3.2 色素的可见光谱特性比较
取各色素浓缩液,分别用pH2.0柠檬酸-磷酸氢二钠缓冲液稀释到适当浓度。用紫外-可见分光光度计在可见光波长范围内扫描,分别记录3种色素溶液的吸收光谱及最大吸收波长(λmax)。
1.3.3 pH值对色素稳定性的影响
分别配制pH1的盐酸-氯化钾缓冲液、pH2~6、pH7、pH9的柠檬酸-磷酸氢二钠缓冲液[10-11]、pH11、pH13的磷酸氢二钠-氢氧化钠缓冲液。取1mL各色素浓缩液,以pH2缓冲溶液稀释色素浓缩液使其在最大吸收波长下的吸光度接近0.800,以其他pH值缓冲溶液配制的稀释液都与同种果以pH2缓冲溶液配制的稀释液的稀释倍数相同。得3种色素各pH值等量色素溶液,观察其颜色变化。
1.3.4 光照对色素稳定性的影响
取各色素浓缩液,分别用pH2.0柠檬酸-磷酸氢二钠缓冲液稀释到一定浓度,测定在最大吸收波长处的吸光度,使得3种色素溶液在最大吸收波长处的吸光度接近0.800[10],作为各色素稀释液(以下各小节色素稀释液的配制方法与此相同)。将各色素稀释液置于光照培养箱中,直射光(10000lx)下照射1~5d,记录每天各色素溶液在最大吸收波长处的吸光度。
1.3.5 温度对色素稳定性的影响
取适量各色素稀释液分别置于20、40、60、80℃和100℃下恒温水浴锅中2.5h,每隔30min取样一次,冷却至室温后,测定3种色素溶液在最大吸收波长处的吸光度[12-15]。
1.3.6 氧化剂对色素稳定性的影响
取各色素稀释液,分别加入与稀释液等体积不同体积分数的H2O2溶液,每隔10min测定3种色素溶液在最大吸收波长处的吸光度。
1.3.7 还原剂对色素稳定性的影响
取各色素稀释液,分别加入与稀释液等体积不同质量浓度的Na2SO3溶液,每隔10min测定3种色素溶液在最大吸收波长处的吸光度。
1.3.8 金属离子对色素稳定性的影响
取各色素稀释液分别加入与稀释液等体积0.1mol/L的不同金属离子溶液,在1h和24h后测定3种色素溶液在最大吸收波长处的吸光度,并观察溶液颜色变化。
1.3.9 抗坏血酸对色素稳定性的影响
取各色素稀释液分别加入与稀释液等体积不同质量浓度的抗坏血酸溶液,在1h和24h后测定3种色素溶液在最大吸收波长处的吸光度。
1.3.10 柠檬酸对色素稳定性的影响
取各色素稀释液分别加入与稀释液等体积不同质量浓度的柠檬酸溶液,在1h和24h后测定3种色素溶液在最大吸收波长处的吸光度。
从众,有三类情况:一是与大家的意见、观点一致,所以赞成,举手,鼓掌,同意;二是对于大多数人的意见、观点并不赞成,也跟着举手、鼓掌,表示赞成或同意;三是本身没有主见,不知是非,人云亦云,好吃懒做随大帮,屎壳郎跟着屁瞎哄哄。后一种人,不值一议。
1.3.11 其他常用食品添加剂对色素稳定性的影响
取各色素稀释液分别加入与稀释液等体积5mg/mL苯甲酸钠、200mg/mL蔗糖和200mg/mL葡萄糖溶液,在1h和24h后测定3种色素溶液在最大吸收波长处的吸光度。
2 结果与分析
2.1 色素的可见光谱特性比较

图1 紫叶稠李小果色素、紫叶稠李大果色素和稠李果色素光谱特性比较Fig.1 Visible absorption spectra of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
紫叶稠李小果、紫叶稠李大果和稠李果色素在pH2.0的柠檬酸-磷酸氢二钠缓冲液中的可见光谱见图1。
由图1可见,紫叶稠李小果、紫叶稠李大果和紫叶稠李果色素在波长400~600nm之间有一个明显的吸收峰,最大吸收波长均为513nm。
2.2 pH值对色素稳定性的影响
按1.3.3节的方法,配制不同pH值的缓冲溶液,记录紫叶稠李小果、紫叶稠李大果和稠李果色素在不同pH值溶液中的颜色变化,结果见表1。
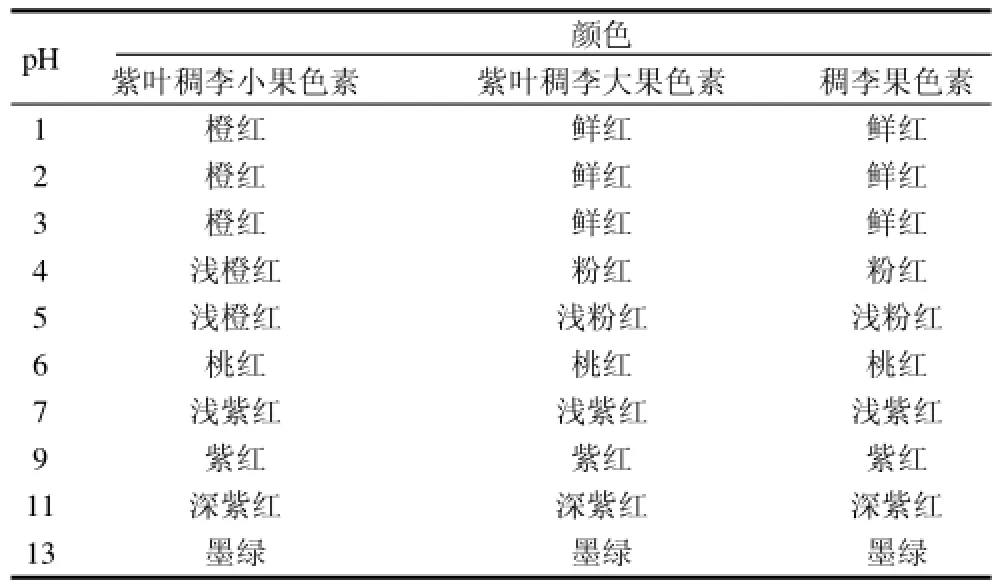
表1 pH值对色素稳定性的影响Table 1 pH stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
由表1可知,紫叶稠李小果色素在pH1~5时呈橙红色,随着pH值升高颜色逐渐变浅。紫叶稠李大果和稠李果色素在pH1~3时呈鲜红色,pH4~5时由粉红过渡到浅粉红。当pH≥6时,3种色素颜色均由桃红向墨绿转变。由此可见,紫叶稠李小果、紫叶稠李大果和稠李果色素在pH≤3的酸性介质中能够保持色素本身的颜色,可用于一些酸性食品如果汁、果酒的着色。
2.3 光照对色素稳定性的影响
按1.3.4节的方法,配制紫叶稠李小果、紫叶稠李大果和稠李果色素稀释液。3种色素稀释液经不同时间的直射光照射后在最大吸收波长处的吸光度如图2所示。

图2 光照对色素稳定性的影响Fig.2 Light stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
从图2可以看出,紫叶稠李小果、紫叶稠李大果和稠李果色素随光照时间的延长吸光度逐渐下降,但下降幅度不大。相对而言,在直射光照射的相同时间内色素吸光度由大到小为,紫叶稠李小果>紫叶稠李大果>稠李果。从降解速率来看,3种色素均在直射光照射0~3d降解较慢,但稠李果色素的降解速率要大于紫叶稠李小果和紫叶稠李大果;3~5d内3种色素均降解较快,且降解速率差别不大。 由此可见,光稳定顺序为,紫叶稠李小果>紫叶稠李大果>稠李果。
2.4 温度对色素稳定性的影响
按1.3.5节的方法,测定温度对紫叶稠李小果、紫叶稠李大果和稠李果色素稳定性的影响,3种色素稀释液经不同温度恒温水浴加热不同时间冷却后,分别测定其在最大吸收波长处的吸光度,如图3所示。
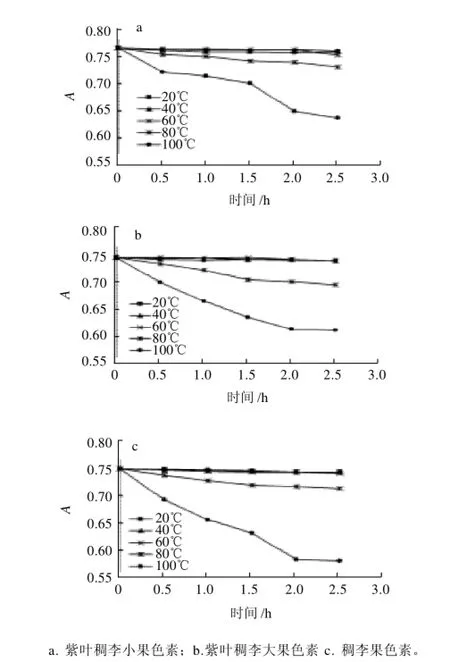
图3 温度对色素稳定性的影响Fig.3 Temperature stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
从图3可以看出,加热温度不超过60℃对紫叶稠李小果、紫叶稠李大果和稠李果色素的稳定性影响不明显。当加热温度为80℃时,3种色素随时间的延长吸光度明显降低,色素的颜色均变浅;在加热相同时间内色
素的热稳定性顺序为,紫叶稠李小果>稠李果>紫叶稠李大果;从降解速率来看,3种色素均在1.5h内降解最快,色素的降解速率由小到大为,紫叶稠李小果<稠李果<紫叶稠李大果。当加热温度为100℃时,3种色素的吸光度随时间的延长均低于同时间80℃时色素的吸光度;在加热相同时间内色素的热稳定性顺序为;紫叶稠李小果>紫叶稠李大果>稠李果;从降解速率来看,紫叶稠李小果色素在0.5h和1.5~2h内降解最快;紫叶稠李大果和稠李果色素在2h内降解最快。
2.5 氧化剂对色素稳定性的影响
按1.3.6节的方法,测定不同体积分数H2O2溶液对紫叶稠李小果、紫叶稠李大果和稠李果色素稳定性的影响。3种色素在不同体积分数H2O2溶液中存放不同时间后,测定其在最大吸收波长处的吸光度,如图4所示。

图4 H2O2对色素稳定性的影响Fig.4 Oxidative stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
从图4可以看出,随着H2O2体积分数的提高和时间的延长,紫叶稠李小果、紫叶稠李大果和稠李果色素吸光度均逐渐下降,溶液颜色逐渐变浅。加入不同体积分数的H2O2(体积分数≥0.5%)溶液后,3种色素溶液在10min后吸光度快速下降;10~60min的同时间内,H2O2体积分数越高,色素吸光度越低,吸光度的下降速率越小。加入相同体积分数H2O2(体积分数≥0.5%)溶液后,随着时间的延长,色素的吸光度和吸光度的下降速率均逐渐减小。以上两种情况下,色素吸光度由大到小均为,紫叶稠李小果>稠李果>紫叶稠李大果;色素吸光度的下降速率均为,紫叶稠李小果最小,其他两种色素相差不大。在加入0.1%H2O2后,10min内3种色素吸光度下降均不明显,10~60min内,3种色素的吸光度匀速下降,吸光度的下降速率由小到大为,紫叶稠李小果<稠李果<紫叶稠李大果。由此可见,3种色素的耐氧化性顺序为,紫叶稠李小果>稠李果>紫叶稠李大果。因此,3种色素在生产应用中应尽量避免与氧化剂接触。
2.6 还原剂对色素稳定性的影响
按1.3.7节的方法,测定不同质量浓度Na2SO3溶液对紫叶稠李小果、紫叶稠李大果和稠李果色素稳定性的影响。3种色素在不同质量浓度Na2SO3溶液中存放不同时间后,测定其在最大吸收波长处的吸光度,如图5所示。
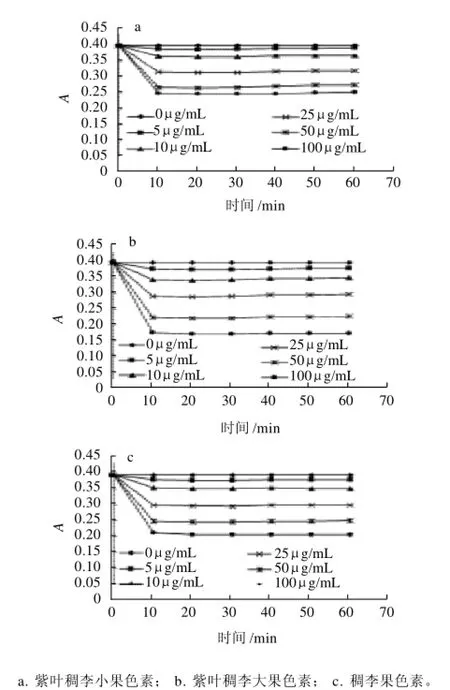
图5 Na2SO3对色素稳定性的影响Fig.5 Reducing stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
从图5可以看出,加入Na2SO3溶液后,紫叶稠李小果、紫叶稠李大果和稠李果色素吸光度在10min后迅速下降,加入的Na2SO3溶液质量浓度越大,色素的吸光度越低,色素颜色越浅。相对而言,3种色素在加入相同质量浓度Na2SO3溶液后的吸光度由大到小为,紫叶稠李小果>稠李果>紫叶稠李大果。因此,3种色素的耐还原能力顺序为,紫叶稠李小果>稠李果>紫叶稠李大果。在加入不同质量浓度的Na2SO3溶液10~60min内,3种色素的吸光度均基本维持不变,说明Na2SO3对色素的影响非常迅速。紫叶稠李小果、紫叶稠李大果和稠李果在生产应用中应尽量避免与还原剂的接触。
2.7 金属离子对色素稳定性的影响
按1.3.8节的方法,测定0.1mol/L不同金属离子对紫叶稠李小果、紫叶稠李大果和稠李果色素稳定性的影响。3种色素在不同金属离子溶液中存放1h和24h后,测定其在最大吸收波长处的吸光度,见表2。
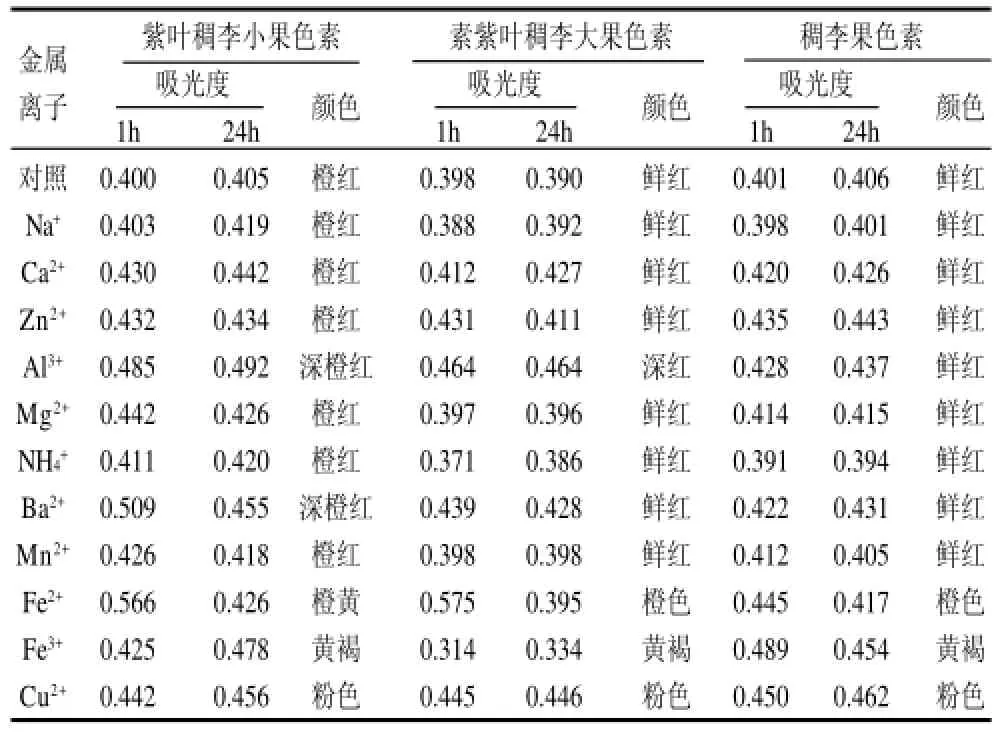
表2 金属离子对色素稳定性的影响Table 2 Effects of metal ions on the stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
从表2可以看出,向3种色素溶液加入Al3+1h后,紫叶稠李小果和紫叶稠李大果色素吸光度上升,24h后吸光度基本不变,溶液颜色略有加深,说明Al3+对该两种色素有护色作用,但对稠李果色素无明显影响;加入Ba2+1h后,紫叶稠李小果色素的吸光度上升,24h后下降,说明有Ba2+存在时紫叶稠李小果色素不稳定,但对紫叶稠李大果和稠李果色素无明显影响;Fe2+、Fe3+、Cu2+均改变3种色素溶液的颜色,所以在制取和使用这3种色素的过程中应避开铁、铜器。其他金属离子对紫叶稠李小果、紫叶稠李大果和稠李果色素均无明显影响。
2.8 抗坏血酸对色素稳定性的影响
按1.3.9节的方法,测定不同质量浓度抗坏血酸溶液对紫叶稠李小果、紫叶稠李大果和稠李果色素稳定性的影响。3种色素在不同质量浓度抗坏血酸溶液中存放1h和24h后,测定其在最大吸收波长处的吸光度,见表3。
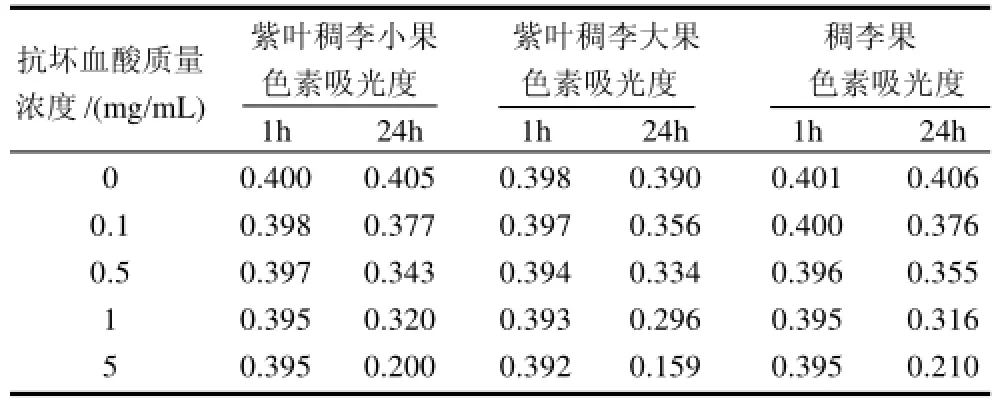
表3 抗坏血酸对色素稳定性的影响Table 3 Effect of ascorbic acid on the stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
由表3可以看出,紫叶稠李小果、紫叶稠李大果和稠李果色素在加入不同质量浓度的抗坏血酸24h后的的吸光度均低于对应1h后的吸光度,抗坏血酸质量浓度越大,色素吸光度越低,肉眼所见色素的颜色越浅。因此,向该3种色素加入抗坏血酸时要尽量降低添加浓度。相对而言,在加入相同质量浓度的抗坏血酸24h后,紫叶稠李小果和稠李果色素吸光度相差不多,均高于紫叶稠李大果色素吸光度。因此,3种色素中紫叶稠李大果色素在有抗坏血酸的存在下稳定性最差。
2.9 柠檬酸对色素稳定性的影响
按1.3.10节的方法,测定不同质量浓度柠檬酸溶液对紫叶稠李小果、紫叶稠李大果和稠李果色素稳定性的影响。3种色素在不同质量浓度柠檬酸溶液中存放1h和24h后,测定其在最大吸收波长处的吸光度,见表4。

表4 柠檬酸对色素稳定性的影响Table 4 Effect of citric acid on the stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
从表4可以看出,紫叶稠李小果、紫叶稠李大果和稠李果色素在1h和24h的吸光度均随添加柠檬酸质量浓度的增大而逐渐升高,肉眼所见3种色素的颜色均逐
渐加深。但在加入相同质量浓度的柠檬酸后,3种色素在24h的吸光度和1h的吸光度相比均变化不大,且3种色素间吸光度差异也不大,说明柠檬酸对3种色素增色迅速,增色效果相似。
2.10 其他常用食品添加剂对色素稳定性的影响
按1.3.11节的方法,测定不同食品添加剂对紫叶稠李小果、紫叶稠李大果和稠李果色素稳定性的影响。3种色素在不同食品添加剂中存放1h和24h后,测定其在最大吸收波长处的吸光度,见表5。
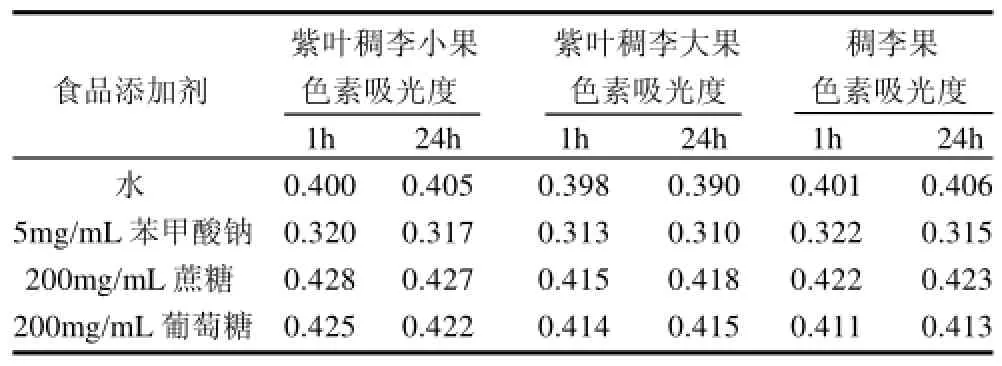
表5 食品添加剂对色素稳定性的影响Table 5 Effects of food additives on the stability of the pigments from the fruits of Padus racemosa and large-fruit and small-fruit species of Padus virginiana
从表5可以看出,苯甲酸钠对3种色素均有一定减色作用,对3种色素的减色程度差异不明显。蔗糖和葡萄糖对3种色素的稳定性影响不大。因此,为保持色素的稳定性要尽量避免3种色素与苯甲酸钠接触。
3 结 论
在pH≤3时,紫叶稠李小果、紫叶稠李大果和稠李果色素能保持色素本身的颜色,分别呈橙红色、鲜红色和鲜红色。pH2时,3种色素在可见光处的最大吸收波长均为513nm。光照和温度不超过60℃时,3种色素较稳定,但对氧化剂和还原剂较为敏感。相对而言,紫叶稠李小果色素的耐光、耐热和耐氧化还原能力强于紫叶稠李大果和稠李果色素;而稠李果色素耐氧化还原能力强于紫叶稠李大果色素,但耐光能力不如紫叶稠李大果色素。Fe2+、Fe3+、Cu2+对3种色素稳定性有不良影响,Al3+对紫叶稠李小果和紫叶稠李大果色素有增色作用,Ba2+存在时紫叶稠李小果色素不稳定,其他金属离子对3种色素无明显影响。食品添加剂中柠檬酸对3种色素有增色作用,抗坏血酸和苯甲酸钠有减色作用,蔗糖和葡萄糖对3种色素无明显影响。
本实验对紫叶稠李小果、紫叶稠李大果和稠李果色素理化性质的研究,为该3种色素的开发利用提供了可供参考的条件。可以看出,该3种色素在自然条件下,如自然光照,中低温度,酸性溶液中保存、应用的稳定性较好,是一种优良的色素资源,可添加或用于食品、药物、化妆品、生物制品等方面。由此可见,稠李和紫叶稠李不仅具有较高的观赏价值,是园林绿化的优良树种,其果实中富含的大量红色素也是潜在的天然着色剂和理想色素来源。
[1] 吴灿军, 赵萍, 王雅, 等. 天然色素及枸杞色素的提取和抗氧化作用的研究进展[J]. 陕西农业科学, 2010(1): 103-107.
[2] 杨青珍, 王锋, 孙元琳. 甜樱桃果实红色素的提取和稳定性研究[J].食品科学, 2010, 31(4): 120-122.
[3] MEKKAWY H A, ALI M O, EL-ZAWAHRY A M. Toxic effect of synthetic and natural food dyes on renal and hepatic functions in rats[J]. Toxicology Letters, 1998, 95(1):155.
[4] 吴京平. 新型天然食品红色素的提取和稳定性研究[J]. 北京联合大学学报:自然科学版, 2010, 24(1): 17-20.
[5] 王庆菊, 李晓磊, 王磊, 等. 紫叶稠李叶片花色苷及其合成相关酶动态[J]. 林业科学, 2008, 44(3): 45-49.
[6] 王书凯, 徐善光, 高千荣, 等. 稠李和紫叶稠李的形态识别及园林应用[J]. 辽宁林业科技, 2010(1): 55; 59.
[7] 金晓胜, 王耀民. 稠李育苗及栽培技术[J]. 农村科技, 2008(8): 63.
[8] 帕提古丽, 刘晓芳, 李萍. 紫叶稠李苗木繁育技术[J]. 防护林科技, 2010(2): 114-116.
[9] 李萍, 刘晓芳, 黄闵敏, 等. 紫叶稠李叶片色素测定及动态变化分析[J]. 中国林副特产, 2009(1): 11-13.
[10] 赵慧芳, 李维林, 王小敏, 等. 悬钩子类果实色素理化性质研究[J].食品工业科技, 2009, 30(2): 248-250; 253.
[11] ZHANG Hechun, ZHAN Jixun, SU Keman, et al. A kind of potential food additive produced by Streptomyces coelicolor: characteristics of blue pigment and identification of a novel compound, λ-actinorhodin [J]. Food Chemistry, 2006, 95(2): 186-192.
[12] 杨颖, 夏其乐, 陈剑兵, 等. 紫薯花色苷的理化性质研究[J]. 食品工业科技, 2009, 30(11): 251-253; 256.
[13] PAN Yingming, ZHU Zhiren, HUANG Zhili, et al. Characterisation and free radical scavenging activities of novel red pigment from Osmanthus fragrans ,seeds[J]. Food Chemistry, 2009, 112(4): 909-913.
[14] WANG Hengshan, PAN Yingming, TANG Xujie, et al. Isolation and characterization of melanin from Osmanthus fragrans,seeds[J]. LWT -Food Science and Technology, 2006, 39(5): 496-502.
[15] CEPEDA E, GARCA M, RENOBALES G, et al. Pimento (Capsicum annuum L.) puree: preparation, physicochemical properties and microscopical characterisation[J]. Journal of Food Engineering, 2000, 45(2): 85-92.
Physico-chemical Properties of the Pigments from the Fruits of Padus L. Plants
WANG Zhen-yu1,2,REN Jian1,ZHANG Ning1,HAO Xiu-mei1
(1. School of Forestry, Northeast Forestry University, Harbin 150040, China;2. School of Food Science and Engineering, Harbin Institute of Technology, Harbin 150090, China)
The spectral and physico-chemical properties of the pigments extracted from the fruits of Padus racemosa and largefruit and small-fruit species of Padus virginiana were investigated in order to offer helpful
for the development and utilization of these pigments. The results showed that the all these pigments from different Padus L. plants had good resistance to light and heat but were sensitive to pH value, oxidants and reductants. The pigment from Padus racemosa exhibited higher resistance to oxidation and reduction but poorer resistance to light when compared with that from large-fruit species of Padus virginiana, while the resistance of both of them to light, heat, oxidation and reduction was weaker than that of the pigment from small-fruit species of Padus virginiana. Except Fe2+, Fe3+and Cu2+, other metal ions including Na+, Ca2+, Zn2+, Al3+, Mg2+, NH4+, Ba2+and Mn2+had no adverse effect on all these pigments. Citric acid as a common food additive had hyperchromic effect on them, while two others, ascorbic acid and sodium benzoate had hypochromic effect. Sucrose and glucose had no significant effect.
Padus racemosa;Padus virginiana;pigment;physico-chemical properties
TS255.1
A
1002-6630(2010)17-0092-06
2010-04-25
王振宇(1957—),男,教授,博士,研究方向为功能性食品。E-mail:wzy219001@yahoo.com.cn
