富硒沼泽红假单胞菌G3菌与牛初乳复配改善小鼠免疫功能的作用研究
2010-03-21杨启银王家芳贾秉晟管海华
杨启银,王家芳,贾秉晟,管海华,刘 青
富硒沼泽红假单胞菌G3菌与牛初乳复配改善小鼠免疫功能的作用研究
杨启银1,2,3,王家芳1,贾秉晟1,管海华1,刘 青1
(1. 南京师范大学生命科学学院,江苏 南京 210046;2. 南京市微生物工程技术研究中心,江苏 南京 210046;3. 江苏省微生物资源工程化技术研究中心,江苏 南京 210046)
目的:探讨富硒沼泽红假单胞菌G3菌(简称富硒G3菌)与牛初乳复配对小鼠免疫功能的影响。方法:将富G3菌与牛初乳复配形成富硒牛初乳,用环磷酰胺构建小鼠免疫低下模型,对免疫低下小鼠灌胃富硒G3菌、牛初乳和富硒牛初乳,50d后测定各组小鼠脏器指数、白细胞数、T淋巴细胞阳性率、血清SOD酶活性、全血GSH-Px活性,同时计算平均每日进食饲料质量与体质量增加量的比值。结果:富硒G3菌、牛初乳、富硒牛初乳均能提高免疫低下小鼠对饲料的利用率,能提高免疫低下小鼠SOD、GSH-Px活性、白细胞数和T淋巴细胞阳性率,其中富硒牛初乳高剂量组效果最为明显,说明富硒牛初乳高剂量组能显著增强小鼠的免疫功能。
硒;牛初乳;沼泽红假单胞菌;环磷酰胺;免疫功能
牛初乳是奶牛正常分娩后一周内分泌的乳汁,初乳中营养物质十分丰富,并含有多种特殊的生理活性物质,主要分为免疫活性因子和生长因子两类。研究表明,初乳不仅可以提供幼畜生长发育所必需的营养成分,而且还具有提高免疫力、改善胃肠道、提高生产性能等作用[1-3]。沼泽红假单胞菌(Rhodopseudomonas palustris)是红螺菌科红假单胞菌属的一种。由于沼泽红假单胞菌含有丰富的营养活性成分及其独特的生物转化功能,已应用于乳酸饮料和酒类中,成为一种新的食品资源和饲料资源[4]。近年来它的免疫调节、抗氧化作用也引起人们的关注。硒(Se)是人体必需的微量元素,体内缺硒会引起多种疾病。补硒可激活体液和细胞免疫能力,从而起到抗癌作用,补硒也能改善肝脏功能,促进肝细胞的再生[5-10]。富硒沼泽红假单胞菌是以还原
态的硒化物作为电子供体培养而成的一种含有有机硒化合物的菌体[11]。沼泽红假单胞菌本身营养丰富,含有多种活性成分[12],并且是唯一由国家农业部批准作为饲料添加剂使用的光合细菌[13]。目前,国内用富硒沼泽红假单胞菌与牛初乳复配改善小鼠免疫力低下的研究尚未见报道。
本实验用沼泽红假单胞菌作为一种新的转化有机硒的载体,将富硒沼泽红假单胞菌G3菌与牛初乳复配形成富硒牛初乳,初步探讨富硒牛初乳对环磷酰胺所致小鼠免疫低下的影响,为微生物富硒与牛初乳复配进行保健品开发提供参考。
1 材料与方法
1.1 材料、试剂与仪器
牛初乳冻干粉(简称牛初乳),免疫球蛋白含量21%,由江苏吴中大自然生物工程有限责任公司提供;沼泽红假单胞菌(Rhodopseudomonas palustris)G3(本实验室保存);富硒沼泽红假单胞菌G3(本实验室制备);富硒牛初乳(本实验室制备);注射用环磷酰胺 江苏恒瑞医药有限公司。
昆明种小鼠,雄性129只,雌性33只,体质量(20±2)g,购于南京中医药大学动物繁殖中心。
FA1004电子天平 上海舜宇恒平科学仪器有限公司;Centrifuge5804R离心机 德国Eppendorf公司;CHA-213生物显微镜 日本Olympus公司;UV757紫外-可见光分光光度计 上海精密科学仪器有限公司。
1.2 方法
1.2.1 富硒沼泽红假单胞菌G3的制备
采用分批补硒补料方法制备富硒G3菌:挑取耐硒G3菌单菌落于液体培养基做种子活化液,120h后将种子活化液按5%的接种量接种于装液量为200mL的250mL的具塞三角瓶中,于接种后12h加硒,使培养基亚硒酸钠浓度达到4×10-5mol/L,在培养过程的36h和48h分别补料,并在36h补硒,使培养基亚硒酸钠总浓度达到5×10-5mol/L,制备富硒G3菌。
沼泽红假单胞菌的营养成分、B族维生素含量和类胡萝卜素含量见参考文献[12]。
1.2.2 富硒牛初乳
按照1.2.1节方法制备富硒G3菌,5000r/min离心30min,用双蒸水反复冲洗去除游离无机硒,收集菌体,烘干研磨后备用,有机硒含量847.42μg/g。富硒G3菌与牛初乳复配,按m(富硒G3菌):m(牛初乳)=1:20000配制成富硒牛初乳。
1.2.3 环磷酰胺诱导小鼠免疫力低下模型[14-19]
小鼠正常饲养3 d后随机分组,分为空白对照组(A)、免疫低下模型组(B)、富硒G3菌低剂量组(C,硒剂量为0.833μg/kg bw)、富硒G3菌高剂量组(D,硒剂量为8.333μg/kg bw)、牛初乳低剂量组(E,灌胃剂量为0.017g/kg bw)、牛初乳高剂量组(F,灌胃剂量为0.167g/kg bw)、富硒牛初乳低剂量组(G,灌胃硒剂量为0.833μg/kg bw、灌胃牛初乳剂量为0.017g/kg bw)、富硒牛初乳高剂量组(H,灌胃硒剂量为8.333μg/kg bw、灌胃牛初乳剂量为0.167g/kg bw),灌胃体积均为5mL/kg bw。每天灌胃一次,灌胃4 7 d。
小鼠共分为8组,每组12只。每10d定时称量体质量一次,颈背部皮下注射环磷酰胺(空白对照组注射生理盐水),每天更换垫料,记录小鼠健康以及发病情况,定时称量给料量及剩料量,计算平均每日进食饲料质量与体质量增加量的比值。实验共进行50d,实验结束时,取空腹16h的小鼠尾血测定T淋巴细胞阳性率,摘眼球取血处死,测定白细胞数,全血GSH-Px酶活性、血清S O D酶活性,取肝脏、脾脏、胸腺、肾脏,去除结缔组织后称质量,计算脏器指数。
1.2.3.1 小鼠平均每日进食饲料质量与体质量增加量的比值测定
实验期间,每10d定时称小鼠体质量,每天定时称量给料量及剩料量,计算平均每日进食饲料质量与体质量增加量的比值。
平均每日进食饲料质量与体质量增加量的比值(F/G)=平均日采食量/平均日体质量增加量 (1)
1.2.3.2 小鼠脏器指数
实验结束时,取空腹16h小鼠的肝脏、脾脏、胸腺、肾脏,去除结缔组织后称质量,计算脏器指数。
肝脏指数=(肝脏质量/体质量)×100 (2)
肾脏指数=(肾脏质量/体质量)×100 (3)
“办公自动化系统使一线医务人员足不出户即可完成大量行政审批申请工作,可实时查询各节点审批情况,审批完成后自动归档到各归口科室进行办理,让我们的医务人员有更多的时间为患者提供更多的优质服务。”
脾脏指数=(脾脏质量/体质量)×100 (4)
胸腺指数=(胸腺质量/体质量)×100 (5)
1.2.3.3 小鼠血清SOD酶活力及全血GSH-Px活性测定
使用南京建成生物工程研究所试剂盒测定。
1.2.3.4 小鼠白细胞数[14,20]
在2mL离心管中加入0.38mL白细胞稀释液,准确吸取全血20μL,擦去枪头外壁余血,将枪头插入离心管中稀释液的底部,轻轻将血放出,并吸取上清液清洗多次,混匀。待红细胞完全破坏,液体变成棕褐色后,再次混匀后滴入血球计数板中,静置2~3min,待白细胞下沉,用低倍镜计数白细胞总数(个/L)。
白细胞数/(个/L)= N/4×10×20×106(6)式中:N为4个大方格内白细胞总数。
1.2.3.5 小鼠T淋巴细胞阳性率[21-23]
取鼠尾血一滴至洁净载玻片一端,推成厚薄适当的
血片,冷风迅速吹干→将血片置冷的福尔马林-丙酮固定液中,4℃固定1min→取出血片用自来水冲洗3min,再用双蒸馏水将玻片上剩余的自来水冲掉,冷风迅速吹干→将经过固定、冲洗并干燥后的血片放入孵育液中,37℃孵育2h→取出血片立即在自来水中冲洗3min,再用蒸馏水冲洗,以除去血片上的沉淀物→用孔雀绿染色液将血片复染1min左右,双蒸馏水先后冲洗,晾干,油镜观察、计数100个淋巴细胞,求出酯酶染色(ANAE)阳性细胞百分数。
1.2.4 数据处理与分析
数据的统计处理采用Origin 6.0软件进行方差分析,结果以平均数±标准差(x±s)表示。
2 结果与分析
2.1 小鼠生长性能
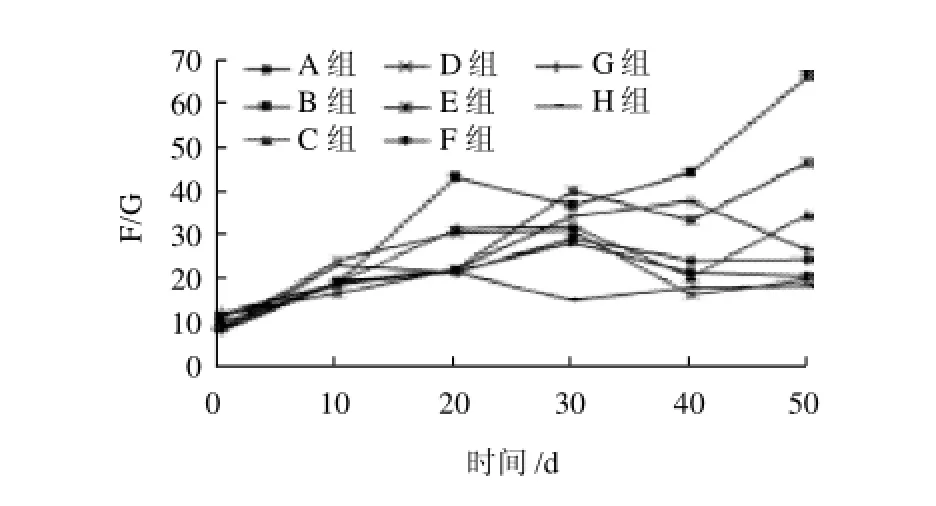
图1 不同饲养阶段各组日平均每日进食饲料质量与体质量增加量的比值变化Fig.1 Change of F/G in each group during different feeding periods
由图1可以看出,在0~10d的饲养阶段,各组间F/G差别不大。在饲养10~20d时B组的F/G开始均高于A组及各处理组,说明B组对饲料的利用率不高,其他各处理组能够较好地吸收利用饲料,在饲养30~50d时B组的平均F/G越来越高,是C组的1.93倍、D组的3.36倍、E组的1.42倍、F组的3.23倍、G组的2.5倍、H组的3.59倍,说明免疫功能低下的B组对饲料的利用率越来越低。
2.2 小鼠脏器指数
由表1可以看出,B组各项脏器指数普遍比A组和各处理组低,说明环磷酰胺对小鼠的生理功能有一定的影响。比较A组与B组各脏器指数,差异极显著(P<0.01),说明免疫功能低下模型成功。比较C、D、E、F、G、H组与B组的差异性,各项脏器指数均高于B组,其中脾脏指数最明显,各处理组均高于B组,C组和E组差异显著(P<0.05),D、F、G、H组差异极显著(P<0.01);比较H组与B组的肝脏、肾脏、脾脏和胸腺指数,H组明显高于B组,超过了A组水平,与B组差异极显著(P<0.01)。实验结果表明, C、D、E、F、G组和H组的各项脏器指数增加,其中以H组的效果最为明显。
表1 富硒牛初乳对免疫低下小鼠脏器指数的影响±s)Table 1 Effect of selenium-enriched bovine colostrumson on organ index of immunodepressed mice (±s)

表1 富硒牛初乳对免疫低下小鼠脏器指数的影响±s)Table 1 Effect of selenium-enriched bovine colostrumson on organ index of immunodepressed mice (±s)
注:*.与免疫低下模型组比较,差异显著(P<0.05);**.与免疫低下模型组比较,差异极显著(P<0.01)。下同。
组别肝脏指数肾脏指数脾脏指数胸腺指数A5.003±0.301**1.280±0.057**0.374±0.021**0.234±0.007** B4.384±0.2681.204±0.0350.297±0.0210.180±0.012 C4.441±0.1681.224±0.0270.322±0.027*0.184±0.006 D4.919±0.165**1.262±0.043**0.338±0.009**0.187±0.006 E4.412±0.0771.219±0.0310.314±0.005*0.182±0.002 F4.883±0.179**1.265±0.029**0.334±0.009**0.186±0.005 G4.721±0.151**1.243±0.035*0.321±0.005**0.186±0.006 H5.010±0.113**1.287±0.023**0.380±0.024**0.244±0.007**
2.3 小鼠血清SOD酶活性和全血GSH-Px酶活性
表2 富硒牛初乳对小鼠血清SOD活性和全血GSH-Px活性影响±s)Table 2 Effect of selenium-enriched bovine colostrumson on the activities of SOD and GSH-Px in blood of immunodepressed mice±s)
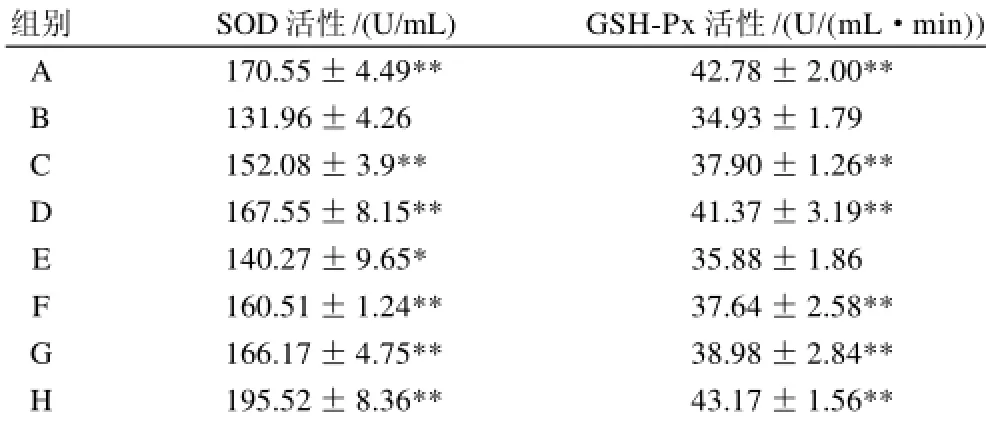
表2 富硒牛初乳对小鼠血清SOD活性和全血GSH-Px活性影响±s)Table 2 Effect of selenium-enriched bovine colostrumson on the activities of SOD and GSH-Px in blood of immunodepressed mice±s)
组别SOD活性/(U/mL)GSH-Px活性/(U/(mL·min)) A 170.55±4.49**42.78±2.00** B 131.96±4.2634.93±1.79 C 152.08±3.9**37.90±1.26** D 167.55±8.15**41.37±3.19** E 140.27±9.65*35.88±1.86 F 160.51±1.24**37.64±2.58** G 166.17±4.75**38.98±2.84** H 195.52±8.36**43.17±1.56**
由表2可知,A组与B组血清SOD活性相比较,差异极显著(P<0.01),说明免疫力低下模型成功。比较C、D、E、F、G、H组与B组小鼠的血清S O D活性差异性,各处理组血清SOD活性均有不同程度的提高,C组提高了20.12U/mL、D组提高了35.59U/mL、E组提高了8.31U/mL、F组提高了28.55U/mL、G 组提高了34.21U/mL、H组提高了63.56U/mL,与B组相比较,差异极显著(P<0.01)。结果表明,不同剂量的有机硒和牛初乳均能使各处理组血清SOD活性有所提高,其中H组SOD活性最高。说明H组具有较强的清除体内自由基,提高免疫能力。
比较A组与B组全血GSH-Px活性,A组比B组增加了7.85U/(mL·min)差异极显著(P<0.01),说明免疫力低下造模成功。比较C、D、E、F、G、H组与B组小鼠的全血GSH-Px活性差别,各处理组GSH-Px
活性比B组均有不同程度的提高,C组提高了2.97 U/(mL·min)、D组提高了6.44U/(mL·min)、F组提高了2.71U/(mL·min)、G 组提高了4.05U/(mL·min)、H 组提高了8.28U/(mL·min),差异极显著(P<0.01);E组提高最少,仅提高了0.95U/(mL·min),为差异不显著(P>0.05)。结果表明,C、D、F、G、H组均可提高小鼠全血GSH-Px活性,其中H组GSH-Px活性最高。说明H组具有较强清除体内自由基能力,改善受损伤细胞,提高免疫力。
2.4 小鼠白细胞数和T淋巴细胞阳性率
表3 富硒牛初乳对免疫低下小鼠白细胞数和T淋巴细胞阳性率的影响(±s)Table 3 Effect of selenium-enriched bovine colostrumson on the counts of white cells in immunodepressed mice and the population of positive T-cells (±s)

表3 富硒牛初乳对免疫低下小鼠白细胞数和T淋巴细胞阳性率的影响(±s)Table 3 Effect of selenium-enriched bovine colostrumson on the counts of white cells in immunodepressed mice and the population of positive T-cells (±s)
组别白细胞数(×109个/L)T淋巴细胞阳性率/% A 7.97±0.16**61.47±3.34** B 4.84±0.1739.89±1.98 C 5.10±0.29*42.36±2.71* D 7.86±0.25**55.03±2.44** E 5.02±0.2641.78±3.83 F 6.22±0.27**46.94±2.80** G 6.38±0.19**50.03±2.68** H 8.49±0.19**63.19±3.14**
由表3可知,比较A组与B组的白细胞数,B组比A组明显低了3.13×109个/L,差异极显著(P<0.01),说明小鼠免疫力低下。比较C、D、E、F、G组和H组与B组的白细胞数,各处理组均比B组有所提高,其中E组增加最少,仅增加了0.18×109个/L,差异不显著;C组略有增加,增加了0.26×109个/L,差异较显著(P<0.05);D、F、G、H组增加较多,差异极显著(P<0.01)。实验表明,D、F、G组和H组白细胞数都明显得到提高,其中以D组和H组最为明显,D组与A组水平接近,H组超过A组水平,比B组增加3.65×109个/L。说明D组和H组都可以提高小鼠白细胞数。
经显微镜观察T淋巴细胞在胞浆内有明显的紫红色圆点(有时融合成片状的产物)一般为1~2个,有的2~4个紫红色颗粒,此为酯酶染色阳性(即ANAE阳性)。由表3可知,与B组相比,A组T淋巴细胞阳性率比B组高,且差异极显著(P<0.01),说明小鼠免疫低下。与B组相比较,各处理组T淋巴细胞阳性率均有所提高,其中C组与E组小鼠T淋巴细胞阳性率增加较少,E组与B组相比较,差异不显著;C组与B组相比较,增加较明显,差异较显著(P<0.05);D、F、G组和H组与B组相比较,T淋巴细胞阳性率增加明显,差异极显著(P<0.01),其中H组T淋巴细胞阳性率最高,超过A组水平。结果表明,D、F、G、H组的小鼠T淋巴细胞阳性率都得到提高,尤其H组的效果最为明显。
3 讨 论
免疫抑制是由于免疫系统受到损害,导致机体对抗原的应答能力下降的一种免疫异常状态。环磷酰胺是一种细胞毒性药物,它能够杀死有丝分裂和进入循环周期的细胞,具有较强的免疫抑制作用,在免疫学研究中常以环磷酰胺作为免疫抑制模型的制备药物[15-16]。本实验通过对小鼠饲养期间对饲料利用的分析,免疫功能低下的模型组在饲养20d后对饲料的利用率越来越低,F/G越来越高,是其他实验组的1.42~3.59倍,说明环磷酰胺构建小鼠免疫低下模型成功。
免疫器官组织由淋巴组织组成,它是免疫细胞发生、分化、成熟的场所,也是免疫反应发生的地点,脾脏、胸腺是小鼠的免疫器官,观察其质量的改变可以直观地反映小鼠免疫功能的变化[24]。环磷酰胺属于细胞周期非特异性化疗药,对增殖周期中各期细胞均有灭杀作用[25-26],由于机体大部分白细胞寿命较短,环磷酰胺的灭杀作用首先通过白细胞反映出来[17]。通过白细胞计数和计算T淋巴细胞阳性率可以大致反映小鼠的免疫功能状态[18-19]。本实验比较了各实验组的肝脏、肾脏、脾脏和胸腺指数,与模型组相比均有差异,其中富硒G3菌高剂量组、牛初乳高剂量组和富硒牛初乳高剂量组,差异极显著(P<0.01)。对小鼠白细胞数和T淋巴细胞阳性率的影响,除牛初乳低剂量组不明显外,其余各组都十分明显,其中富硒牛初乳高剂量组与模型组相比,小鼠白细胞数提高了175%、T淋巴细胞阳性率提高了158%。说明适当的剂量有改善免疫低下的作用。
SOD和GSH-Px是清除自由基的关键抗氧化酶,能够保护细胞免受损伤,维护细胞膜结构完整性,增强机体的免疫功能。实验表明,注射了环磷酰胺的免疫低下模型组与对照组相比,SOD和GSH-Px活性明显较低,这与吴军等[27]和曹志玲[28]报道的环磷酰胺可导致机体抗氧化能力降低的结果一致。注射环磷酰胺导致机体抗氧化能力下降,自由基产生过多,造成组织细胞膜毒性反应,影响正常组织形态和功能的完整性,抑制淋巴细胞增生分化,抑制其对刺激原的反应性及细胞的功能[29]。实验各组小鼠的血清SOD酶活性和全血GSH-Px酶活性除低牛初乳低剂量组外都有明显的提高,尤其富硒牛初乳高剂量组小鼠体内的S O D酶活性提高了47.77%,GSH-Px酶活性提高了23.59%,说明经复配的富硒牛初乳对清除体内的自由基,保护机体细胞免受损伤,改善免疫功能的作用优于单一牛初乳或有机硒的作用。
郭峰等[30]研究表明,在饲粮中添加酵母硒或无机硒
可提高生长前期肉鸡的日增体质量,降低F/G,其中同水平的酵母硒增加量大于无机硒。添加酵母硒对生长后期肉鸡体质量增加仍具有明显提高作用,对F/G有明显降低作用;而添加无机硒虽有提高体质量的效果,但对F/G无显著影响。张乙山等[31]研究表明,与不加硒空白对照组相比,在基础日粮中添加0.3、0.5、0.8mg/kg 亚硒酸钠分别使F/G降低了6.82%、6.23%和8.61%;添加0.3、0.8mg/kg 酵母硒分别使F/G降低了5.93%和17.21%;添加0.3、0.5mg/kg 纳米硒分别使F/G降低了8.31%和9.20%,酵母硒和纳米硒的添加量能较大幅度降低F/G。万善霞等[32]研究表明,饲喂仔猪牛初乳IgG能提高仔猪的生产性能。Bird等[33]报道,初乳中的表皮生长因子具有改善酸分泌、调节黏膜刷状缘消化酶的活性、改善机体的消化吸收能力、促进机体生长的功能。比较本实验各处理组F/G,均比免疫低下模型组低,说明免疫低下模型组饲料利用率不高,这与上述文献报道的结果一致。
实验结果表明,富硒G3菌、牛初乳、富硒牛初乳均能提高免疫低下小鼠对饲料的利用率,能提高免疫低下小鼠SOD、GSH-Px活性、白细胞数和T淋巴细胞阳性率,其中牛初乳高剂量组和富硒牛初乳高剂量组的效果最为明显;比较牛初乳高剂量组和富硒牛初乳高剂量组的效果,富硒牛初乳高剂量组更为明显,说明富硒牛初乳能显著增强小鼠的免疫功能,但有机硒与牛初乳如何进行复配以及作用机理有待进一步研究。
[1]赵明, 刘宁. 免疫调节功能性食品: 牛初乳[J]. 中国食物与营养, 2006 (5): 55-57.
[2]陈志伟, 马燕芬, 侯先志. 牛初乳的研究进展[J]. 综述与专论, 2005 (6): 43-46.
[3]宋宏新, 梁萍. 牛初乳的营养保健与产品质量控制[J]. 中国乳品工业, 2006, 34(3): 32-62.
[4]史国富. 光合细菌在医药保健品方面的应用进展[J]. 科技情报开发与经济, 2003, 13(7): 99-100.
[5]关玉群, 朱磊, 王充, 等. 硒与人体健康[J]. 现代预防医学, 2003, 30 (5): 700-703.
[6]王能才, 王双双. 硒微量元素临床研究进展[J]. 医学文选, 2004, 23 (1): 78-80.
[7]张靖, 方卫斌, 熊正英. 硒缺乏对运动能力的影响[J]. 四川体育科学, 2004(1): 26-29.
[8]王栋钢, 雷培芸, 杨咏梅, 等. 硒对儿童桥本甲状腺炎的影响[J]. 广东微量元素科学, 2004, 11(2): 34-36.
[9]吴蕴棠, 孙忠, 车素萍, 等. 锌、硒对糖尿病大鼠糖、脂代谢紊乱的调节及其分子机制的研究[J]. 卫生研究, 2004, 33(1): 70-74.
[10]吴万征, 吴忠. 微量元素硒与人体健康[J]. 广东微量元素科学, 2000, 7(11): 7-11.
[11]JAGIELO P J, QUINN T J, QURESHI N. Grain dust-induced lung inflammation is reduced by Rhodobacter spaeroides diphosphoryl lipid A[J]. Am J Physiol, 1998, 274: 26-31.
[12]吴向华, 杨启银, 刘五星. 沼泽红假单胞菌营养成分与评价[J]. 江苏农业科学, 2005(1): 86-88.
[13]方立超, 王斌, 张锦亮, 等. 沼泽红假单胞菌2C 菌株的安全性评价[J]. 氨基酸和生物资源, 2005, 27(2): 52-54.
[14]中华人民共和国卫生部医政司. 全国临床检验操作规程[M]. 3版. 南京: 东南大学出版社, 2006: 132-133.
[15]李业鹏, 计融, 韩春卉, 等. 建立小鼠免疫抑制低下模型的初步研究[J]. 中国食品卫生杂志, 2001, 13(6): 7-10.
[16]朱晓彤, 江艳青, 王丙云, 等. 环磷酰胺诱导黄羽肉鸡免疫抑制的研究[J]. 华南农业大学学报: 自然科学版, 2003, 24(4): 60-63.
[17]赵喜新, 阎杜海, 王和平, 等. 环磷酰胺引致的小鼠白细胞减少模型及动力学分析[J]. 上海实验动物科学, 1998, 18(1): 12-14.
[18]吴克枫, 冯燕梅, 俞红, 等. 不同剂量环磷酰胺对小鼠的免疫毒性研究[J]. 贵州医药, 1994, 23(2): 91-92.
[19]徐海帆, 李汉贤. 免疫抑制小鼠不同时间环磷酰胺的血药浓度与免疫功能[J]. 南华大学学报: 医学版, 2001, 29(6): 562-564.
[20]潘健存, 陈静, 李华, 等. 水牛初乳粉对免疫低下小鼠免疫功能的影响[J]. 中国乳品工业, 2007, 35(5): 16-18.
[21]林清华. 免疫学实验[M]. 武汉: 武汉大学出版社, 1999: 204-206.
[22]朱辛为, 李质馨, 窦肇华, 等. T淋巴细胞标记染色: ANAE法的改进[J]. 解剖学杂志, 2003, 26(3): 300-301.
[23]姜世勃, 陈泽洪. T淋巴细胞酯酶活性检测法的改进及其影响因素的探讨[J]. 第一军医大学学报, 1982, 2(4): 384-388.
[24]黄沁. 免疫药物学[M]. 上海: 上海科学技术出版社, 1986.
[25]王和平, 赵喜新, 田开宇.小鼠白细胞减少模型白细胞及骨髓粒系细胞的动态变化[J]. 郑州大学学报: 医学版, 2002, 37(1): 439-440.
[26]叶雨文, 卞如濂. 基础药理学[M]. 杭州: 浙江人民出版社, 1999.
[27]吴军, 赵凤鸣, 王明艳, 等. 四君子汤对环磷酰胺造模小鼠血清中SOD,GSH,CAT和MDA水平的影响[J]. 辽宁中医杂志, 2007, 34(8): 1168-1169.
[28]曹志玲. 环磷酰胺对雏鸡血液超氧化物酶(SOD)活性的影响[J]. 广东畜牧兽医科技, 2007, 32(5): 36-47.
[29]张连琴, 陈雪娴. 自由基与疾病[J]. 天津医科大学学报, 1997, 3(2): 85-88.
[30]郭峰, 李同树, 苗朝华, 等. 日粮硒源及添加水平对肉鸡生产性能、肉质和甲状腺激素的影响[J]. 动物营养学报, 2004, 16(3): 63-64.
[31]张乙山, 边连全, 游思亲. 三种硒源对生长肥育猪组织硒沉积及抗氧化能力的影响[J]. 饲料工业, 2008, 29(1): 18-20.
[32]万善霞, 滑静, 张淑萍. 牛初乳IgG对仔猪增重和血液指标的影响[J].动物科技, 2004, 21(6): 34-35.
[33]BIRD A R, CROOW J. Jejunal glucose absorption is enhanced by epidermal growth factor[J]. J Nutr, 1994, 124: 231-240.
Combined Effect of Bovine Colostrumson and Selenium-enriched Rhodopseudomonas palustris G3 on Immune Function in Mice
YANG Qi-yin1,2,3,WANG Jia-fang1,JIA Bing-sheng1,GUAN Hai-hua1,LIU Qing1
(1. College of Life Science, Nanjing Normal University, Nanjing 210046, China;2. Nanjing Engineering and Technology Research Center for Microbiology, Nanjing 210046, China;3. Jiangsu Engineering and Technology Research Center for Microbial Resources, Nanjing 210046, China)
In order to investigate the effect of selenium-enriched bovine colostrumson on immune function of immunodepressed mice induced by cyclophosphamide, selenium-enriched Rhodopseudomonas palustris G3 (hereinafter called selenium-enriched G3) was mixed with bovine colostrumson to prepare selenium-enriched bovine colostrumson. The immunodepressed mice were treated with selenium-enriched G3, bovine colostrumson and selenium-enriched bovine colostrumson, respectively. The administration was carried out once a day for 47 successive days after 3 days of adaptive feeding, and organ index, white blood cell number, T-cell population, the contents of SOD and GSH-Px in blood, and feed/gain ratio of mice were determined at the end of the administration. Results indicated that selenium-enriched G3, bovine colostrumson and selenium-enriched bovine colostrumson could increase the utilization efficiency of diet, enhance the activities of SOD and GSH-Px in blood, and improve mouse immune function. Compared with the control group, the selenium-enriched bovine colostrumson exhibited best improved immune at the high dosage.
selenium;bovine colostrumson;Rhodopseudomonas palustris;cyclophosphamide;immunization
TQ929.3
A
1002-6630(2010)21-0373-05
2010-06-24
江苏省科学技术厅高新技术项目(BG2005326)
杨启银(1951—),男,副教授,主要从事微生物应用和微生物制剂的研究。E-mail:yangqiyin@163.com
