肝动脉化疗栓塞序贯联合 CT导向下微波消融术治疗原发性肝癌的近期疗效观察
2010-03-21郑小令
郑小令,张 亮
(海南省农垦那大医院放射科,海南 儋州 571700)
原发性肝癌(Primary hepatocellular carcinoma,HCC)是我国常见的一种恶性肿瘤,手术切除仍是目前肝癌的首选方法。但各种非手术疗法的作用日益凸显,包括经皮无水酒精注射(PEI)、射频消融(RFA)、氩氦刀、微波消融 (Percutaneous microwave coagulation therapy,PMCT)等治疗,开辟了肝癌介入治疗的新途径。其中以 PMCT为代表的多种微创介入序贯联合经导管肝动脉栓塞化疗术(Transcatheter arterial chemo-embolization,TACE)治疗被认为是非常有前途的方法。我们将 TACE联合 PMCT应用于HCC治疗,取得了良好的临床效果,报道如下:
1 资料与方法
1.1 临床资料 2006年 6月至 2009年 12月住院原发性肝癌患者 68例。入选标准:原发性肝癌患者,单个肿瘤直径≤5 cm,总数不超过 3个,所有病例均经病理确诊或临床诊断(至少两种以上影像学检查确认)证实。所有入选病例中,肝脏外未见转移,门静脉内未见癌栓,且癌灶结节距重要组织器官、血管均大于 0.5 cm。所有病人均无 PMCT、TACE治疗的禁忌证。随机分为两组——联合组:经TACE治疗后 1-4周内行 CT引导下 PMCT治疗 48例 ,55个病灶,男 35例,女 13例 ;年龄 32-74岁 ,中位年龄(51.6±5.2)岁;其中 41例(85.4%)血清甲胎蛋白(AFP)(+);患者肝功能 Child-pugh分级 A级 45例,B级 3例。单纯接受 TACE(TACE组)20例,23个病灶 ,男 17例 ,女 3例;年龄 35-70岁,中位年龄(53.8±4.8)岁;其中 18例 (90.0%)AFP(+);患者肝功能 Child-pugh分级 A级 16例,B级4例。两组病例的性别、年龄和肝功能 Child-pugh分级差异均无统计学意义(P>0.05),具有可比性。
1.2 仪器设备 TACE治疗使用的数字减影血管造影机(Digital substraction angiography,DSA)为PHILIPS公司生产的平板数字 DSA机,CT扫描设备使用 Marconi CT-Twinflash。CT增强扫描注射器为电动式高压注射器。微波仪器:南京庆海微波电子研究所研发 MTC-3(C)型组织间肿瘤微波凝固治疗仪,微波发射频率 2 450 MHz,功率 5-100 W,时间 1-99 min连续可调,配置微波治疗针,长 10-20 cm,高强度,可直接用于经皮穿刺。蠕动泵:南京庆海微波电子研究所研发,作为水冷式微波天线中水循环的动力,常温袋装无菌生理盐水 500 ml作为冷却源,通过进出水管与水冷式天线构成闭合循环通路。
1.3 治疗方法:
1.3.1 TACE治疗组 患者在获得明确诊断后,术前评估无手术禁忌证,经皮股动脉穿刺插管,在 DSA引导下行腹腔动脉和肠系膜上动脉造影,必要时行膈动脉造影,明确肿瘤的供血动脉后,将导管超选择性插管至肿瘤的供血动脉,肝功能为 Child A级的患者先行 TACE治疗,常规用药为吡喃阿霉素(Pirarubicin,THP-ADM)40-60 mg、碘化油 10-20 ml的混合乳化物选择性经肝动脉灌注化疗栓塞,后经导管灌注卡铂(Carboplatin,CBP)300 mg。注药完毕后,再行 DSA造影。术后给予止血、抗炎、护肝等常规对症支持治疗。肝功能为 Child B级的患者先行护肝治疗,待肝功能恢复后行 TACE治疗。每隔 3-4周重复治疗一次,共行三次治疗。
1.3.2 PMCT治疗组 对照组与治疗组 TACE治疗方案相同,待首次 TACE治疗后 1-4周行肝脏CT增强扫描,了解肿瘤内碘化油沉积情况及肿瘤是否完全坏死,有肿瘤组织残留时对肿瘤残留部分进行 PMCT治疗。治疗过程:由 CT引导下经皮微波消融,在局麻 +静脉麻下实施治疗,术前根据病灶位置,患者取仰卧位或俯卧位,CT扫描确定病灶部位、数目、大小等,选择穿刺点及进针方向。在进针部位用金属网格线做好定位标记,常规消毒铺巾,在穿刺点及进针路径采用 2%利多卡因进行局部浸润麻醉,进针时尽量避开邻近重要器官,如肝门区血管、门静脉主干及左右支、胆囊等。在 CT导向下进针将微波消融针头位于肿瘤远侧端(相对于皮肤),微波穿刺针达到预定位置后,给予静脉麻醉,消融功率50 W,消融时间约 5-10 min,可酌情行多位点叠加治疗,使消融范围超过病变区延伸至正常组织 0.5 cm以上,确保肿瘤组织充分坏死。如残留的肿瘤较大,则采用多点、多针同时或分次治疗。术中给予心电监护,实时监测患者生命体征,术后行 CT扫描观察有无气胸、腹腔出血等并发症及消融范围情况,术后3 d给予止血、预防感染、护肝等常规对症支持治疗。在随访过程中,如发现消融不完全,于肝功能基本恢复后再次予以PMCT。术前及术后定期复查血常规、生化常规、凝血四项和肿瘤相关抗原(AFP)。
1.4 近期疗效观察 疗效评价根据 CT平扫和增强检查,以病变范围是否缩小或病变是否有强化及强化范围的大小作为疗效评判标准。如病变区无强化,且 DSA造影无肿瘤染色,则为完全坏死;如发现病变部位仍有强化,在排除异常灌注和肿瘤消融治疗后的周围炎症反应后,根据强化范围确定:肿瘤范围在 90%-95%之间为不完全坏死;范围在 50%-89%之间为部分坏死。
1.5 随访 完成 3个疗程后,每 1个月行 CT或 MRI增强以及 DSA检查,并行常规血生化和 AFP检查,追踪随访患者肿瘤局部控制情况、术中及术后并发症,若病情稳定,每 3个月复查一次,评价患者近期平均生存期。
2 结 果
2.1 肝肿瘤坏死率 所有病例均行 TACE治疗,其中 TACE组:16例 2次,4例 3次;TACE+PMCT组 :27例 TACE 1次 ,16例 2次,5例 3次;30例行 PMCT 1次 ,18例 2次 。经 CT、MRI或 PET/CT检查作为评价依据,证实肿瘤坏死情况(见表 1),两组间肿瘤完全坏死率差异有统计学意义(P<0.05)。
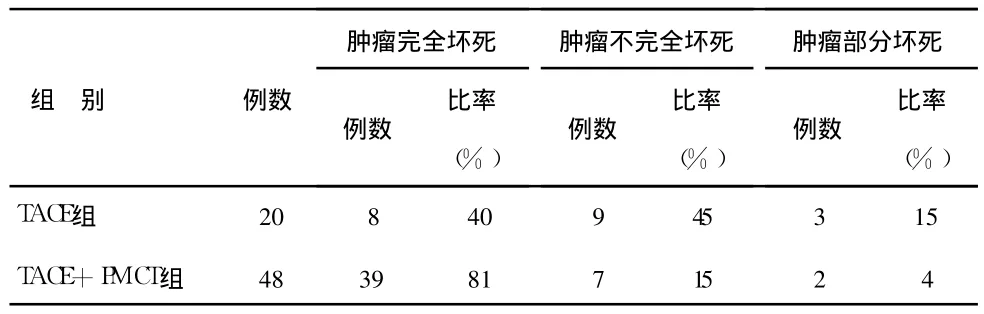
表1 两组肿瘤坏死程度比较
2.2 肿瘤相关抗原(AFP)测定 所有患者术前 1-3 d,术后第 1、3个月分别行肿瘤相关抗原测定,术前 AFP值由 16.5 ng/ml至大于 21 174 ng/ml不等,术后均有不同程度下降(P<0.05)。
2.3 1年半生存率 TACE组治疗后 1年半的生存率为 75.0%(15/20),而联合治疗组的 1年半生存率为 97.9%(47/48)。
2.4 并发症 TACE治疗后出现栓塞后综合征:疼痛、发热、恶心、呕吐等,经对症处理均能缓解。TACE联合 PMCT治疗后并发症:术后均有轻到中度肝区疼痛及发热,体温在 37.1℃-39.4℃,32例术后均有血清转氨酶升高,经保肝及对症处理后于 1-2周内恢复正常或降至术前水平;未发生肝包膜下出血、气胸及肝破裂等严重并发症。
3 讨 论
目前,在肝癌的非手术治疗中,TACE是首选的治疗方法。由于 HCC瘤内 90.0%的血供来自肝动脉,癌周 10.0%来自门静脉,故 TACE后瘤内中心区的癌细胞血供明显受限,出现缺血性坏死,但对癌周影响不大;随着癌灶体积的增大,大于 5 cm的肝癌病灶几乎完全由双重供血,癌灶中心部分主要由肝动脉系统供血,周边生长活跃部分由门静脉系统供血。TACE可使几乎全部的肉眼可见的肿瘤血管闭塞,血管内皮细胞坏死将刺激机体的血管内皮生长因子(VECF)等促肿瘤血管生长因子的表达上调,导致残癌组织中的血管新生加速。因此,单纯行 TACE治疗尽管可致大部分癌细胞坏死,但仍常残留活癌灶,极易复发。小肝癌患者行肝段 TACE治疗的临床疗效与手术切除接近[1]。但应指出,缺乏血供的肿瘤类型 TACE疗效差[2],大肝癌反复多次的 TACE治疗加重正常肝组织的损害[3];肿瘤血供的变化致再次的 TACE治疗难度增大,以上原因使 TACE治疗后肝癌组织常坏死不彻底,出现较高的复发(残留)或转移,影响总体疗效。
1994年 Seki等首次报道采用 PMCT治疗小肝癌以来,PMCT治疗肝癌引起国内外学者的关注,目前成为肝癌综合治疗的重要方法之一。它主要是利用微波的热效应和肿瘤不耐热的特点,在极短的时间内在肿瘤局部产生 60℃-107℃高温,肿瘤细胞致死温度临界点在 42.5℃-43℃,这种热能仅限于被加热的组织局部,使被加热的肿瘤组织迅速凝固坏死,达到原位灭活肿瘤局部根治的目的[4]。微波固化可引起机体局部组织理化性质的变化,可以提高机体的免疫功能[5]。有学者报道对直径 3-5 cm肿瘤结节灭活率可达到 73%和 57%。
结合文献及本组病例结果分析,我们认为 TACE序贯联合 PMCT治疗肝癌的优点有:1)肝动脉栓塞后肝癌的供血动脉阻塞,封闭肿瘤血管床,血供显著减少,清除了动脉血流的冷却效应,同时栓塞剂还可以通过动脉 -门静脉交通支到达肿瘤周边的门静脉,暂时性地减少了肿瘤周边门静脉血流,这样也减少了门静脉所致的血流吸热效应。2)TACE引起的缺血和炎症反应而导致癌组织及周边组织水肿,PH值下降,有利于热的产生和专递,为 PMCT治疗时能量聚集,增加热的敏感性,扩大凝固范围,最大限度地原位杀灭肿瘤组织提供良好的治疗基础条件。3)除栓塞作用外,碘油可作为化疗药物的载体,起到缓释作用,延长化疗药的半衰期。温热可增加癌细胞对化疗药的敏感性,减缓对化疗药所致癌细胞损伤的修复。4)肝动脉造影仍然是诊断肝癌的确切的方法,栓塞前 DSA造影可以发现超声、CT/MR未能检查出的更小的复发或肝内转移病灶。同时 TACE使较大的病灶缩小,有利于 PMCT治疗,对 PMCT未处理的病灶起到控制作用[6]。5)冷循环 PMCT的应用使传统单点凝固范围由 1.6 cm×2.4 cm达到 4.7 cm×5.2 cm,可以较大幅度的降低肿瘤负荷,减少TACE治疗的次数,从而降低多次反复 TACE对正常肝组织的损害影响等副作用,所以两者有很强的互补性。6)碘油栓塞后起到追踪的作用,为 CT引导穿刺定位提供参考。
对于中晚期肝癌患者,据文献报道,TACE后 1年半生存率仅达 28.5%-78%,本组病例 TACE组1年半生存率仅达 75.0%,而联合治疗组 1年半生存率达到 97.9%;因此对于原发性肝癌不能手术的患者,采用 TACE联合 PMCT治疗,明显优于单纯TACE治疗,可明显提高患者的生存质量和生存率。
本组研究采用 CT引导定位 PMCT,其优点在于较常规应用较多的超声定位提高了定位的准确率,从而增加治疗的安全性[7]:1)根据 CT片可较为方便的设计 PMCT方案;2)受气体、骨骼、碘油和胃肠的影响小,良好显示 TACE后残留病灶的位置及大小,而且 TACE后病灶的碘油起到示踪定位作用;3)CT分辨率高,有利于特殊部位病变的定位穿刺,可以准确显示针尖的位置及其与周围重要器官的关系;4)较容易发现治疗过程中发生的并发症以便及时处理。出血是消融治疗中并不常见的并发症,因为消融的热效应及术后的针道电凝具有止血作用,本组患者在消融术中及术后未出现肝包膜下出血。对于穿刺路径经过胸腔的患者,气胸也是并发症之一[8],如不能避免,也应尽量减少穿刺次数,以减少气胸的发生概率。
综上所述,我们认为 TACE序贯联合 PMCT治疗可弥补单纯 TACE对缺乏血供的肿瘤类型 TACE疗效差;大肝癌反复多次的 TACE治疗加重正常肝组织的损害;肿瘤血供的变化致再次的 TACE治疗难度增大等的缺陷,治疗上可起到互补作用,使肿瘤完全坏死率及近期生存率均明显提高,是治疗 HCC的安全、微创、有效的综合治疗方法,联合治疗疗效明显优于单纯 TACE治疗。
[1] 杨 远,周伟平.小肝癌临床治疗新观念[J].肝胆胰外科杂志,2005,17(2)∶163-165.
[2] 韦传军,李彦豪,陈 勇,等.肝动脉化疗栓塞术后联合射频热凝治疗大肝癌[J].介入放射学,2005,14(3)∶246-248.
[3] 孔 健,窦永充,许林锋,等.肝动脉化疗栓塞治疗原发性肝癌后肝纤维化指标的改变[J].中华肝胆外科杂志,2002,8(7)∶414-416.
[4] 王精兵,梁惠民,冯敢生.经皮微波凝固治疗肝肿瘤[J].放射学实践,2001,16(4)∶214-217.
[5] 张 晶,董宝纬,梁 萍,等.原发性肝癌经皮微波凝固治疗前后局部免疫活性细胞功能检测[J].中华医学杂志,2001,81(16)∶974-977.
[6] 单人锋,彭贵主,周福庆,等.经皮穿刺微波凝固联合 TACE治疗肝癌[J].实用临床医学,2009,10(2)∶35-37.
[7] 许林锋,陈耀庭,任 强,等.TACE联合冷循环 PMCT治疗原发性肝癌的临床应用[J].中国肿瘤临床,2007,34(10)∶555-556.
[8] 王立刚,张 亮,范卫君,等.TACE联合PMCT治疗原发性肝癌的临床疗效观察[J].广州医药,2009,40(1)∶8-11.
