大鼠局灶性脑缺血再灌注模型的复制及评价
2010-03-21徐秋英刘亚敏沈强曾征伦夏鑫华
徐秋英,刘亚敏*,沈强,曾征伦,夏鑫华
(1.广州中医药大学第一附属医院,广东广州510405;2.广州医学院,广东广州510182)
脑血管疾病是危害人类生命和健康的常见病和多发病,其中缺血性脑卒中(AIS)占有相当大的比例(75%~85%)[1]。大脑中动脉及其分支的梗死(简称MCAO)是人类脑梗死常见的发病形式之一[2]。为了解缺血性脑卒中的演变过程和药物疗效观察,脑缺血动物模型已成为研究脑血管病损伤机理和防治措施不可缺少的工具,因而制作最接近人类缺血性脑卒中的理想动物模型一直是人们普遍关注的课题。近年来多数学者倾向于选用大鼠复制脑缺血模型,为了能够最大限度地保证建立生理指标控制严格、重复性好的整体动物模型。国际脑血管病委员会对局灶性脑缺血模型的手术和设计均提出明确要求。近20年来发展创立了许多新方法,运用最广泛的是线栓法。我们在完成课题研究过程中,选用改良的线栓法进行了SD大鼠局灶性脑缺血/再灌注模型(以下简称为MCAO模型)的复制,逐渐摸索出一套操作简便、稳定性好、成功率高的模型复制方法,现介绍如下。
1 实验材料
1.1 实验动物及分组 SPF级SD大鼠,雌雄兼用,体重260~300 g,广东省医学实验动物中心提供。合格证号:SCXY(粤)2003-0001。随机分为两组,a:改良前模型组20只,b:改良后模型组20只。清洁动物房饲养,恒温恒湿[温度(24±2)℃,湿度60%左右], SPF级大鼠饲料喂养,自由进水(消毒蒸馏水)。
1.2 实验试剂 水合氯醛(上海五联化工厂),分析纯,用生理盐水配成10%浓度;多聚赖氨酸(Poly-LLysine,武汉博士德生物有限公司提供),使用前将原液浓度用蒸馏水稀释至0.1%;肝素(山东齐鲁制药有限公司),使用前配成100 U/mL浓度。
1.3 实验仪器 双极射频电凝器:SDQ-30,上海手术器械厂;数码相机:V3,日本SONY公司产;电热恒温水浴箱:ZD-420,杭州蓝天仪器;投射式电镜:JEM-1200EX型,日本产;超薄切片机:AO,奥地利产;大鼠脑垫:美国ZivicMiller公司生产;动脉夹:宁波医用缝针厂;丝线:0号手术缝合线;进口尼龙线:直径0.26 mm,长4 cm,在前段2 cm用黑色油性笔标记,使用细砂纸打磨使头端光滑、钝圆、前段 2 cm浸入0.1%Poly-L-Lysine,5 min自然晾干,临用前在头端醮取肝素。无齿眼科镊、手术剪、止血钳、线剪、1 mL注射器等均为国产。
2 实验方法
2.1 模型制备方法 参照Longa等[3]的线栓法复制大鼠MCAO模型。术前禁食12 h,自由饮水。手术前按0.35 mL/100 g为大鼠腹腔注射10%水合氯醛麻醉,保留自主呼吸,仰卧位固定,术中体温由肛温计监测,并用白炽灯加热维持肛温在36.5~37℃。取大鼠腹侧颈部正中作为手术切口,沿胸锁乳突机内缘肌肉、筋膜,分离右侧颈总动脉、颈外动脉、颈内动脉和翼腭动脉,分离过程中电凝血管小分支及交通支以防出血。结扎右侧翼腭动脉,在距右颈总动脉分叉约1 cm处结扎右颈外动脉,于远心端用电凝笔将其灼断。动脉夹夹闭右颈总动脉、颈内动脉,在右颈外动脉距结扎处近心端约0.5 cm处用4号皮内注射针头小心刺一小孔,牵拉右颈外动脉残端,使其与右颈内动脉成一直线,将尼龙线栓经小孔缓慢向颈内动脉入颅方向推进并松开右颈内动脉处动脉夹。以颈总动脉分叉处为标记,推进18~20 mm感到轻微阻力时,即已阻断大脑中动脉血流。阻断2 h后,拨出尼龙线,扎紧动脉残端,缝合皮下组织和皮肤,完成缺血再灌注损伤模型。假手术组除不插线外,全过程同模型组。分别于缺血3,24,48 h对大鼠进行神经功能评分。
2.2 模型评价方法
2.2.1 行为学变化及神经功能缺损评分 大鼠脑缺血2h麻醉清醒后,表现为不同程度的局灶性神经功能障碍。如耸毛,左上肢屈曲内收,提尾时左前肢内收,向前爬行时向左侧转圈(追尾征)或向左侧倾倒,侧推抵抗力下降,蜷卧少动等;再灌注4~6 h后局灶性神经功能障碍症状如左上肢屈曲内收,及提尾向前爬行时向左侧转圈或向左侧倾倒等基本消失,双侧抗侧推抵抗力基本相同,仅表现为耸毛,蜷卧少动。按TiboGerriets等的评分标准并作少量修改,主要通过观察动物的行为变化进行评分。0分:无神经功能缺失;1分:不能完全伸直左前肢;2分:行走时断续向左侧转圈;3分:向左侧持续转圈;4分:向左侧倾倒;5分:不能自动行走和意识水平下降。
2.2.2 脑梗死体积测定(TTC染色) 大鼠脑缺血2 h再灌注24 h后,麻醉后断头处死,迅速取出大鼠大脑,生理盐水冲洗残血,将大脑置0℃生理盐水中15 min,再取出置于大鼠脑垫中,从额极间隔2 mm连续做6个脑组织冠状切片,迅速放入2%TTC溶液中(TTC水溶液是一种无色溶液,是呼吸链中吡啶-核苷结构酶系统的质子受体,是脂溶性光敏感的复合物,与正常组织中的脱氢酶反应呈红色,缺血组织内脱氢酶活性下降,不能反应,故不会产生变化呈苍白色)。TTC染色用于测定梗死灶大小具有快速、直观地确定梗塞范围的优点,且境界清楚。37℃水浴箱恒温孵育30 min后置10%甲醛中固定24 h,数码相机用微距按切片顺序排列拍取照片,输入电脑,用真彩病理图像分析软件(技易科技)测量梗死灶面积,玫瑰红色区为正常脑组织,苍白色区为梗死区,各脑片梗死面积之和乘以厚度(2 mm)为总的梗死体积。以梗死灶体积占全脑体积的百分率进行统计分析。
2.3.3 组织形态观察 再灌注24 h后开颅取脑肉眼观察,颅底有否出血,正常组脑组织颜色形态均正常,无苍白及肿胀。脑缺血2 h再灌注24 h后缺血侧大脑组织肿胀明显,颜色变浅,软脑膜血管有出血。取脑组织皮质作常规脱水,石蜡包埋切片,厚度为5 μ m, HE染色后,光镜下观察神经细胞组织形态学变化。光镜下观察,正常组脑神经细胞结构完整,细胞核较大,核仁清楚,细胞及间质无水肿;脑缺血2 h再灌注24 h组脑神经细胞多数神经细胞核固缩,核仁显示不清,细胞外空隙明显增宽,间质疏松,显示细胞周围及间质水肿。
2.2.4 模型纳入和舍去标准 造模过程中,神经功能评分必须达到2~4分者,方可纳入研究。如出现以下情况,模型应舍去:(1)栓线插入深度不足18 mm,且无明显神经功能缺损表现或症状很轻;(2)蛛网膜下腔出血、大脑中动脉起始部或其附近的willis环动脉有凝血块的大鼠,因为这是出血性脑损伤或永久性脑缺血损伤,而非脑缺血再灌注损伤;(3)手术时出血较多,症状很重或术后意识不清。
3 结果
改良前后大鼠MCAO模型各种率的比较,见表1。
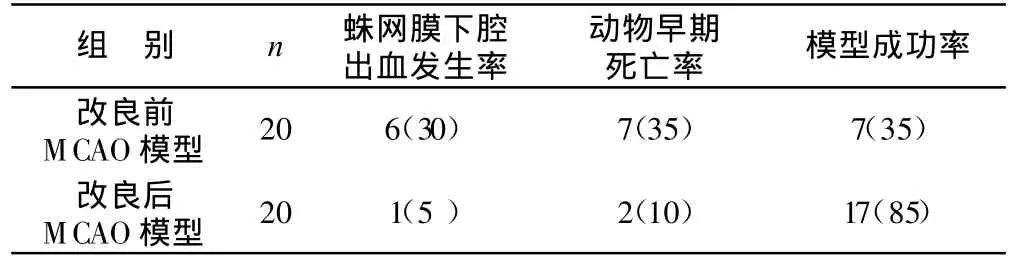
表1 改良前后大鼠MCAO模型各种率的比较 例(%)
从表1可以看出,改良前后制作的MCAO模型,改良前蛛网膜下腔出血发生率30%、动物早期死亡率35%、模型复制的成功率35%;而改良后蛛网膜下腔出血发生率下降至5%(χ2=4.33,P<0.05),动物早期死亡率下降至10%(χ2=3.58,P<0.10),模型复制的成功率则上升到85%(χ2=10.42,P<0.01)。
4 讨论
关于MCAO模型的复制近年来多数学者倾向于选用SD大鼠,原因是:(1)大鼠脑血管解剖特点比较接近人类[4];(2)有关大鼠生理、生化、形态及药理等方面的实验资料比较丰富,有利于进行研究和比较; (3)价格低廉,可进行较大量重复实验;(4)纯种鼠属近亲交配,品种相对一致,脑血管解剖和生理机能变异较小,故实验中损伤部位恒定,实验重复性好;(5)大脑体积小,有利于进行固定染色及病理组织学观察。国际脑血管病委员会对MCAO模型的手术设计也有明确的要求:(1)单支血管可被重复阻滞,该血管阻塞引起的改变可从血流变化等方面观察到;(2)实验对脑实质造成的病变应与人的接近,血管阻塞后该血管能再通,以恢复60%对缺血区的再灌注;(3)尽量减少对脑的手术性损伤,避免颅内组织暴露于大气中,避免颅内环境稳定性遭到破坏;(4)巴比妥盐在血管阻塞期间避免使用,以利于神经障碍的观察。对复制脑缺血模型手术方法,近20年来发展创立了许多新方法,包括开颅电凝阻断法、开颅结扎法、化学刺激诱导血栓性闭塞法、夹闭法、光化学诱导血栓形成阻断法、线栓法、颅外动脉注入微栓子、内皮素(ET)灌注诱导血管收缩法的栓塞法等,但运用最广泛的是线栓法。线栓法制成的局灶性脑缺血模型无须开颅,属相对非侵入性方法,避免了开颅术所带来的弊端,另外它可以轻易地实现缺血后再灌注,准确地控制缺血/再灌注时间,适用于神经元对缺血敏感性、耐受性以及再灌注损伤和治疗时间窗的研究,故目前应用最为广泛。当然,线栓法也存在一些缺点,如:(1)需要一定的手术技巧,制作流程相对复杂;(2)稳定性欠佳,不同实验室应用该方法制备的模型在成功率、梗死体积、蛛网膜下腔出血发生率、动物早期死亡率等方面不尽相同;(3)动物品系及体重要求严格;(4)插入的尼龙线可能干扰到下丘脑体温调节中枢的血液循环,造成缺血后体温升高的并发症,对缺血结果有影响; (5)线栓造模过程是非直视下的手术,血流是否完全阻断不能即刻得知。
本研究在总结前人经验的基础上,动物品系选用的是纯种近亲交配的SD大鼠,手术方法则选择目前运用最为广泛的线栓法。通过改良法制作MCAO模型,使制备模型的成功率从开始30%提高到80%,手术时间也从开始的需两人合作1 h才能完成到后来单人操作只需15 min便能完成。笔者经验,(1)首先要严格控制大鼠的体重及品系,以尽量保持脑缺血的恒定性;(2)线栓的处理是造模成败的关键。这里作特别的介绍,开始参考教科书介绍的方法,选用直径0.26 mm的单股尼龙线,将头端加热使其直径增大至0.3~0.5 mm的圆球形,理论上头端增大似乎可增加栓塞的成功率,但实际操作时尼龙线头端受热后变异性大,圆球形并不完全整齐和光滑,线栓插入时很容易卡在翼腭动脉或颅底,导致插管不成功,后取消线栓加热直接插管,又出现新的问题,插管时尖锐的线栓头容易刺破颅内血管造成蛛网膜下腔出血,导致动物模型症状过重甚至昏迷,无法进行神经功能评分,动物基本上存活不到实验设计所需的再灌注时间已经死亡。后来尝试将线栓头端用细砂纸打磨光滑,线栓在插入前前段涂以多聚赖氨酸(Poly-L-lysine)以增加缺血的稳定性,插入线栓时头端蘸取肝素预防线栓部位形成血栓。通过改进线栓头,插管成功率大大提高,大鼠缺血侧大脑经TTC染色证实制作的大鼠缺血模型是成功的,证明线栓头端不加热成圆球形也可以完全栓住目的动脉,而动物死亡率则大幅降低,最终确定选用此法;(3)严格掌握线栓插入的深度和力度:一般是以颈总动脉分叉处为标记,推进18~20 mm感到轻微阻力时,即已阻断大脑中动脉血流。具体操作时要特别注意,线栓插入过浅,前端未到大脑中动脉分叉处,插入过深则阻塞的是大脑后动脉,均不能达到阻塞大脑中动脉的目的;操作力度过轻线栓插不进,过重则容易造成血管内皮的损伤或刺破血管引起脑出血,导致造模失败;(4)拔出线栓动作轻柔并固定好线栓:应拔出线栓进行再灌注时,左手持手术镊固定线栓结扎部位,右手轻轻的将线栓拔出,动作一定要轻柔,防止拉断血管而无法再灌注或大出血导致动物死亡;(5)白炽灯加热维持肛温:手术虽然保持在22~26℃的环境中进行,但因水合氯醛麻醉后可致大鼠体温下降,影响脑缺血的稳定性,所以手术操作时仍在手术区域加用白炽灯加热以维持大鼠的肛温。通过不断的摸索和改进,笔者使用的大鼠局灶性脑缺血再灌注动物改良模型应用于局灶性脑缺血的研究,通过早期行为学、TTC染色及组织学观察,获得了较为满意的效果,可为研究缺血性脑卒中的演变过程和药物疗效观察提供保障,是研究脑梗塞较为理想的方法之一。
[1]李昌植,葛林宝.超早期电针干预对脑缺血再灌注模型大鼠智能作用的研究[J].吉林中医药,2005,25(2):46-47.
[2]王赞,姜宏宇,孟红梅,等.Rosuvastatin在小鼠大脑中动脉梗死模型中脑保护机制的探讨[J].中国老年学杂志,2006, 26(11):1534-1535.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusionwithout craniectomy in rats[J].Stroke,1989, 20:84-91.
[4]张成英,苗华,田鹤村,等.大鼠椎-基底动脉的解剖学观察及其在脑缺血模型中的应用[J].中国临床解剖学杂志, 1995,139(1):53-55.
