豆粕中胰蛋白酶抑制剂间接竞争酶联免疫吸附检测方法的研究
2010-03-09邢春芳葛向阳
邢春芳 葛向阳
胰蛋白酶抑制剂是豆粕中重要的抗营养因子之一。主要包括两大类:Kunitz类和Bowman-Birk类,它们在理化性质上存在一定的差异,但是两类胰蛋白酶抑制剂都可以和动物体内的胰蛋白酶、胰凝乳蛋白酶结合,抑制其活性,最终导致消化不良,阻碍动物的生长发育。
目前胰蛋白酶抑制剂检测方法很多:脲酶检测法、氢氧化钾检测法、酶化学方法、免疫学方法等,其中脲酶检测法和氢氧化钾检测法都是间接的检测胰蛋白酶抑制剂的含量。最经典的检测方法是Kakade酶化学方法,此方法是用反应中被抑制的胰蛋白酶的活性反映胰蛋白酶抑制剂的含量。该方法简单易操作,但灵敏度低,结果变异性较大,而且在检测发酵豆粕时,反应过程中易形成白色絮状物,使后续的比色过程无法进行,检测不能完成。为了解决这一问题,本文建立了间接竞争ELISA检测方法。
1 材料与方法
1.1 材料和试剂
主要仪器:96孔酶标板(JET,加拿大制造);酶标仪(BIO-TEK,美国制造);水浴锅(富华,中国制造)。
主要试剂:大豆胰蛋白酶抑制剂标准品(sigma,美国);抗胰蛋白酶抑制剂抗体(自己制备),HRP-羊抗兔 IgG(BOSTER,中国);包被液:0.05 M pH 值 9.6碳酸盐缓冲液,4℃保存;洗涤缓冲液:0.15 M pH值7.40磷酸盐缓冲液,4℃保存;封闭液:1%BSA,现用现配;底物缓冲液:pH值5.0磷酸柠檬酸缓冲液;底物:临用前配制,1 ml TMB(10 mg TMB/5 ml无水乙醇),15 ml底物缓冲液,64 μl 30%双氧水;终止液:2 M硫酸。
1.2 间接ELISA基本程序
按照岳磊等(2008)介绍的方法进行ELISA操作,测定OD450nm值,每个步骤之间均用洗涤液洗涤3次,每次 5 min,根据 Amax、IC50、Amax/IC50确定 ELISA 最佳反应条件。
1.3 实验条件的优化
1.3.1 包被抗原和一抗、二抗工作浓度的确定
用方阵滴定法进行测定,选择OD450nm值在1.0左右对应的包被抗原和一抗、二抗的浓度为ELISA反应的理想工作浓度。
1.3.2 抗原最佳包被时间的选择
以上面得到的抗原的最佳包被工作浓度,按37℃1、2、3、4、5 h和4℃过夜进行包被,以最佳抗血清稀释度进行ELISA测定,测OD450nm选择最佳包被时间。
1.3.3 封闭液浓度和封闭时间的选择
以浓度为0.5%、1%、1.5%、2%的BSA进行封闭,选择最佳封闭液浓度。然后以最佳封闭液浓度在37℃分别封闭 1、2、3和 4 h,测OD450nm选择最佳封闭时间。
1.3.4 抗原和抗体体积比及竞争时间的选择
以抗原和抗体体积比 70:30、60:40、50:50、40:60、30:70进行结合反应,测OD450nm选择最佳体积比。以抗原和抗体最佳体积比,37℃按45、60、75、90 min进行竞争反应,测OD450nm选择最佳竞争时间。
1.3.5 酶标二抗作用时间的选择
以酶标二抗最佳稀释度按 45、60、75、90 min进行反应,测OD450nm选择最佳作用时间。
1.3.6 显色液中TMB比例的选择
TMB与底物缓冲液的体积比按 1:10、1:15、1:20、1:25进行显色反应,测OD450nm选择最佳体积比。
1.3.7 显色时间的选择
加入底物后,37 ℃显色 10、15、20、25 min,测OD450nm选择最佳显色时间。
1.4 标准曲线的制作
根据上述优化的最佳条件,进行间接竞争ELISA测定,制备标准曲线。以系列稀释度(16、4、1、1/4、1/8、1/16 μg/ml)的 TI标准液建立测定梯度,测 OD450nm。抑制率I(%)=100×[(OD对照-ODTI)/(OD对照-OD空白)],以抑制率I为纵坐标,TI的浓度对数为横坐标,绘制标准曲线,建立回归方程。计算IC50和IC15,对其进行相关分析。
1.5 抗体特异性检测
在优化的实验条件下,分别考察了抗胰蛋白酶抑制剂的抗体与豆粕中其他主要的抗营养因子Glycinin与β-Conglycinin的交叉反应,以抗体稀释度的对数为横坐标,OD450nm为纵坐标作图反应抗体的特异性。
1.6 精密度的测定
以批内误差和批间误差来表示该方法的精密度。TI的每一标准样品浓度在同一块板内作6次重复,计算孔间变异系数表示批内误差;用同等质量的不同酶标板重复操作6次,计算批间变异系数表示批间误差。
1.7 样品的前处理
考察不同浸提液对样品的提取效果,所用浸提液有0.05 M pH值8.2 Tris-HCl,0.01 M NaOH(加入豆粕样品后调pH值9.5);pH值7.34 PBS、蒸馏水。称取豆粕样品0.5 g,加入25 ml浸提液,25℃振荡30 min,8000 r/min离心10 min,取上清适度稀释后按优化好的实验方法进行ELISA分析。
1.8 回收率的测定
在空白样品(经高温120℃处理30 min作为空白样)中分别添加浓度为 0.8、1.6、2.4 μg/ml的 TI,每个浓度设3个平行,用上述建立的方法进行检测,计算回收率。
2 结果与分析
2.1 ELISA方法的建立
经过优化后:在96孔酶标板上用包被液包被标准抗原(0.5 μg/ml),4 ℃过夜。用 PBST 洗板,1%BSA封闭液封板,37℃2 h,弃封闭液,PBST洗板。加梯度稀释的标准抗原、适度稀释的样品液和一抗(1:800),37℃孵育75 min。洗板后加二抗,37℃孵育75 min。洗板后加底物液,37℃反应15 min。加终止液终止反应,酶标仪读数。
2.2 标准曲线的建立
绘制的标准曲线如图1,得到的线性方程为y=16.18x+57.183(R2=0.9986)。
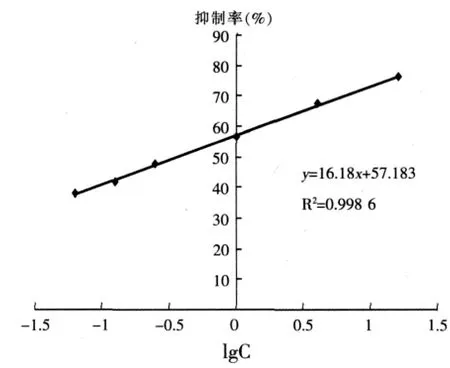
图1 TI标准曲线
在ELISA中,常用IC50(抗原抗体结合反应被抑制一半时抗原的浓度)表示灵敏度,IC50愈小,灵敏度愈高。最低检出限则由IC15来表示,即抗原抗体结合反应的抑制率为15%时所对应的抗原浓度。本实验建立的ELISA方法的灵敏度IC50为0.36 μg/ml,最低检出限 IC15为 2 ng/ml。
2.3 抗体特异性检测
测定结果如图2所示,Glycinin与β-Conglycinin抗原蛋白随着抗体稀释度的增加所对应的OD值变化很小,而且值很小。而TI随着抗体稀释度的增加所对应的OD值呈现出明显的下降趋势。这说明实验中所用的抗TI抗体具备显著的特异性。
2.4 精密度的测定
通过批内、批间变异系数的计算考察了实验的精密度。表1显示了线性范围内各个梯度浓度的批内变异系数为3.49%~18.77%,批间变异系数为4.55%~24.96%。
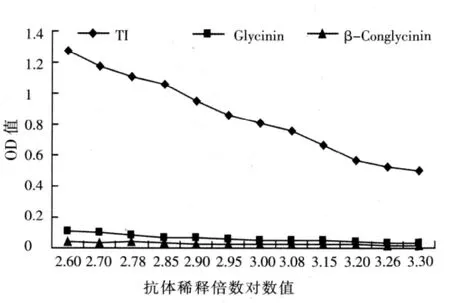
图2 抗体特异性
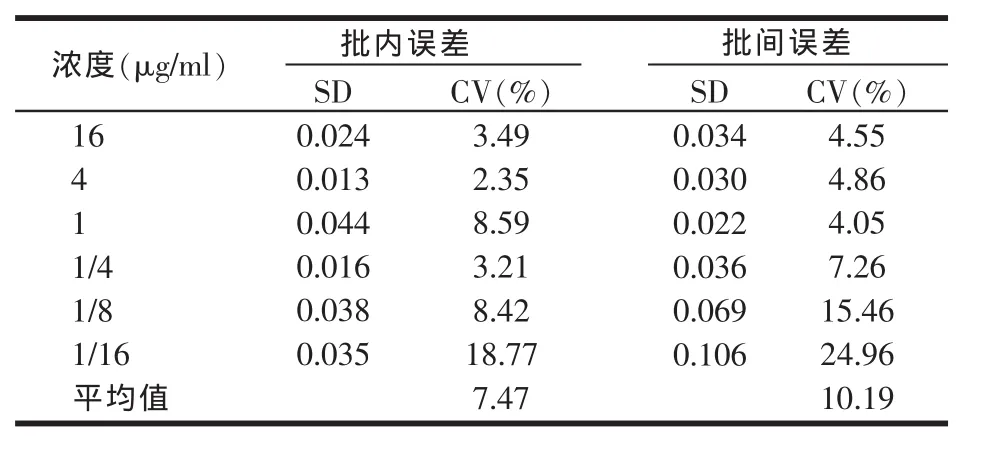
表1 不同TI浓度的变异系数
2.5 样品的前处理
在间接竞争ELISA中,OD值越小TI含量越高。实验结果见图3,0.05 M pH值8.2 Tris-HCl浸提效果最好。
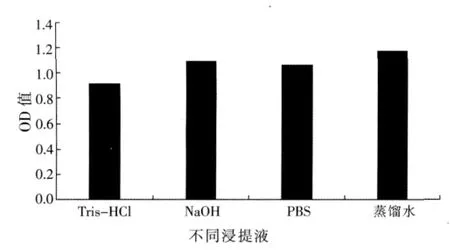
图3 不同浸提液的浸提效果
2.6 回收率的测定
在样品中添加浓度为 0.8、1.6、2.4 μg/ml的胰蛋白酶抑制剂,表2显示平均回收率依次为99.2%、93.7%、104.9%,所得样品添加的回收率都比较高,表明该实验建立的间接竞争ELISA方法符合实际。
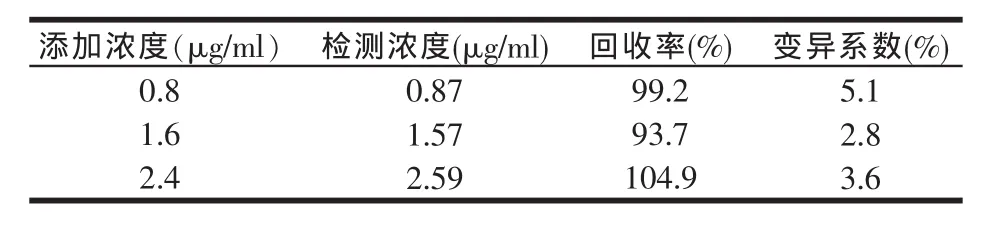
表2 样品添加的回收率
3 结论
酶联免疫吸附试验由于灵敏度高、特异性强等特点已经在饲料检测中获得了广泛的应用,但ELISA测定中影响因素较多。首先,酶标板的质量对测定结果有很大的影响,不同厂家、不同批次生产的板对试验结果的影响也不尽相同,建议最好使用同一厂家同一批次生产的板,有条件的最好使用进口板。第二,包被抗原时注意把抗原液缓慢加到孔底,尽量避免抗原液沾到侧壁上;抗原包被时间长度不能有太大变动,在本课题中,包被时长每次为16 h。第三,洗涤时,注意加洗涤液的方式,最好垂直加液,加液的速度不宜过快;倒液时,应尽量保证板面水平,且快速倒液。这样可以减少试剂污染,缩小实验结果的非系统误差。第四,在试验过程中,一抗和酶标二抗的效价在常温很容易降低,从而影响OD450nm值,为了使试验结果准确,应避免不必要的波动,一抗和酶标二抗均要求现用现配。第五,一些在4℃存放的缓冲液,在用前30 min要取出使温度平衡到室温。最后,在整个试验过程中所用的洗涤剂和缓冲液在配制时都要按照要求准确调节,这些微小的因素有时也能对整个实验的结果产生不必要的误差。总之,实验过程中实验操作、试剂、仪器等应保持前后一致,减少一切可能影响实验结果的因素,才能得到好的实验结果。
本实验建立的间接竞争ELISA检测TI的方法可以替代酶化学方法来检测TI,从而解决了酶化学方法检测某些发酵豆粕过程中因出现白色絮状物而不能检测这一问题。比较来看:首先ELISA是直接以含量(mg/g)为单位来评价检测结果,形象直观;酶化学方法则是以被抑制的胰蛋白酶的酶活来间接反应TI的含量,比较抽象。其次,相对于酶化学方法,灵敏度高、影响因素多、步骤相对繁琐是ELISA的缺点。实际应用时,可根据需求和检测条件进行合理的选择。
我国是一个饲料资源比较缺乏的国家,加强对抗营养因子检测方法的研究有利于指导饲料生产加工,提高饲料利用率,为缓解饲料缺口压力起到积极作用。
