康脑液 1号对大鼠脑缺血再灌注细胞凋亡及GFAP表达的影响
2010-03-07赵宝民邹玉安薛茜薄爱华杨向方
赵宝民 邹玉安 薛茜 薄爱华 杨向方
康脑液 1号为临床治疗缺血性脑血管病的经验组方,临床疗效良好。以往药理研究证实康脑液 1号组方中单药如黄芪、三七、葛根等具有降低血液黏度、改善脑血流、改善微循环、降低血脂及抑制炎性反应等作用[1,2]。缺血再灌注后损伤刺激胶质细胞反应性活化、增殖,进而形成胶质瘢痕,同时增加细胞凋亡。胶质纤维酸性蛋白(GFAP)的表达是星形胶质细胞的特异性标志。本研究通过观察康脑液 1号对局灶性脑缺血再灌注后缺血半暗带、梗死灶中心细胞凋亡及 GFAP表达的影响,以探讨其可能的脑保护作用机制。
1 材料与方法
1.1 实验动物与分组 健康雄性SD大鼠180只,体重(270±20)g,SPF/UAF级,购自北京大学医学部实验动物科学部,许可证号:SCXK(京)2006-0008。称重后随机分为 5组,每组 36只。(1)假手术组;(2)模型组;(3)盐酸法舒地尔组(6.3 mg◦100g-1◦ d-1);(4)康脑液 1号 A组(1.5 g◦ 100 g-1◦ d-1);(5)康脑液 1号 B组(30g◦ 100 g-1◦ d-1)。以颗粒型大鼠繁殖饲料喂养(北京康蓝生物技术有限公司生产),饮用去离子水,室温控制在 22~25℃,正常昼夜节律。
1.2 药物与试剂 盐酸法舒地尔注射液(川威):天津红日药业股份有限公司生产(国药准字 H 20040356,产品批号:060608,规格 2ml∶30mg)。栓线购自北京沙东生物技术有限公司[产品编号 2432-100,线长 40mm,线身直径 0.24mm,头端直径(0.32±0.02)mm]。试剂盒购自北京中杉金桥生物技术有限公司。
1.3 脑缺血再灌注损伤模型的制备 采用改进 Longa线栓法[3]制备大鼠右侧大脑中动脉脑缺血再灌注模型。SD大鼠术前 24 h禁食,随意进水。用 7%水合氯醛(350mg/kg)腹腔注射麻醉,不结扎翼颚动脉,均缺血 2 h,术后单笼、分组给药。假手术组将栓线插入颈内动脉但不入颅,2 h后退回至颈外动脉内,其余步骤同实验组。
1.4 用药方法 康脑液 1号,由黄芪、三七、葛根等组成。饮片购自河北北方学院第一附属医院中药房。常规煎煮浓缩至4 g/m l。盐酸法舒地尔组采用腹腔注射法给药,康脑液 1号组采用灌胃法给药,每天早晨给药 1次,均连续给药 7 d,最后 1次给药后 1h实施脑缺血再灌注手术缺血 2h,术后继续给药至再灌注各时间点(1、3、7 d);给药剂量按大鼠与人体表面积等效剂量折算。康脑液 1号 A组剂量为 15 g◦ g-1◦d-1,B组剂量为 30g◦g-1◦d-1。假手术组和模型组动物也于 1、3、7 d给予等量去离子水灌胃。于术后分别取材。观察 5组大鼠术毕清醒后的 Longa评分和术后的活动度变化。
1.5 动物灌注固定与取材 将实验大鼠缺血 2 h,至再灌注所需时间点时,7%水合氯醛腹腔注射麻醉仰卧位固定,暴露心脏。将灌注针从左心室心尖部插入直至升主动脉并固定,灌注肝素化 0.9%氯化钠溶液 150m l,同时剪开右心房,将全身血液冲洗干净,然后应用 4%多聚甲醛 200 ml(4℃)心脏灌注固定30min。快速断头取脑,从前向后将脑组织分为 A、B、C、D、E五等分,切成厚度约2~3mm的脑片,选取 C脑片,入 4%多聚甲醛固定液中继续固定24 h。
1.6 TTC染色和脑梗死面积测定 缺血 2 h再灌注 24 h后,每组随机抽取 6只大鼠,快速断头取出鼠脑,置冰箱(-20℃)内 10min后,切除嗅脑,取冠状面从前向后将脑组织分为A、B、C、D、E五等分,切成厚度 2~3mm厚的脑片,选取 C脑片,将切片迅速置于 2%TTC溶液(37℃水浴)中避光条件下染色30min。正常脑组织染成红色,缺血区呈灰白色,界线清晰。4%多聚甲醛固定 24 h。数码相机摄片,计算机图像分析,求得TTC染色两侧正常区与梗死灶的面积。以缺血对侧脑片的面积减去缺血侧 TTC染色正常区的面积求得脑梗死面积。
1.7 HE染色、细胞凋亡和免疫组化测定 常规乙醇脱水、二甲苯透明,石蜡包埋,切片厚度 5μm,4℃储存备用。HE染色观察病理形态,免疫组织化学染色法采用 SP法,操作严格按说明书进行,DAB显色,常规脱水、透明、封片。用已知阳性切片作为阳性对照,PBS替代一抗作为阴性对照。
1.8 统计学分析 应用 SPSS 16.0统计软件,计量资料以±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 神经功能行为学评分及脑梗死体积 缺血再灌注 6 h即可看到明显梗死灶,累及右侧大脑半球基底节区、额顶叶皮层及海马区,随再灌流时间的延长梗死体积百分比逐渐增大,至缺血再灌注 24h时,梗死灶占C脑片面积百分比达(43.0±0.7)%。康脑液 1号A、B组达(35.0±0.4)%。康脑液 1号A、B组比模型组梗死体积明显减小,且神经功能行为学评分与其余各组比较差异有统计学意义(P<0.05)。见表 1。
2.2 病理组织学改变 高倍光镜下,(1)假手术组:大脑组织结构完整,无梗死灶及水肿。神经细胞、神经胶质细胞未见异常。胞膜、核膜、核仁清晰。(2)模型组:缺血第 1天,缺血对侧,细胞形态正常。缺血侧皮质神经细胞数量明显减少,排列紊乱,组织间隙水肿严重。缺血半暗带明显,神经细胞稍小,形态基本正常;缺血灶中心区神经细胞体积明显缩小,部分细胞呈三角形,胶质细胞固缩。缺血第 7天神经细胞、胶质细胞及毛细血管、小血管与周围脑间质的间隙显著增大,间质疏松。病灶中心区随时间延长出现大量液化性坏死灶及囊性变,后期呈网状改变,残存细胞很少。(3)康脑液 1号 2组及盐酸法舒地尔组:在各个时间点与模型组相比,神经元形态改变较轻,胞体完整,突起较清楚,基本保持完整。可见尚存的大脑皮质的正常神经元排列结构,且组织间隙水肿较模型组明显减轻,神经元、胶质细胞和血管大量变性坏死等缺血性改变和炎性反应明显轻于模型组。5组病理组织学改变提示大鼠 MCAO模型制备成功。
2.3 TUNEL凋亡和免疫组化结果 光镜下(×400)在梗死灶及周边区各随机选取 10个互不重叠视野,计数平均数和标准差,计数阳性细胞数。细胞核内存在棕黄色颗粒者为凋亡细胞。各组缺血对侧半球脑组织切片中可见少量阳性细胞。模型组缺血半球凋亡细胞散布于整个缺血区内,病灶边缘可见较多的阳性细胞而病灶中心阳性细胞数较少。康脑液 1号 2组病灶边缘可见少量阳性细胞,而病灶中心可见较多阳性细胞,与其余各组比较差异有统计学意义(P<0.05)。假手术组仅有少数阳性细胞见表 2、3。模型组缺血梗死边缘区星形胶质细胞 GFAP的表达随着再灌注时间的延长而逐渐升高,7 d逐渐达到高峰,与假手术组比较差异有统计学意义(P<0.01)。而梗死灶中心 GFAP的表达很少。盐酸法舒地尔组与模型组的 GFAP表达相近。康脑液 1号 2组梗死灶周边 GFAP的表达很少;而梗死灶中心GFAP的表达较多,与模型组、盐酸法舒地尔组比较差异有统计学意义(P<0.01)。康脑液 1号 2组的影响:减少缺血半暗带神经元凋亡而 GFAP的表达较少;诱导病灶中心神经元凋亡减少坏死而 GFAP的表达较多,康脑液 1号各组比较差异无统计学意义(P>0.05)。见表 4、5。
表 1 康脑液 1号对缺血再灌注大鼠神经功能行为学评分的影响n=30,±s
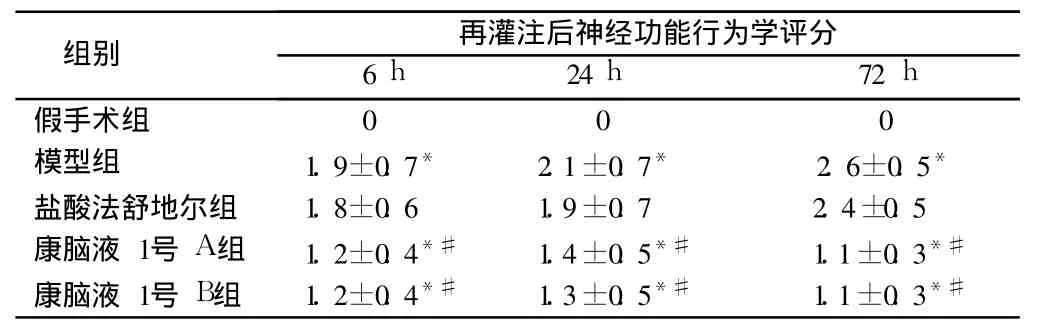
表 1 康脑液 1号对缺血再灌注大鼠神经功能行为学评分的影响n=30,±s
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 再灌注后神经功能行为学评分6h 24 h 72 h假手术组 0 0 0模型组 1.9±0.7* 2.1±0.7* 2.6±0.5*盐酸法舒地尔组 1.8±0.6 1.9±0.7 2.4±0.5康脑液 1号 A组 1.2±0.4*# 1.4±0.5*# 1.1±0.3*#康脑液 1号 B组 1.2±0.4*# 1.3±0.5*# 1.1±0.3*#
表 2 康脑液 1号对脑缺血再灌注大鼠梗死灶周边神经细胞凋亡的影响n=30,±s
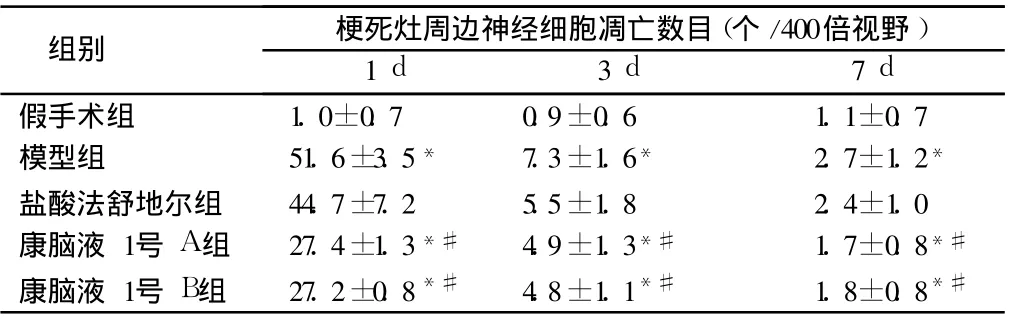
表 2 康脑液 1号对脑缺血再灌注大鼠梗死灶周边神经细胞凋亡的影响n=30,±s
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 梗死灶周边神经细胞凋亡数目(个/400倍视野)1 d 3 d 7 d假手术组 1.0±0.7 0.9±0.6 1.1±0.7模型组 51.6±3.5* 7.3±1.6* 2.7±1.2*盐酸法舒地尔组 44.7±7.2 5.5±1.8 2.4±1.0康脑液 1号 A组 27.4±1.3*# 4.9±1.3*# 1.7±0.8*#康脑液 1号 B组 27.2±0.8*# 4.8±1.1*# 1.8±0.8*#
表 3 康脑液 1号对脑缺血再灌注大鼠梗死灶中心神经细胞凋亡的影响n=30,±s
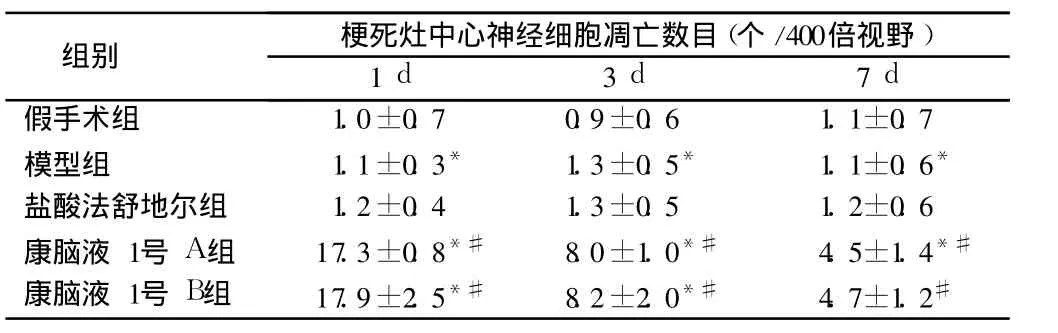
表 3 康脑液 1号对脑缺血再灌注大鼠梗死灶中心神经细胞凋亡的影响n=30,±s
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 梗死灶中心神经细胞凋亡数目(个/400倍视野)1 d 3 d 7 d假手术组 1.0±0.7 0.9±0.6 1.1±0.7模型组 1.1±0.3* 1.3±0.5* 1.1±0.6*盐酸法舒地尔组 1.2±0.4 1.3±0.5 1.2±0.6康脑液 1号 A组 17.3±0.8*# 8.0±1.0*# 4.5±1.4*#康脑液 1号 B组 17.9±2.5*# 8.2±2.0*# 4.7±1.2#
表 4 康脑液 1号对缺血再灌注大鼠梗死灶周边 GFAP表达的影响n=30,±s
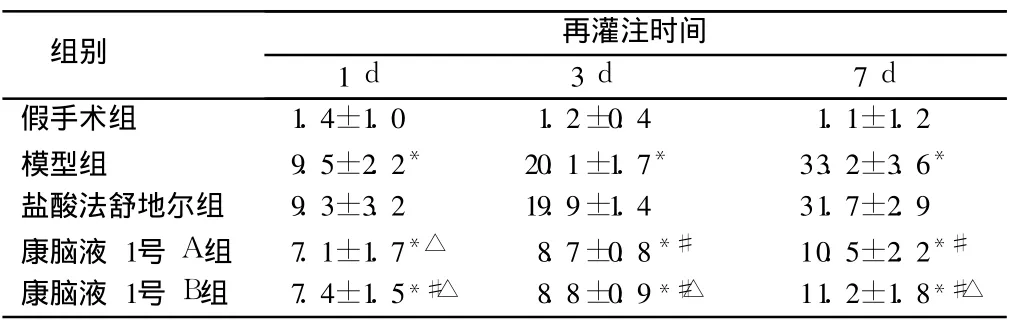
表 4 康脑液 1号对缺血再灌注大鼠梗死灶周边 GFAP表达的影响n=30,±s
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 再灌注时间1 d 3 d 7 d假手术组 1.4±1.0 1.2±0.4 1.1±1.2模型组 9.5±2.2* 20.1±1.7* 33.2±3.6*盐酸法舒地尔组 9.3±3.2 19.9±1.4 31.7±2.9康脑液 1号 A组 7.1±1.7*△ 8.7±0.8*# 10.5±2.2*#康脑液 1号 B组 7.4±1.5*#△ 8.8±0.9*#△ 11.2±1.8*#△
表 5 康脑液 1号对缺血再灌注大鼠梗死灶中心 GFAP表达的影响n=30,±s
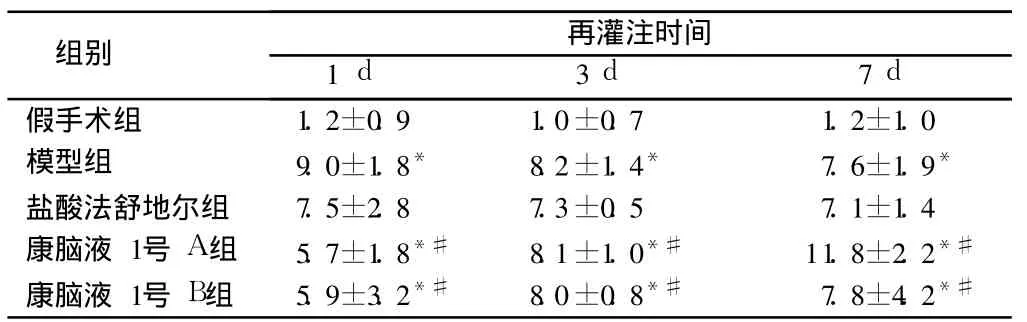
表 5 康脑液 1号对缺血再灌注大鼠梗死灶中心 GFAP表达的影响n=30,±s
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 再灌注时间1 d 3 d 7 d假手术组 1.2±0.9 1.0±0.7 1.2±1.0模型组 9.0±1.8* 8.2±1.4* 7.6±1.9*盐酸法舒地尔组 7.5±2.8 7.3±0.5 7.1±1.4康脑液 1号 A组 5.7±1.8*# 8.1±1.0*# 11.8±2.2*#康脑液 1号 B组 5.9±3.2*# 8.0±0.8*# 7.8±4.2*#
3 讨论
脑缺血再灌注后神经元凋亡的发生既是凋亡相关基因表达的结果,又受许多内外因素的调节。与凋亡基因激活、氧自由基、钙超载、线粒体损伤导致细胞能量代谢障碍、凋亡蛋白因子及相关细胞因子过度表达有关。研究表明,缺血半暗带的细胞损伤主要通过神经元凋亡(apoptosis)途径进行[4,5]。最显著发生凋亡的部位是缺血半暗带及缺血敏感区(如海马)等部位[6],脑缺血后细胞凋亡在缺血再灌注 30min即出现,以 24~48 h凋亡细胞数目最多 ,可一直持续到再灌注 28 d[7]。
局灶性脑缺血再灌注损伤时,星形胶质细胞在缺血再灌注损伤刺激后表达明显增高。在后期形成胶质瘢痕,影响神经功能的恢复。GFAP(胶质纤维酸性蛋白)是星形胶质细胞合成的一种重要骨架蛋白,是星形胶质细胞的特异性标记物,其表达量的多少可以反映星形胶质细胞的功能状态。缺血刺激使得星形胶质细胞 GFAP活化表达增加,启动细胞周期的进程。星形胶质细胞的活化状态上调分泌神经生长因子和成纤维细胞生长因子对神经组织起营养支持保护作用,可能有利于神经元的修复[8]。
星形胶质细胞通过调节神经细胞内外离子浓度,抑制钙超载,拮抗兴奋性氨基酸细胞毒性作用,抗氧化和自由基,释放生物活性物质,提供能量等对神经元起保护作用[9]。本研究结果显示,假手术组各时间点大鼠凋亡细胞和 GFAP阳性细胞数变化不明显。在坏死边缘区,模型组与盐酸法舒地尔组各时间点凋亡细胞数不同程度减少。而GFAP阳性细胞数均不同程度增加,且第 7天时达高峰;坏死中心区域[10]凋亡细胞和 GFAP阳性细胞数较少。康脑液 1号各组能减少梗死灶周边凋亡细胞和星形胶质细胞表达GFAP,增加梗死灶中心区域凋亡细胞和星形胶质细胞表达GFAP,引起星形胶质细胞明显的调节性活化,康脑液 1号对梗死灶周围细胞凋亡和神经胶质细胞的增生有显著抑制作用,减少脑缺血再灌注后缺血半暗带胶质瘢痕,减少了梗死面积。能明显减轻脑缺血再灌注导致的脑损伤,康脑液 1号各组与模型组梗死灶面积、神经胶质细胞 GFAP表达有显著性差异。这些改变可能促进神经元的修复及重塑。
康脑液 1号,由黄芪、三七等组成,全方具益气活血、熄风清心、清热利湿之效。因此我们推测,康脑液 1号在脑缺血再灌注后梗死灶的病理形态改变与调节细胞凋亡和神经胶质细胞活性可能有关,从而得以重塑梗死灶。有研究表明,抑制梗死灶周边细胞凋亡和神经胶质细胞的增生,对神经功能的重塑有重要意义[11]。故调控缺血后细胞凋亡和星形胶质细胞的活性可能是脑缺血治疗的新方向。
1 李花,邓常清,陈北阳,等.三七总皂苷对大鼠脑缺血再灌注后Caspase表达的影响.中国药理学通报,2006,22:189-193.
2 何蔚,朱遵平.三七总皂苷对大鼠脑梗死区 ICAM-1表达和中性粒细胞浸润的影响.中药材,2005,28:403-405.
3 Longa EZ,Weinstein PR,Carlson S,et al.Reversiblem iddle Cerebral artery occlusion without craniectomy in rats.Stroke,1989,20:84-91.
4 Love S.Apoptosis and brain ischem ia.Prog Neuropsychopharmacol Biol Psychiatry,2003,27:267.
5 Yao H,Takasawa R,Fukudu K,et al.DNA fragmentation in ischem ic core and penumbra in focal cerebral ischem ia in rats.Mol Brain Res,2001,91:112-118.
6 Grotewold L,Ruther U.Fgfand Wnt signaling in programmed celldeath and chondrogenesis during vertebrate limb development:the role of Dickkopf-1.Int JDev Biol,2002,46:943-947.
7 Grotewold L,Ruther U.TheWnt antagonist Dickkopf-1 is regulated by Bmp signaling and c-Jun and modulates programmed cell death.EMBO J,2002,21:966-975.
8 杨忠,李红丽,蔡文琴,等.两种不同脑损伤后胶质细胞反应性变化的比较研究.第三军医大学学报,2001,9:1074-1077.
9 韩冬,冯加纯.星形胶质细胞对脑缺血后神经元的保护作用.中国卒中杂志,2006,1:644-646.
10 KajiharaH,Tsutsum i E,Kinoshita A et al.Activated astrocytes with glycogen accumulation in ischem ic penumbra during the early stage of brain infarction:immunohistochemical and electron m icroscopic studies.Brain Res,2001,909:92-101.
11 Zhu Z,Zhang Q,Yu ZY,et al.Inhibiting Cell cycle progression reduces reactive astrogliosis initiated by scratch injury in vitro and by cerebral ischem ia in vivo.Glia,2006,55:546-558.
