ERIC-PCR对山东省东平湖4种常见淡水鱼肠道菌群多样性的分析*
2010-03-07周玉法刘敬博苗增民蔡玉梅李代军
周玉法,刘敬博,苗增民,蔡玉梅*,李代军
(1.山东农业大学动物科技学院,山东泰安271018;2.泰安市岱岳区畜牧局,山东泰安271000)
鱼类肠道中寄生着种类繁多、数量巨大的微生物,它可以帮助消化食物产生一些必需的氨基酸和维生素,对机体的生长有一定的促进作用,并且这些微生物主要是由大量细菌组成的。微生态学研究表明,环境条件的改变可导致机体微生态系统的变化,造成菌群失调,干扰机体营养代谢和免疫功能,甚至严重影响机体健康,导致一系列疾病的发生。因此对肠道菌群结构多样性进行研究具有至关重要的意义。但是,肠道内微生物很多都是厌氧菌,用传统的细菌学方法很难对其分析,并且传统的细菌分离和培养方法耗时、费力,易受操作方法的影响。而分子生物学的发展为分析肠道菌群的结构带来了希望。一些分子生物学研究方法,如质粒图谱、限制性核酸内切酶谱、脉冲场凝胶电泳(PFGE)、随机引物PCR(RAPD)及ERIC-PCR等,已经被应用于微生物群落的分析与研究,其中,以ERIC序列为基础的ERIC-PCR指纹图谱分析是目前应用最广泛的方法之一,它与其它方法相比,其灵敏度高、可重复性和可靠性好、且省时省力[1]。
肠道细菌中发现的ERIC序列是一段长为126 bp的反向重复序列,定位于基因组内可转录的非编码区域或与转录有关的区域,且该序列散布在整个基因组中,具有极强的保守性,用ERIC-PCR得到的DNA条带特征能反映细菌整个基因组结构的差异,因而能清晰地区别包含有ERIC重复序列细菌的不同种和不同菌株,具有很强的鉴别种乃至菌株的能力[2]。ERIC-PCR技术已被证明是研究复合菌群结构的有效手段,并已被广泛应用于各种生物的肠道菌群和环境复合菌群结构的研究中[3-6]。但采用ERIC-PCR技术研究鱼类及其他水生生物的肠道菌群研究结果还未见报道。
本研究采用ERIC-PCR技术对山东省东平湖(山东省第二大淡水湖)常见4种淡水鱼(表1)的肠道菌群的组成进行了研究,建立了它们的ERICPCR指纹图谱并分析了它们之间的相似性,从而为本地区鱼类疾病的防治、微生物类添加剂以及微生态育种提供理论依据。
1 材料与方法
1.1 试验用鱼
4种健康淡水鱼(表1)均采集于东平湖同一水域下的某养殖区。

表1 山东省东平湖4种常见淡水鱼T able 1 four kinds of common fresh water fish from Dongping Lake,Shandong Province
1.2 样品采集及肠道细菌总DNA的提取
使用无菌的牙签将肠道划开,剥取里面的肠道内容物。每种鱼收集10个个体的肠道内容物,混合后作为这种鱼的代表样品,置于—20℃冰箱保存备用。
用苯酚-氯仿抽提法从鱼类肠道样品中提取基因组DNA,并用100 μ L去离子无菌水溶解,—20℃冷冻保存备用[7]。
1.3 ERIC-PCR
采用引物ERIC1(3′-CACT TAGGGGTCCTCGAATGTA-5′)和ERIC2(5′-AAGTAAGTGACTGGGGTGAGCG-3′)[8]进行PCR,反应体系由以下成分组成:1.5 U Taq DNA聚合酶,引物ERIC1和ERIC2各300 ng/μ L,0.875 mmol/L dNTPs,1×buffer,1.5 mmol/L MgCl2,2 μ L模板DNA,最后用灭菌双蒸水补充至25 μ L。反应参数:95℃5 min;94℃1 min,51℃复性1 min,72℃延伸3 min,32个循环;最后72℃延伸16 min,结束反应。进行电泳之前,所有PCR反应产物在4℃条件下保存。PCR扩增产物经12 g/L~15 g/L的琼脂糖凝胶电泳分离,以DL 2 000 Maker作为分子质量标准,电泳结果在紫外分析仪(Tanon-2500,Shanghai,China)上照相。
1.4 ERIC-PCR分析
计算机软件记录下扩增及电泳谱带,用电泳图象分析软件(Gel Image System,Version 4.00)自动生成矩阵图。采用非加权对数算术平均法(Unweighted pair group method using averages algorithm,UPGMA),利用NTSYS-pc 2.10软件构建聚类树状图。
2 结果
2.1 ERIC-PCR指纹图谱的建立
每一条泳道代表1种鱼的肠道菌群ERIC-PCR指纹图谱(图1)。因为每条泳道代表的是1种鱼10个个体的混合样品,所以它反映的是这种鱼肠道菌群的平均状态。不同位置的条带代表不同的细菌,亮度反映出细菌相对量的多少。从不同泳道的条带数量、位置和亮度的差异表明4种鱼的肠道菌群的结构组成是不一样的,反映了这些鱼的肠道细菌的结构存在明显的多样性差异。
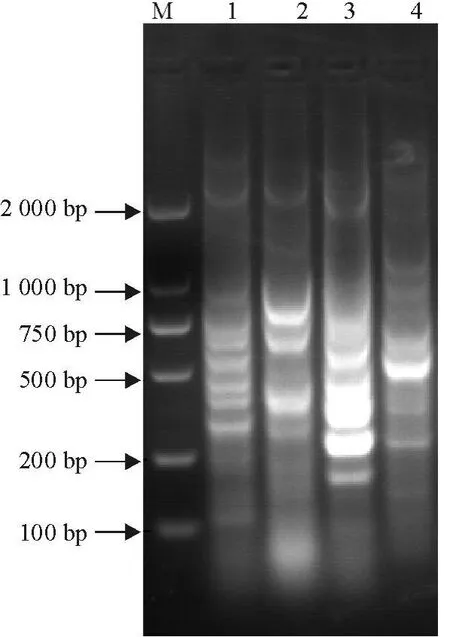
图1 4种鱼肠道菌群ERIC-PCR电泳图Fig.1 ERIC-PCR electrophoresis chart of four kinds of fish
2.2 ERIC-PCR图谱与肠道细菌组成分析
用ERIC-PCR方法对4种鱼肠道菌群进行扩增,得到了每一种鱼的肠道菌群聚类树状图,相同种类肠道菌群具有相同的ERIC-PCR指纹图谱。如图2所示,样品1和3的相似性为0.64,说明这两种鱼肠道菌群相似性较高,而样品2和4相似性较差,且与样品1和3差异也很大,这很可能与这四种鱼的食性和生长的水层有很大关系。

图2 4种鱼肠道菌群ERIC-PCR聚类分析图Fig.2 ERIC-PCR analysis chart of microfilaria in four fishes
3 讨论
已有多篇研究报道鱼类肠道菌群的组成和食物有着密切的关系。尹军霞等[9]用细菌培养和计数的方法对鲢鱼、鳊鱼、鲫鱼等4种不同食性鱼的后肠菌群进行了分析后,认为后肠内容物中的细菌总数、后肠内容物和后肠壁中的双歧杆菌数都与食性相关。曹志华等[10]用稀释平板计数法对摄食含尿素饲料和对照饲料的健康鲤鱼肠道菌群进行了分析,证明摄食含尿素饲料的实验组能利用尿素的细菌占细菌总数的比例比对照组高了30%。周文豪等[11]对摄食不同饵料的草鱼肠道菌群进行研究,证明饵料中的菌群在摄食后48 h内可以影响草鱼肠道菌群的数量及组成。由于培养的方法具有较高的选择性,所以大部分采用培养方法的研究报道主要集中于某几类细菌的数量变化上。
采用分子生物学技术比较某种鱼类或其他水生生物在2种或3种状态下(比如不同养殖场或不同饲料)的肠道菌群差别的研究也被报道。如Holben等人研究了养殖型和野生型鲑鱼的肠道菌群;Huber W E等[12]研究了不同渔场的虹鳟的肠道菌群;Tanaka R J等[13]研究了不同食物条件下的鲍鱼肠道菌群[14]。但是,采用ERIC-PCR方法快速分析多种鱼类肠道菌群的差异以及观察这种差异和食性的关系,还未见报道。本试验通过ERIC-PCR分析技术对山东东平湖4种常见淡水鱼肠道菌群的多样性进行分析,并通过UPGMA分析了不同食性和肠道菌群多样性的相关关系。
本研究所采用的样品全部是来自东平湖同一水域条件下健康成年鱼,并且每种鱼采用10个个体的混合样品,这样降低了食性以外的其他因素包括个体差异对研究结果的影响。虽然在东平湖同一水域条件下,很多影响因素不能得到控制,比如水体表层和底层的环境是不同的,但是对这4种鱼类样品的研究能够反映出在同一水域条件下鱼类肠道菌群的状态。
本研究建立了山东东平湖4种常见淡水鱼类在同一水域条件下肠道菌群的ERIC-PCR指纹图谱,观察到它们的肠道菌群在同一条件下具有较大差异,并且食性差异大的鱼类之间肠道菌群差异也更为明显。本研究证明,ERIC-PCR技术是一种能够快速有效地研究鱼类肠道菌群的技术,是较其它方法更简单、灵敏度更高、可重复性和可靠性较好,且能较为全面反映菌群结构多样性的方法。如果有必要,对ERIC-PCR优势条带DNA的割胶测序可以进一步确定肠道菌群的优势细菌。
[1] 高卫科,王川庆,吴高锋,等.ERIC-PCR及在肠道菌群分析中的应用[J].上海畜牧兽医通讯,2008(2):52-53.
[2] Hulton C S,Higgins C F,Sharp P M.ERIC sequences:a novel family of repetitive elements in the genomes of Escherichia coli,Salmonella typhimuirum and other enterobacteria[J].Mol Microbiol,1991,5:825-834.
[3] Di Giovanni G D,Watrud L S,Seidler R J,et al.Comparison of parental and transgenic alfalfa rhizosphere acterial communities using Biolog GN metabolic fingerprinting and Enterobacterial Repetitive Intergenic Consensus sequence-PCR(ERIC-PCR)[J].Microbial Ecology,1999,37(2):129-139.
[4] 潘 莉,杜惠敏,黄海东,等.腹泻儿童肠道菌群结构的ERIC-PCR指纹图分析[J].中国微生态学杂志,2003,15(3):141-144.
[5] 鲁海峰,魏桂芳,李仲逵,等.ERIC-PCR分子杂交技术分析大熊猫肠道菌群结构[J].中国微生态学杂志,2005,17(2):81-84.
[6] Wong H C,Lin C H.Evaluation of typing of Vibrio parahaemolyticus by throe PCR methods using special pfimem[J].J Clin Microbiol,2001,39(12):4233-4240.
[7] 金 晶,彭 颖,李晓波.快速提取肠道微生物基因组DNA的方法[J].现代生物医学进展,2007,7(1):100-103.
[8] Versalovic J,Koeuth T,Lupski J R.Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes[J].Nucleic Acids Res,1991,19(24):6823-6831.
[9] 尹军霞,沈文英,张建龙,等.不同食性鱼肠道壁菌群的研究[J].水利渔业,2003,23(5):7-8.
[10] 曹志华,易万军,罗静波.尿素对鲤鱼消化道菌群的影响[J].湖北农学院学报,2001,21(3):226-228.
[11] 周文豪,陈孝煊,张冬晓,等.摄食不同饵料对草鱼肠道菌群影响的研究[J].华中农业大学学报,1998,17(3):252-256.
[12] Holben W E,Williams P,Gilbert M A,et al.Phylogenetic analysis of intestinal microflora indicates a novel Mycoplasma phenotype in farmed and wild salmon[J].Microbiol Ecol,2002,44:175-185.
[13] Huber I,Spanggaard B,Appel K F,et al.Phylogenetic analysis and in situ identification of the intestinal microbial community of rainbow trout(Oncorhynchus mykiss,Walbaum)[J].J Appl Microbiol,2004,96(1):117-132.
[14] T anaka R J,Ootsubo M,Sawabe T,et al.Biodiversity and in situ abundance of gut microflora of abalone(Haliotis discus hannai)determined by culture-independent techniques[J].Aquaculture,2004,241(1-4):453-463.
