知母中α-葡萄糖苷酶抑制剂的提取及性质研究
2010-02-23杨秀芳闫倩茹
杨秀芳, 陈 梅, 闫倩茹
(1.教育部轻化工助剂化学与技术重点实验室, 陕西科技大学化学与化工学院, 陕西 西安 710021)
0 引言
糖尿病是一种常见的有遗传倾向的内分泌系统疾病,预防和治疗糖尿病目前已成为医学界十分关注的课题[1,2].α-葡萄糖苷酶在机体的许多代谢过程中起着关键的作用,并与许多因代谢紊乱失调而引发的疾病有密切关系,如糖尿病、癌症、病毒感染等[3].因此,人们试图寻找合适的抑制剂用于控制和调节α-葡萄糖苷酶的活性,以期对有关疾病进行防治.目前研制的此类抑制剂有些已成为治疗糖尿病的新药,我国传统中医学治疗糖尿病已有2 000多年的历史,近年来国家确认了一批具有降血糖活性的中药,为筛选α-葡萄糖苷酶抑制剂类药物提供了良好的背景.
知母为百合科植物知母AnemarrhenaasphodeloidesBge.的干燥根茎,现代药理研究结果表明知母具有清热泻火、生津润燥等功效[4].有研究报道知母水提物亦具有一定的α-葡萄糖苷酶抑制剂作用[5].在前人筛选工作的基础上,作者进一步研究了知母总水提物的α-葡萄糖苷酶抑制作用,旨在从中提取分离出α-葡萄糖苷酶抑制剂并对其性质进行初步的研究.
1 材料与仪器
材料与试剂: pHS-25数显pH计(上海精密科学仪器有限公司);UV-1700紫外分光光度计;GL21高速冷冻离心机; 4-硝基苯-α-D-吡喃葡萄糖苷(PNPG),购自Sigma;SPK-100超滤膜,购自中科院上海生化所;药材购自西安市中药材市场,其余试剂均为分析纯.
2 实验部分
2.1 相关试剂的配制
(1)pH 6.8、浓度为0.1 mol·L-1的磷酸缓冲溶液:将0.1 mol·L-1KH2PO4溶液67.5 mL与0.1 mol·L-1K2HPO4溶液82.5 mL混合.
(2)PNPG溶液:0.301 5 g PNPG溶于100 mL蒸馏水中,配成1 mmol·L-1的溶液.
(3)Na2CO3终止液:21.2 g Na2CO3溶于1 000 mL蒸馏水中,配成0.2 mol·L-1的溶液.
2.2 α-葡萄糖苷酶活性的测定
根据Tremblay等[6]的方法测定α-葡萄糖苷酶活性.取1 mmol PNPG 2 mL,pH 6.8磷酸缓冲溶液2 mL,在37 ℃水浴锅中保温5 min,再加入1 mL酶液,保温15 min,加入0.2 mol·L-1Na2CO3终止液5 mL,在400 nm的条件下测定其吸光度.用蒸馏水代替酶液作空白,其它步骤试剂一样,其中酶活力单位定义为:在37 ℃,pH 6.8的条件下酶液每分钟水解PNPG释放1μmol对硝基酚(PNP)的酶活力.抑制剂活力单位定义为:在相同的条件下,降低1个酶活力单位所需抑制剂的量.抑制百分比 =(抑制剂活力/酶活力)×100%.
2.3 知母中α-葡萄糖苷酶抑制活性成分的提取、分离及纯化
2.3.1 抑制活性成分HGI的分离纯化
称取知母切片120 g,按知母与水1∶4 w/v的比例浸泡,于60 ℃下浸提48 h.用12层纱布过滤,滤液在4 000 r/min下离心15 min,将上清液依次用石油醚、乙酸乙酯、正丁醇萃取,并测定各部分的抑制活力.对抑制活性最强的乙酸乙酯部分经活性炭脱色后,再用SPK-100滤膜超滤,被截留部分上CMC纤维素柱层析,紫外检测收集有抑制活性部分,真空浓缩干燥即得抑制剂HGI.
2.3.2 HGI纯度测定
将HGI溶液点样于乙酸纤维素薄膜上,两端用滤纸搭桥,电压150 V,电泳15 min,缓冲液为pH 12.2的硼酸盐缓冲液.0.5%甲苯胺蓝染色,1%乙酸脱色.
2.4 知母中抑制剂的动力学实验
2.4.1 温度对知母抑制剂的影响
分别在30、40、50、60、70、80、90、100 ℃下测定知母中α-葡萄糖苷酶抑制剂的抑制活力(作相应空白对照),反应终止时迅速冷却至室温.
2.4.2 pH对知母抑制剂的影响
分别配制pH 2.0、3.0、4.0、5.0、6.0、6.8、7.5、8.0、9.0、10.0、11.0、12.0、13.0、14.0的缓冲溶液,在此缓冲体系下,测有抑制剂及无抑制剂两种条件下的酶活力.
2.4.3 抑制剂浓度对抑制效果的影响
分别选取抑制剂浓度为0、10、20、40、50、60、80、100 mg·mL-1,在同样温度、时间及pH条件下测定抑制活力.
2.4.4 抑制剂作用时间对抑制效果的影响
在试管中加入α-葡萄糖苷酶及抑制剂溶液(终浓度为40 mg·mL-1),分别于37 ℃保温.在反应过程中,分别控制抑制剂作用时间为0、1、2、5、10、15、20 min,比较在不同时间下抑制剂的抑制效果.
2.4.5 抑制剂抑制类型的确定
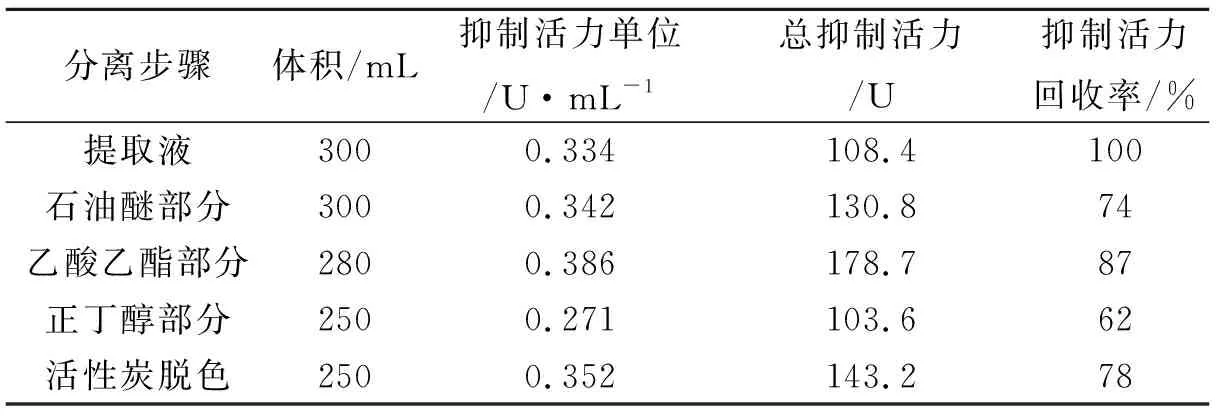
表1 HGI的分离纯化
在一定抑制剂浓度条件下,分别加入底物(浓度为0.2、0.3、0.4、0.5 mmol·L-1),测定酶活力.改变抑制剂浓度(分别为0、0.5、1 mg/mL),可得出一系列不同底物浓度条件下的酶活力,用双倒数作图法确定抑制类型.
3 结果与讨论
3.1 抑制剂的分离纯化
按2.3.1对知母提取物中的抑制成分进行分离纯化,各步骤分离结果如表1所示,经活性炭脱色后的活力单位为0.352 U/mL.再经超滤、柱层析后收集有抑制活性的流分,该组分浓缩干燥后得到α-葡萄糖苷酶抑制剂试样,其提取物抑制比活力为粗提液的2.4倍.
3.2 HGI乙酸纤维素薄膜电泳结果

图1 乙酸纤维素薄膜电泳结果
电泳时样品由负极向正极移动,染色得单一蓝色条带(见图1).HGI的成分鉴定:提取物HGI经茚三酮实验、双缩脲实验、三氯化铁实验、检测皂甙和黄酮类物质的实验结果均为阴性,只有Molish实验(糖及糖苷类物质的定性实验)结果呈阳性,表明HGI中不含蛋白质或酚类物质,因此HGI可能是含糖的大分子多聚物.

图2 温度对抑制效果的影响 图3 pH对酶活性和HGI抑制活性的影响
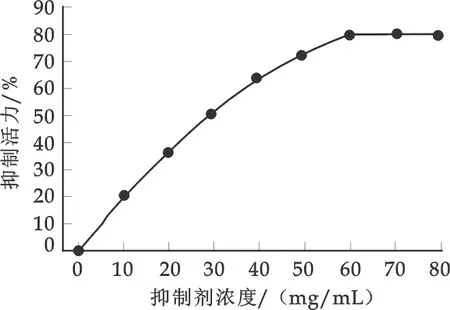
图4 抑制剂浓度对抑制效果的影响
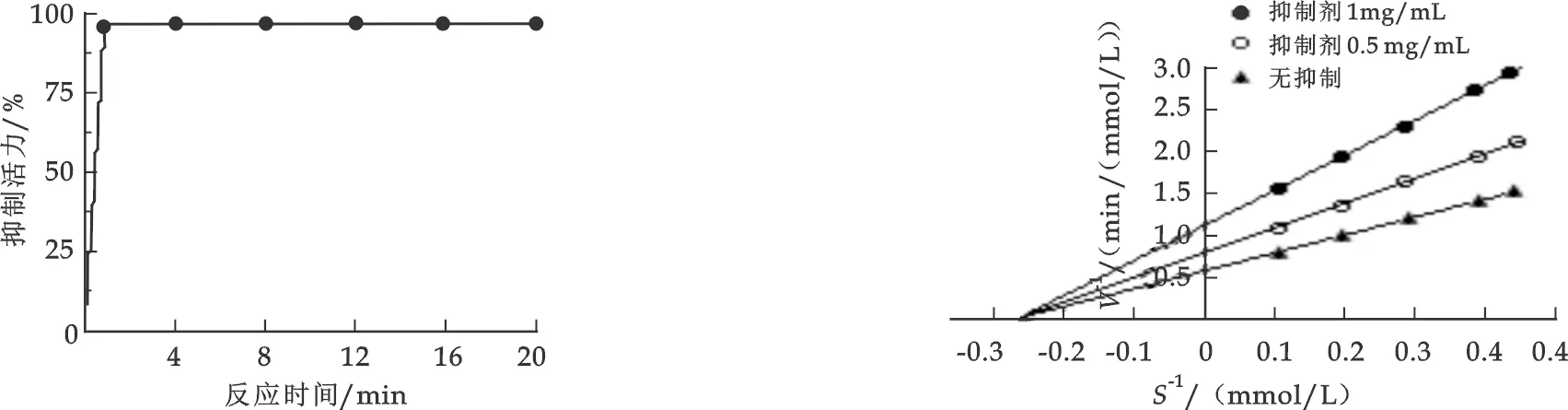
图5 反应时间对抑制效果的影响 图6 抑制剂的双倒数酶动力曲线
3.3 抑制剂对温度和pH的稳定性
在不同温度下处理HGI溶液,测定其抑制活性,发现在35~100 ℃水浴10 min后抑制活性基本上不随温度的改变而变化(见图2),表明HGI有很高的热稳定性.当HGI在pH 2.0~12.0范围内变动时,抑制活性也没有发生明显的改变(见图3),表明HGI的酸碱稳定性很好.
3.4 抑制剂的浓度对抑制效果的影响
由图4可见,加入抑制剂质量浓度为10 mg/mL时,抑制活力达到21.4%;加入60 mg/mL时,抑制活力为78%,表明HGI对α-葡萄糖苷酶有较强的抑制活性.
3.5 HGI与α-葡萄糖苷酶作用时间对抑制活性的影响
HGI对酶的抑制作用迅速,结果如图5所示,说明抑制剂作用1 min,即可抑制90%的酶活性,以后基本不变.由此可见,HGI对α-葡萄糖苷酶有很高的亲和性,是一种活性很强的抑制成分.
3.6 抑制剂的作用类型
按照Dixon的方法测定该抑制剂的抑制作用动力学曲线,以1/[S]为横坐标,1/V为纵坐标作双倒数曲线,如图6 所示,由此可推测此抑制成分的抑制类型为竞争性抑制.根据竞争性抑制动力学方程可求得α-葡萄糖苷酶Km=4.57×10-4mol/L,Ki=3.86×10-3mg/mL.
式中:V-反应速度;Vmax-最大反应速度;Km-米氏常数;I-抑制剂浓度;S-底物浓度;Ki-抑制剂常数.
4 结论
本实验结果表明,知母水提液的乙酸乙酯萃取部分相对于其它溶剂对α-葡萄糖苷酶具有较高的抑制活性,对其进一步酶抑制作用的研究结果表明,知母中α-葡萄糖苷酶抑制剂在35~100 ℃具有较高的稳定性,对酸碱稳定性很好,抑制活性随着抑制剂用量的增加显著增强,且抑制作用迅速,在1 min内抑制率就能达到最大值,抑制类型为竞争性抑制.
参考文献
[1] 王 翼,张 旭.α-葡萄糖苷酶抑制剂的研究进展[J].海峡药学,2009,21(9):4-6.
[2] 张捷平, 黄 玲, 施 红. 女贞子多糖对α-葡萄糖苷酶的抑制作用[J].福建中医学院学报, 2009 ,19(1):35-37.
[3] 刘瑞丽, 丁美萍, 徐 雯, 等.α-葡萄糖苷酶抑制剂研究进展[J].药物生物技术,2009,16(4):388-392.
[4] 杨 云, 冯卫生.中药化学成分提取分离手册[M].北京:中国中医药出版社,1998:192-195.
[5] 高小平,张蔚瑜, 邹文俊, 等.中药提取物中α葡萄糖苷酶抑制剂的筛选[J].天然产物研究与开发, 2003,15(6):536-538. .
[6] 杨胜远,刘玉燕, 梁智群.β-葡萄糖苷酶产生菌的分离筛选[J].工业微生物, 2002,32(4):36-38.
