非酒精性脂肪性肝炎大鼠肝脏血管内皮生长因子表达的意义
2010-02-16侯金佟
吴 静,郑 浩,江 瑛,苏 文,侯金佟,张 华
(1.首都医科大学宣武医院超声诊断科,北京 100053;2.首都医科大学病理生理学教研室,北京 100069)
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)是病理组织学改变与酒精性脂肪性肝炎相似,但无过量饮酒史的一种慢性疾病[1]。NASH作为隐源性肝硬化的重要病因,日益引起临床的重视[2、3]。但NASH的发病机制至今并不完全清楚,NASH严重的肝细胞脂变和气球样变常成为局部缺血和缺氧的原因,而局部缺血和缺氧又进一步加重NASH肝细胞损伤,表明肝脏血流动力学的异常可能成为NASH病变进展的重要因素之一。血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前已知作用最强的血管生成正性调节因子,具有促进内皮细胞增殖,增强多种血管生成因子的促血管生成效应,抑制内皮细胞凋亡,促使血管通透性增加的作用,局部缺血和缺氧是调节VEGF表达的主要因素之一[4,5]。因此VEGF可能与NASH的发病有关。本实验利用高脂饮食复制大鼠非酒精性脂肪肝损伤模型,通过高分辨率小动物显微超声成像系统检测门脉系统静脉内径等血流动力学指标,通过分子生物学方法检测肝脏VEGF mRNA和蛋白表达水平,旨在探讨NASH大鼠肝脏血流动力学的变化和VEGF在NASH的表达及其作用,为今后防治NASH提供实验依据。
1 材料和方法
1.1 动物模型建立及分组
清洁级SD雄性大鼠110~130g 20只,由首都医科大学动物中心提供,动物合格证号SCXK-(军)2007-004。随机分为对照组(10只,普通饲料喂养)和模型组(10只,高脂饲料即普通饲料基础上加10%猪油和2%胆固醇喂养),饲养于清洁级环境内16周。
1.2 超声检查
采用Visual Sonics Vevo 770型超高频小动物彩色多普勒超声诊断仪,探头频率20~40MHz,测量肝脏大小、回声强度、后方回声衰减、肝缘圆钝及肝内血管显示程度进行评分(1为正常,2为轻度改变,3为明显改变),取均值;测量门静脉、脾静脉和肝静脉内径及最大血流速度(V),选用门静脉长轴切面,取最大值作为门静脉内径(D);计算门静脉血流量应用公式:
Q(ml/min)=π×(D/2)2×V×60。
1.3 血生化指标检测
腹主动脉采血(隔夜禁食),肝素抗凝,常规制备血清。应用Olympus AU640全自动生化分析仪检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆固醇(TC)。
1.4 组织病理学检查
取肝脏组织行冷冻切片和石蜡切片,分别进行HE染色,油红O染色和Masson染色,观察肝脏脂肪变性、气球样变和纤维化等病理变化。
1.5 免疫组织化学染色
免疫组织化学SP法染色,按说明书(PV-6002二步法免疫组化检测试剂盒,北京中杉金桥生物技术有限公司)规范进行。切片脱蜡至水化,置3%过氧化氢,室温30min,微波修复抗原。滴加5%BSA封闭液,37℃,30min;滴加VEGF单克隆抗体(sc-7269,Santa Cruz公司)1∶100稀释液,4℃过夜;滴加辣根过氧化物酶标记的二抗(兔抗鼠IgG),37℃,10min;DAB避光显色,镜下控制显色时间;苏木精轻度复染。以PBS代替第一抗体作为阴性对照。
1.6 蛋白印记
称取100mg肝组织,加入裂解液匀浆,4℃,以12 000g,离心15min,取上清蛋白定量。取100μg蛋白上样进行SDS/PAGE电泳,经硝酸纤维素膜电转移,以5%脱脂奶粉封闭,然后加入一抗(VEGF1∶600或GAPDH1∶5 000)4℃过夜。以辣根过氧化物酶标记的二抗(1∶2 000)室温孵育,利用化学发光法显色,结果曝光于胶片上。应用ImageJ软件进行吸光度分析,以VEGF和GAPDH的比值表示各组蛋白表达水平。
1.7 实时定量RT-PCR
用Trizol提取肝脏组织总RNA,按Promega公司RT-PCR试剂盒说明书逆转录为cDNA。利用实时定量PCR仪(美国,ABI公司7300 System),按SYBR Green PCR Master Mix(美国ABI公司)试剂盒说明书,将大鼠肝脏cDNA同时行VEGF和18sRNA基因定量PCR。VEGF引物:正义链:5′-CGTCTACCAGCGCAGCTATTG-3′,反义链:5′-GCACACAGGACGGCTTGAA-3′,18 sRNA正义链:5′-GTAACCCGTTGAACCCCATT-3′,反义链:5′-CCATCCAATCGGTAGTAGCG-3′。反应扩增条件为0℃ 2min,95℃ 10min;95℃ 15s,60℃ 1min,共40个循环。将检测的临界点设定在PCR扩增过程中荧光信号由本底进入指数增长阶段的拐点所对应的循环数(Ct)作为模板初始浓度的间接指标,结果用18sRNA进行校正。Ct值越大,基因表达量就越小。用2—ΔΔCt法计算相对基因表达量。将所扩增的PCR产物同时进行溶解曲线分析和电泳以保证扩增产物的特异性。
1.8 数据的统计分析
2 结果
2.1 病理改变
肉眼观察对照组肝脏色泽红润,边缘锐利;模型组肝脏体积增大,边缘变钝,呈灰黄色,表面可见黄白色不规则斑块沉积。光镜下观察对照组肝小叶结构清晰;模型组肝细胞排列紊乱,呈大小泡混合性脂肪变性,伴肝细胞气球样变性、并可见大量炎性细胞浸润、碎片状坏死和少量纤维组织增生(图1,见彩插3)。
2.2 超声表现
正常对照组图像为肝实质回声均匀,肝内管系组织显示清晰;模型组肝脏增大,肝缘圆钝,实质回声细密增强,后方组织明显衰减,肝内管系组织显示不清。超声评分与病理评分结果一致[6]。门静脉内径增大,肝静脉内径减小,差异具有显著性(P<0.05)(图2)。门静脉流速和肝静脉流速均下降,但无统计学意义。
2.3 血生化指标
与对照组比较,模型组周大鼠ALT、AST增高、TC、TG增高,差异具有显著性(P<0.05)(表1)。
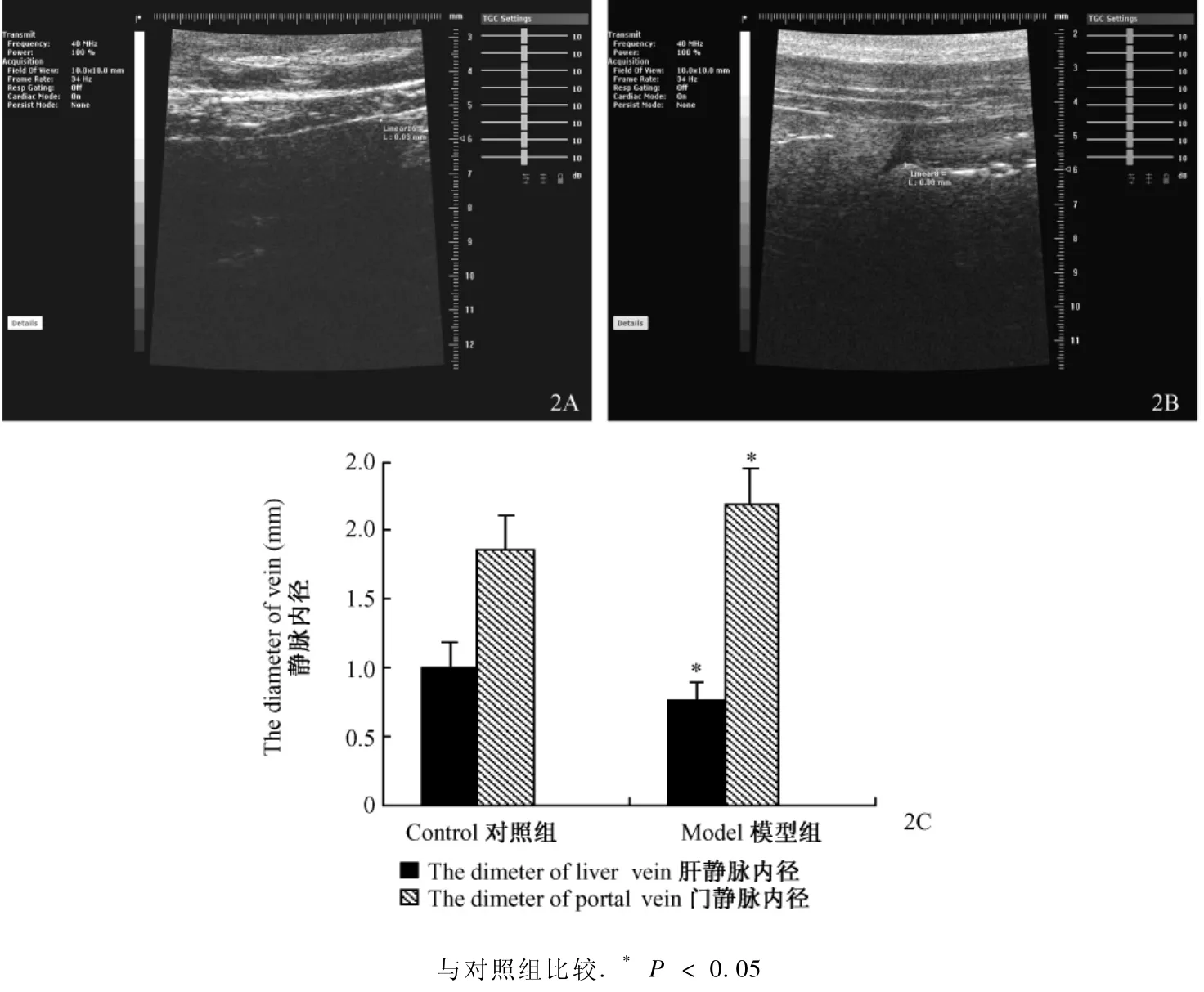
图2 大鼠肝脏超高频超声图像及血流动力学变化Fig.2 The high frequency ultrosound images of the liver and hemodynamic changes in the rats
表1 各组大鼠血生化指标Tab.1 The serum biochemical parameters in the rats(±s)
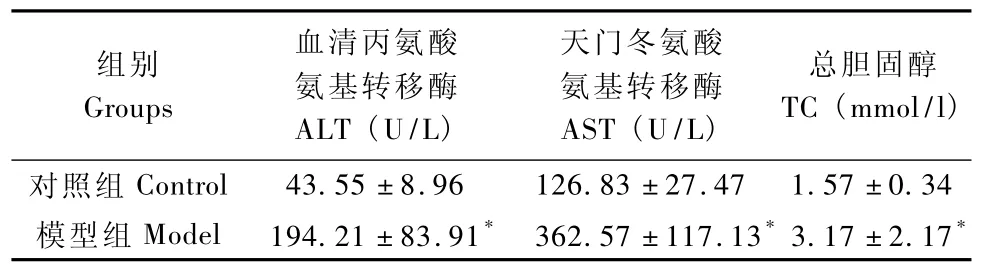
表1 各组大鼠血生化指标Tab.1 The serum biochemical parameters in the rats(±s)
与对照组比较,*P<0.05;*P<0.05,compared with the control group.
组别Groups血清丙氨酸氨基转移酶ALT(U/L)天门冬氨酸氨基转移酶AST(U/L)总胆固醇TC(mmol/l)对照组Control 43.55±8.96 126.83±27.47 1.57±0.34模型组Model 194.21±83.91* 362.57±117.13*3.17±2.17*
2.4 VEGF的表达
免疫组织化学染色结果表明,对照组大鼠肝组织VEGF蛋白表达量极低,仅在中央静脉周围个别肝细胞和窦内皮细胞表达VEGF。模型组肝组织VEGF蛋白表达明显增加,呈弥漫分布,阳性细胞主要为肝细胞和窦内皮细胞,轻度脂变的细胞比气球样变的细胞VEGF蛋白表达更为明显。而增生的炎性细胞和星形细胞则低表达甚至不表达VEGF蛋白。VEGF蛋白的Western blotting结果表明:对照组和模型组均有VEGF蛋白的表达,与对照组相比,模型组大鼠肝组织VEGF的表达增强,差异具有显著性(P<0.05)(图3,图3A、3B见彩插3)。
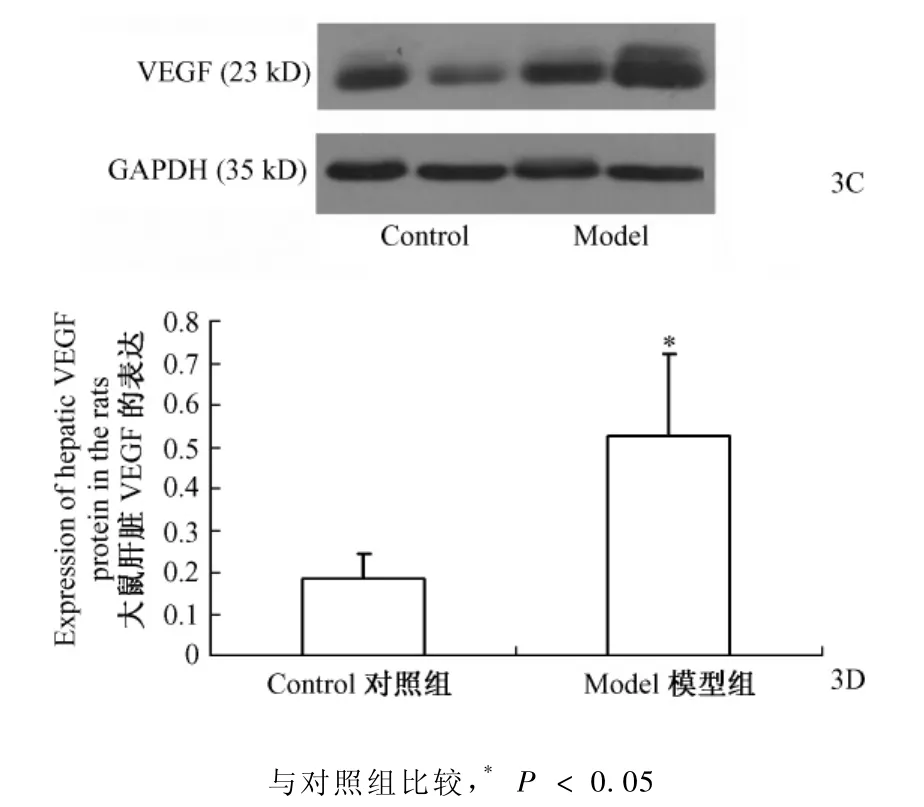
图3 各组大鼠肝脏VEGF蛋白的表达Fig.3 Expression of hepatic VEGF protein of each rat group
实时定量PCR结果表明,NASH大鼠肝脏VEGF mRNA表达水平明显增加。实时荧光定量RT-PCR反应曲线和溶解曲线结果表明,质控良好,扩增物为单一产物。模型组大鼠VEGF mRNA的水平大约是是对照组的3倍,差异具有显著性(P<0.05)(图4)。

图4 各组大鼠肝脏VEGF mRNA水平Fig.4 The levels of hepatic VEGF mRNA in the rat groups
3 讨论
本实验利用高脂复制大鼠NASH模型,与临床高脂饮食所致的NASH有相似的外因。实验结果表明:此时不仅出现高胆固醇血症,血清ALT及AST也显著增高。病理检查表现为肝细胞气球样变性和重度脂肪变性、伴炎性细胞浸润和肝细胞碎片状坏死及纤维组织增生。表明病程已进展为非酒精性脂肪性肝炎(NASH)。
血液流变异常和血流动力学的变化是脂肪肝病变发展的重要病因之一。研究证实肥胖、肝脏脂肪浸润可导致肝静脉血流频谱发生变化[7]。我们的研究结果也表明超高频多普勒超声可以较敏感地检测非酒精性脂肪性肝病大鼠不同时期门脉系统血流动力学变化[8]。本实验超声检查结果:表现为不仅肝脏增大,肝脏回声前方弥漫增强,后方组织严重衰减至显示不清,与脂肪肝的病理结果相一致,而且门静脉内径增大,肝静脉内径减小,静脉流速减低,表明NASH大鼠伴有肝脏血流动力学异常。此时一方面因脂代谢的异常导致血液黏度增加,影响肝脏的血流供应,引起肝组织缺血、缺氧和局部酸血症,导致肝实质内糖元减少,脂肪堆积[7]。另一方面NASH发生时,由于肝细胞脂变和气球样变引起的肝实质顺应性下降,而且随着肝细胞肿胀增大,压迫肝窦及肝内血管,血流阻力加大,影响肝脏充盈和血液循环,肝静脉顺应性的降低导致肝静脉狭窄,流速降低。远端阻力的加大,使门静脉血流速度减低,管径增宽。肝窦与肝细胞间的交换障碍最终导致肝脏功能损害。
VEGF在肝源性疾病的研究表明[9-12],在肝功能完全代偿或部分代偿时VEGF的表达增强,而肝功能失代偿时表达明显下降。急性肝炎,肝硬化和肝癌患者血清VEGF水平明显升高;在四氯化碳诱导的肝损伤大鼠和肝大部切除后的ob/ob小鼠肝脏VEGF水平明显增加,VEGF通过与受体结合刺激肝窦内皮细胞增殖和星状细胞活化,促进肝细胞再生及肿瘤的发生发展。但VEGF在非酒精性脂肪性肝炎的表达水平及其作用并不清楚。本实验结果表明,模型组肝组织VEGF蛋白表达明显增加,呈弥漫分布,阳性细胞主要是肝细胞,腺泡Ⅲ区的肝细胞和外周未完全空化的肝细胞VEGF蛋白表达更为明显。这可能与VEGF系缺氧诱导因子,而此区营养状态较门管区差,缺氧更为明显,细胞处于应激状态有关。而实时荧光定量PCR结果表明,NASH大鼠肝脏VEGF转录水平增加。此时肝细胞VEGF表达增加,可能是一种适应反应,通过诱导VEGF mRNA和蛋白质的表达,促使肝窦内皮细胞分裂、增加肝窦形成、诱导新生血管的形成,以改善肝细胞的供血供氧,最大限度地维持肝细胞功能,以迅速适应脂质底物的供给增加,减少血运障碍,降低细胞缺血缺氧程度,促使肝细胞再生,阻止病变进展,利于创伤修复。但由于VEGF诱导的新生血管的不成熟和其渗透作用,因此可能并不能完全纠正缺氧。而VEGF活性增加的同时也可致炎性渗出增多,星形细胞激活,可能增加纤维化的风险。因此对于VEGF在NASH发病机制中的作用尚需进一步研究,而这些更深入的研究将有助于今后更好的防治NASH。
[1]Jansen P L.Nonalcoholic steatohepatitis[J].Neth J Med,2004,62(7):217-224.
[2]Adams LA,Lymp JF,St Sauver J,et al.The natural history of nonalcoholic fatty liver disease:a population-based cohort study[J].Gastroenterology 2005,129:113-121.
[3]Caldwell SH,Crespo DM.The spectrum expanded:cryptogenic cirrhosis and the natural history of non-alcoholic fatty liver disease[J].J Hepatol,2004,40(4):578-584.
[4]Senger DR,Galli SJ,Dvorak AM,et al.Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid[J].Science 1983,219:983-985.
[5]Ho QT,Kuo CJ.Vascular endothelial growth factor:biology and therapeutic applications[J].Int J Biochem Cell Biol.2007,39(7-8):1349-1357
[6]吴静,郑浩,江瑛,等.大鼠非酒精性脂肪性肝病超声与病理变化的相关性研究[J].中国超声医学杂志,2008,24(8):688-691.
[7]丁声珍,张楚武.脂肪肝的声像图表现及其与糖及脂肪代谢的关系[J].中国超声医学杂志,1992,8(1):60-61.
[8]郑浩,江瑛,余豪,等.非酒精性脂肪性肝病门脉系统血流动力学变化的实验研究[J].中国医学影像技术,2008,24(6):855-857.
[9]Akiyoshi F,Sata M,Suzuki H,et al.Serum vascular endothelial growth factor levels in various liver diseases[J].Dig Dis Sci,1998,43:41-45.
[10]Rosmorduc O,Wendum D,Corpechot C,et al.Hepatocellular hypoxia-induced vascular endothelial growth factor expression and angiogenesis in experimental biliary cirrhosis[J].Am J Pathol,1999,155:1065-1073.
[11]Giatromanolaki A,Kotsiou S,Koukourakis MI,et al.Angiogenic factor expression in hepatic cirrhosis[J].Mediators Inflamm.2007,2007:1-4.
[12]Xu H,Shi BM,Lu XF,et al.Vascular endothelial growth factor attenuates hepatic sinusoidal capillarization in thioacetamideinduced cirrhotic rats[J].World J Gastroenterol 2008,14(15):2349-2357.
