mTOR信号通路及其与阿尔茨海默病的关系
2010-02-16汝文娟唐少君
汝文娟,唐少君,钟 翎
(1.中山大学药学院,广州 510006;2.Department of Neuroscience and Cell Biology,University of Texas Medical Branch,Galveston,TX 77555-1069,USA;3.广东医学院药学院,湛江 524023)
雷帕霉素(rapamycin,RAPA)是近年来开发的有效的抗癌新药。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是雷帕霉素在哺乳动物细胞内的靶分子,是一种进化上十分保守丝氨酸/苏氨酸蛋白激酶,属于磷脂酰肌醇激酶相关激酶(the phosphatidylinositol kinase-related kinase,PIKK)超家族。mTOR被认为是一个调节细胞周期进程和细胞生长的信号汇聚点(convergence),它能整合增殖和营养两种信号,调控细胞的生长和增殖。其主要通过调控代谢和有丝分裂来适应不同的环境条件,使细胞只在有利的条件下增殖。mTOR能调节细胞周期相关的蛋白质翻译包括cyclinD1、cmyc、STAT3等[1]。
mTOR信号的过度活化将引起以组织增生为特点的肿瘤等疾病。在非增殖性组织中,mTOR对于轴突的导向,树突的发育和树突棘的形态发生发挥着重要的作用[2-6],可调节突触可塑性,影响学习和记忆[7-10]。还发现在阿尔茨海默氏症(Alzheimer’s disease,AD)患者体内mTOR通路存在异常[11-14],提示mTOR信号的调控是神经系统疾病值得关注的重要因素,对于AD发病机理的阐明和AD靶点药物的研发具有重要意义。本文综述mTOR信号通路及其与AD关系的研究进展。
1 mTOR信号通路
1.1 mTOR及其复合体组成
mTOR是一种保守的丝/苏氨酸蛋白激酶,编码蛋白由2549个氨基酸组成,分子量为289kD。在细胞内mTOR存在两种功能不同的复合体mTORC1和mTORC2。mTORC1是雷帕霉素(rapamycin)敏感型,rapamycin能够特异性的抑制mTOR蛋白激酶的活性。mTORC1调控着许多细胞内的生理过程如:翻译、核糖体生物合成、凋亡、细胞周期,微管蛋白组装等。mTORC2复合体对雷帕霉素不敏感,主要参与了细胞极性和生长空间的调节,同时还调控着两个蛋白激酶Akt和PKCα的活化[1,15]。mTORC1和mTORC2两种复合体都含有mTOR和一个共同的调节亚基小的GβL蛋白(mLST8/GβL)以及识别底物的亚基(mTORC1中是raptor,mTORC2是rictor)。此外,已确定mTORC1还包括PRAS40;mTORC2包括SAPK-相关蛋白(SIN)和Protor[16-18]。对于构成mTOR复合物的各个组分的具体功能尚不完全清楚,但可以确定mTOR具有催化活性,能够磷酸化包括P70核糖体S6蛋白激酶(p70 ribosomal S6 protein kinase,p70S6K)、真核生物起始因子-4E结合蛋白(eIF-4E binding protein,4E-BP)在内的很多靶蛋白,且mTOR的催化活性需要其他mTOR复合体蛋白组分的参与。
1.2 mTOR上游的主要调控分子
Rheb是Ras家族中极为特殊的一员,属于Ras/Rap/Ral亚家族,是直接作用于mTOR的上游调节物,正调控mTOR通路。最初研究发现诱导癫痫后,Rheb mRNA在海马颗粒细胞中瞬时高度表达。同样Rheb在N-甲基-D-天冬氨酸受体(NMDA受体)依赖的长时程增强效应中也有所增加,说明Rheb参与了NMDA受体对细胞的调节[19]。目前证实在神经活动中与Rheb相关的基因有Rheb1和Rheb2。Rheb具有内源性GTP酶活性,是TSC2(tuberous sclerosis complex 2)的靶分子。在哺乳动物中,Rheb-GTP是其活性状态,其活性状态受TSC1/2的调节。最近的研究显示在果蝇S2细胞和HEK(human embryonic kidney cells)细胞中Rheb-GTP只能活化mTORC1,相反的,却能抑制mTORC2的活性[20]。
TSC 1(tuberous sclerosis complex 1)和TSC2(tuberous sclerosis complex 2)是两个肿瘤抑制基因。它们的基因产物分别是肿瘤抑制因子TSC1(又名hamartin)和TSC2(又名tubrin),通过负向调节mTOR信号转导通路而控制细胞的增长。TSC1、TSC2基因突变将导致错构瘤蛋白或结节蛋白的缺失或是功能障碍,引发细胞增殖和肿瘤的发生[21]。TSC2与TSC1形成的复合物可以对mTOR及其介导的下游信号发生作用。TSC2具有GTPase活化蛋白(GAP)催化亚基,在TSC1的参与下,TSC2可诱导Rheb-GTP向Rheb-GDP的方向转变,促使Rheb与GDP结合从而使mTOR失活[22]。此外,TSC2还存在很多的磷酸化位点,可以被多种激酶(包括Akt、ERK、RSK、AMPK和GSK3β等)磷酸化。这些不同的磷酸化位点对于TSC2的活性的影响并不完全一致[23]。例如:Akt(Ser939、Ser981、Thr1462)[22,23]、ERK(Ser664)[23]和RSK(Ser1798)[23]磷酸化TSC2后使得TSC1/2失活,mTOR活化。而AMPK(Ser1345)磷酸化TSC2后反而使其活化,mTOR失活,当胞内AMP含量较高即能量缺乏时,AMPK被活化,mTOR通路失活,可以说AMPK的活化相当于蛋白质合成代谢的一个关闭信号[23,24]。另外,Inoki等人在研究Wnt信号通路时发现,要完全抑制mTOR通路,需要AMPK、GSK3β同时磷酸化TSC2,且只有当TSC2被AMPK磷酸化后(Ser1345),GSK3β才能磷酸化TSC2(Ser1337、Ser1341)[25]。这些研究所揭示的TSC1/TSC2复杂的调控模式,正是mTOR通路能够整合多种环境和营养因素如生长因子、能量状态、环境压力、激素、氨基酸等的刺激并做出反应,进而调控细胞的生长与增殖的原因之一。
1.3 mTOR的下游效应器
真核细胞翻译启始因子4E结合蛋白(4E-BP)和p70核糖体S6蛋白激酶(p70S6K)是mTOR下游最具特色的两个效应器,形成了平行调节mRNA转译的两条信号通路。
4E-BP是eIF-4E的结合蛋白,也是eIF-4E的抑制因子,eIF-4E是真核生物翻译起始因子。低磷酸化的4E-BP与eIF-4E具有较高的亲和能力,而高度磷酸化后的4E-BP则可释放出eIF-4E。mTOR活化后能磷酸化4E-BP,当4E-BP被mTOR磷酸化后,降低了其与eIF-4E的亲和能力,使得eIF-4E可以与其它翻译起始因子组成多亚单位的复合物,启动mRNA的翻译。目前已知4E-BP高度同源的三种亚型,4E-BP1、4E-BP2、4E-BP3,它们都含有保守的mTOR磷酸化位点[26]。在体内,4B-BP1存在很多磷酸化位点。首先mTOR能使其在Thr37和Thr46发生磷酸化,Thr37和Thr46磷酸化后继而起始4EBP1在Ser65和Ser70发生磷酸化,这对于eIF-4E的释放是至关重要的[27-29]。
p70S6K是核糖体40S小亚基S6蛋白激酶,参与了细胞周期的调节,促进细胞从G1期细胞进入S期,是细胞生长和繁殖所必须的[30,31]。mTOR可使p70S6K的苏氨酸残基发生磷酸化,被磷酸化活化的p70S6K又能促进核糖体40S小亚基S6蛋白磷酸化,使40S小亚基参与活跃的核糖体翻译,对含5′末端寡聚嘧啶的mRNA的翻译起始具有上调作用[30,31]。p70S6K的活性与催化结构域、连接结构域和假底物结构域上多位点的磷酸化状态有关[30],其中催化结构域上Thr229和连接结构域上Thr389的磷酸化对于p70S6K功能的发挥是至关重要的[30]。在体内,mTOR活化后诱发p70S6K的Thr389发生磷酸化,这对于p70S6K的活化最为重要,磷酸化后的p70S6K将为PDK提供一个停泊位点,继而引发PDK磷酸p70S6K的Thr229[32,33]。位于假底物结构域的Ser411,Thr421和Ser424的磷酸化被认为是通过释放p70S6K上结合的假底物而激活p70S6K的[30,31]。除此之外,PP2A(protein phosphatase 2A),CLIP-170(cytoplasmic linker protein),eEF2K(eEF2 kinase),糖原合成酶等也是mTOR的效应蛋白。
1.4 mTOR信号通路的转导
经典的mTOR通路的活化起始于生长因子、营养因子(如脑源性神经营养因子:brain derived neurophic factor,BDNF)或胰岛素等信号对受体酪氨酸激酶(receptor tyrosine kinase,RTKs)的活化,RTK被活化后作用于Ras,且主要通过PI3K/Akt/mTOR或/和ERK/mTOR两条通路转导信号,这两条通路最终都通过调节mTOR的活性而影响蛋白质的表达水平(图1)。由此可见,所谓mTOR通路其实是PI3K和ERK通路的交汇通路。mTOR具有整合环境信号并调整细胞生长增殖功能,正是与其处于通路汇集点且有多层次调节方式和多位点调节靶点相对应。
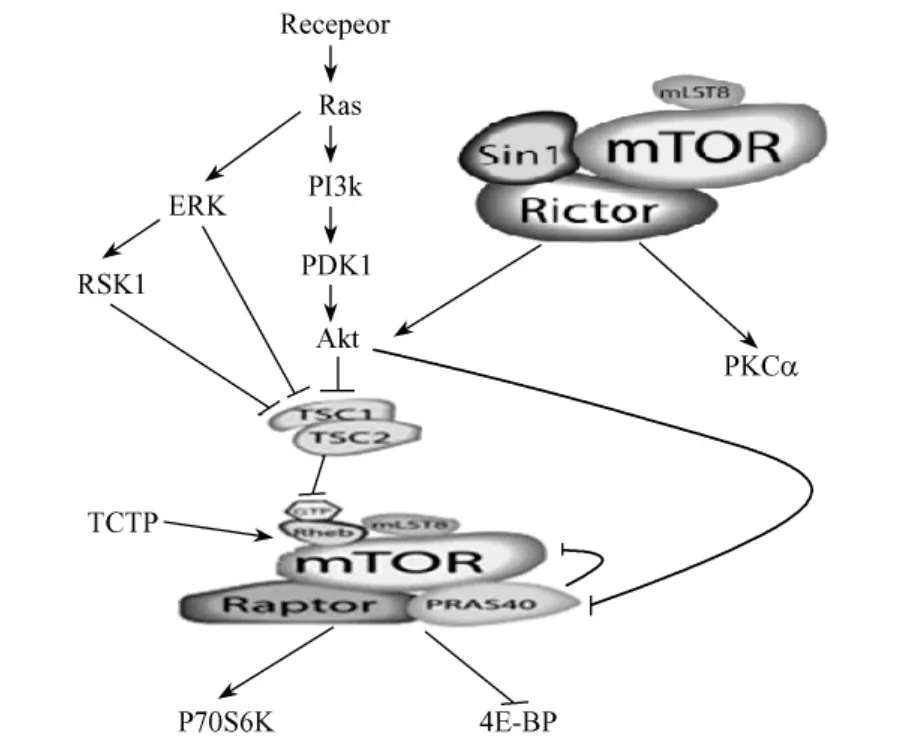
图1 mTOR通路活性的调控Fig.1 The regulation pathways of mTOR
在PI3K/Akt/mTOR通路中,Akt对于通路的活化起着关键的作用,Akt被磷酸化活化可以正调控mTOR通路,反过来mTOR通路的活化对Akt的活性具有负反馈抑制作用。Akt活化后直接作用TSC2,使其磷酸化失活,从而使细胞通过G1期。同时,由于mTOR-Rictor具有PDK2的活性,能够磷酸化Akt碳末端疏水区的丝氨酸残基,且这种磷酸化为Akt活性所必须。所以mTOR对Akt的负反馈调节则可能是Akt的激活引起mTOR-Raptor复合物的组装,两种mTOR复合物平衡被打破,mTOR-Rictor活性降低从而抑制Akt活性[34]。而在ERK/mTOR通路中,ERK(extracellular signal-regulated kinases)可直接或通过RSK(ribosomal S6 kinase)来磷酸化TSC2,使其活性受到抑制,从而活化mTOR通路[35,36]。另外Akt还能直接磷酸化PRAS40(proline-rich Akt substrate 40 kDa)来活化mTORC1,而不需要通过TSC1/2[37];TCTP(translationally controlled tumor protein)也可以直接作用于Rheb,从而使得mTOR通路的活化绕开了TSC1/2的调控[38]。
2 mTOR信号通路与阿尔茨海默病的关系
2.1 mTOR与学习、记忆及突触可塑性的关系
早期的研究主要集中在mTOR对细胞生长增殖以及对细胞周期的调控上,因此很容易的将mTOR与肿瘤、肥胖联系在一起。近年来发现mTOR对于神经系统的正常生理功能的发挥也是至关重要的。突触可塑性分为两种不同的类型:一种是长时程增强效应(long-term potentiation,LTP),另一种是长时程抑制效应(long-term depression,LDP)。不论是持续的高频刺激、BDNF等因素的刺激引发的LTP或是代谢型谷氨酸受体诱导的LTD都是依赖于蛋白质的合成,因此作为主要的翻译调控因子mTOR毫无疑问的参与了突触可塑性的调节[7,39,40]。与突触可塑性相关的分子通路对于学习和记忆的形成也是很重要,已有大量的证据显示mTOR可以通过不同的分子机制来影响学习和记忆的形成。目前的研究主要集中在:(1)对长期记忆的影响[8];(2)对恐惧记忆的影响[9,41];(3)对空间记忆的影响[10]。此外,与突触可塑性调节相关的蛋白如:CamKIIα、PSD95、离子型谷氨酸受体NMDA受体和AMPA受体的亚基作为mTOR通路的靶基因,mTOR通路的活化直接上调这些蛋白的表达进而调节突触的可塑性[42-44]。同时,除了对蛋白表达的影响外,营养因子和氨基酸所诱导的mTOR通路的活化还能抑制细胞的自吞作用来调控细胞内的蛋白水平[45,46]。
2.2 mTOR影响神经元的发育
神经元的发育直接影响神经系统功能的行使,mTOR通路是神经元发育的重要的调控路径,其作用主要包括以下几个方面:(1)轴突的形成和定向生长,mTOR通过影响蛋白质的合成和促进轴突定向生长来发挥其促生长和导向的作用[2,3];(2)树突的发生及分支,外界信号分子如BDNF、PI3K、Akt等可以通过刺激mTOR的活化促进树突的生长和分支扩张[4,5];(3)突触的形成和神经网络的建立,mTOR主要通过影响树突棘的数量及形态来调节突触的形成[5,6],树突棘是神经元树突上的功能性突起结构,通常作为突触后成分与投射来的轴突共同构成完整的突触连接。树突棘的形态与结构具有明显的可塑性,其变化通常会引起突触功能的改变。
2.3 mTOR与阿尔茨海默病
在神经系统中,mTOR的过度活化会导致脑肿瘤的发生。另外,很多证据都显示在一些神经退行性疾病如艾尔茨海默病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)、亨廷顿舞蹈症(Huntington’s disease,HD)等中mTOR信号通路都存在异常。这些疾病都存在一个共同的特征:大脑中一定区域存在大量的神经元丢失,这可能都与mTOR通络的异常有关。AD是一种主要在老年期发生的以进行性痴呆为主要特征的神经退行性疾病。AD最典型的病理特征为:神经元外的β-淀粉样蛋白(β-amyloid protein,Aβ)聚集形成老年斑(senile plaques,SP)、神经元内高度磷酸化的Tau蛋白形成神经纤维缠结(neurofibrillary tangles,NFTs)和神经元的丢失,临床上表现为学习与记忆功能的改变。
已有大量研究证明AD患者体内mTOR通路存在异常,目前主要集中在mTOR对蛋白质合成和细胞周期再进入的调控上[47]。一方面,在AD患者体内存在着mTOR通路的下调,这可能是与Aβ的细胞毒性有关,成为AD发展中导致神经元丢失和细胞凋亡的内在机制。Paccalin等发现p70S6K除参了与蛋白质的合成,在分子水平上也影响着突触可塑性和记忆的形成。在AD患者的淋巴细胞中p70S6K的磷酸化水平明显降低,这与AD患者认知障碍和外显记忆形成障碍密切相关[48,49]。Chebassier等(2005)也进一步证实了AD与mTOR的下调有关,将小鼠神经瘤母细胞暴露于Aβ1-42中导致急速而持续的mTOR/p70S6K通路的下调并伴随着caspase 3的活化[11]。同样,在APP-PS1(淀粉样前体蛋白-早老素)双转基因小鼠大脑皮层细胞和AD患者的淋巴细胞中,也存在mTOR/p70S6K通路的下调,且p70S6K的磷酸化水平与细微精神状态检查(MMSE)的得分相关[11]。其可能的分子机制是PS1通过促进钙粘连蛋白和PI3K的结合从而激活PI3K/Akt信号通路,同时PS1能抑制Gsk-3的活性并减少Tau蛋白的过度磷酸化,而家族性AD突变的PS1不具备上述功能[50]。
另一方面,也有研究报道,AD的发生伴随着mTOR/p70S6K通路的活性的增强,使得AD的整个病理过程中伴随着某些蛋白表达水平的增加,如具有神经毒性的Tau蛋白[12-14]。有趣的是,An等发现用高浓度的Zn2+处理神经母瘤细胞(SH-SY5Y)或者海马神经元后发现p70S6K被磷酸化活化,从而导致胞内Tau的表达和磷酸化水平都有所增加;用mTOR特异性抑制剂rapamycin预处理细胞将削弱Zn2+的作用,也就是说mTOR的活化早于Tau的累积[12]。与此相反的是,Khurana等在Tau所诱发的果蝇AD模型中却发现高度磷酸化的Tau蛋白能导致mTOR通路的异常活化,从而激活细胞周期并最终引发细胞的死亡,即高度磷酸的Tau蛋白是mTOR活化的一个诱因[13]。
由于AD的发病机制是非常复杂的,因此mTOR通路出现两种不同的改变情况(上调/下调)也不足为奇,这可能与实验所涉及AD疾病模型及所选用的组织不同有关。目前,mTOR的抑制剂有可能成为治疗神经退行性疾病的有效药物,mTOR通路的下调可以减少一些具有神经毒性作用的蛋白(如:tau蛋白)合成。
3 展望
通过10多年的研究,已对mTOR通路的组成、功能有了基本的了解,在其与疾病发生及治疗的关系上也有了初步的认识,但下述问题依然困扰着我们:(1)mTOR与其它通路的关系;(2)具体哪些蛋白质的翻译受mTOR通路调节,这些蛋白的具体作用又是什么;(3)mTOR除了影响蛋白质的翻译外,作为激酶是否还有其他生理功能;(4)mTOR是如何整合众多信号以及这些信号分子彼此的联系、优先等级及与疾病的相关性等。相信上述问题的阐明对于进一步挖掘mTOR这一信号汇集点在靶分子药物开发上的作用,及疾病发病机理的探讨既是十分必要的,也是具有重要的实用的价值。
[1]Schmelzle T,Hall MN.TOR,a central controller of cell growth[J].Cell,2000,103(2):253-262.
[2]Campbell DS,Holt CE.Chemotropic responses of retinal growth cones mediated by rapid local protein synthesis and degradation[J].Neuron,2001,32(6):1013-1026.
[3]Choi YJ,Di Nardo A,Kramvis I,et al.Tuberous sclerosis complex proteins control axon formation[J].Genes Dev,2008,22(18):2485-2495.
[4]Jaworski J,Spangler S,Seeburg D P,et al.Control of dendritic arborization by the phosphoinositide-3′-kinase-Akt-mammalian target of rapamycin pathway[J].J Neurosci,2005,25(49):11300-11312.
[5]Kumar V,Zhang MX,Swank MW,et al.Regulation of dendritic morphogenesis by Ras-PI3K-Akt-mTOR and Ras-MAPK signaling pathways[J].J Neurosci,2005,25(49):11288-11299.
[6]Tavazoie SF,Alvarez VA,Ridenour DA,et al.Regulation of neuronal morphology and function by the tumor suppressors Tsc1 and Tsc2[J].Nat Neurosci,2005,8(12):1727-1734.
[7]Tang SJ,ReisG,KangH,etal.A rapamycin-sensitive signaling pathway contributes to long-term synaptic plasticity in the hippocampus[J].Proc Natl Acad Sci U S A,2002,99(1):467-472.
[8]Tischmeyer W,Schicknick H,Kraus M,et al.Rapamycinsensitive signalling in long-term consolidation of auditory cortexdependent memory[J].Eur J Neurosci,2003,18(4):942-950.
[9]Parsons RG,Gafford GM,Helmstetter FJ.Translational control via the mammalian target of rapamycin pathway is critical for the formation and stability of long-term fear memory in amygdala neurons[J].J Neurosci,2006,26(50):12977-12983.
[10]Dash PK,Orsi SA,Moore AN.Spatial memory formation and memory-enhancing effect of glucose involves activation of the tuberous sclerosis complex-Mammalian target of rapamycin pathway[J].J Neurosci,2006,26(31):8048-8056.
[11]Lafay-Chebassier C,Paccalin M,Page G,et al.mTOR/p70S6k signalling alteration by Abeta exposure as well as in APP-PS1 transgenic models and in patients with Alzheimer’s disease[J].J Neurochem,2005,94(1):215-225.
[12]AnWL,Cowburn RF,LiL,etal.Up-regulation of phosphorylated/activated p70 S6 kinase and its relationship to neurofibrillary pathology in Alzheimer’s disease[J].Am J Pathol,2003,163(2):591-607.
[13]Li X,Alafuzoff I,Soininen H,et al.Levels of mTOR and its downstream targets4E-BP1,eEF2,and eEF2 kinase in relationships with tau in Alzheimer’s disease brain[J].FEBS J,2005,272(16):4211-4220.
[14]Khurana V,Lu Y,Steinhilb ML,et al.TOR-mediated cell-cycle activation causes neurodegeneration in a Drosophila tauopathy model[J].Curr Biol,2006,16(3):230-241.
[15]Harris TE,Jr Lawrence JC.TOR signaling[J].Sci STKE,2003,2003(212):e15.
[16]Sarbassov DD,Ali SM,Kim DH,et al.Rictor,a novel binding partner of mTOR,defines a rapamycin-insensitive and raptorindependent pathway that regulates the cytoskeleton[J].Curr Biol,2004,14(14):1296-1302.
[17]Frias MA,Thoreen CC,Jaffe JD,et al.mSin1 is necessary for Akt/PKB phosphorylation,and its isoforms define three distinct mTORC2s[J].Curr Biol,2006,16(18):1865-1870.
[18]Pearce LR,Huang X,Boudeau J,et al.Identification of Protor as a novel Rictor-binding component of mTOR complex-2[J].Biochem J,2007,405(3):513-522.
[19]董理,杜晓霞,肖波.Rheb基因研究进展[J].中国神经免疫学和神经病学杂志,2008,15(06):463-466.
[20]Kwiatkowski DJ.Tuberous sclerosis:from tubers to mTOR[J].Ann Hum Genet,2003,67(Pt 1):87-96.
[21]Manning BD,Cantley LC.Rheb fills a GAP between TSC and TOR[J].Trends Biochem Sci,2003,28(11):573-576.
[22]Garami A,Zwartkruis FJ,Nobukuni T,et al.Insulin activation ofRheb,a mediatorofmTOR/S6K/4E-BP signaling,is inhibited by TSC1 and 2[J].Mol Cell,2003,11(6):1457-1466.
[23]Choo AY,Roux PP,Blenis J.Mind the GAP:Wnt steps onto the mTORC1 train[J].Cell,2006,126(5):834-836.
[24]Inoki K,Zhu T,Guan KL.TSC2 mediates cellular energy response to control cell growth and survival[J].Cell,2003,115(5):577-590.
[25]Inoki K,Ouyang H,Zhu T,et al.TSC2 integrates Wnt and energy signals via a coordinated phosphorylation by AMPK and GSK3 to regulate cell growth[J].Cell,2006,126(5):955-968.
[26]Hay N,Sonenberg N.Upstream and downstream of mTOR[J].Genes Dev,2004,18(16):1926-1945.
[27]Fadden P,Haystead TA,Jr Lawrence JC.Identification of phosphorylation sites in the translational regulator,PHAS-I,that are controlled by insulin and rapamycin in rat adipocytes[J].J Biol Chem,1997,272(15):10240-10247.
[28]Gingras AC,Gygi SP,Raught B,et al.Regulation of 4E-BP1 phosphorylation:a novel two-step mechanism[J].Genes Dev,1999,13(11):1422-1437.
[29]Proud CG.Regulation of mammalian translation factorsby nutrients[J].Eur J Biochem,2002,269(22):5338-5349.
[30]Pullen N,Thomas G.The modular phosphorylation and activation of p70s6k[J].FEBS Lett,1997,410(1):78-82.
[31]Dufner A,Thomas G.Ribosomal S6 kinase signaling and the control of translation[J].Exp Cell Res,1999,253(1):100-109.
[32]Pullen N,Dennis PB,Andjelkovic M,et al.Phosphorylation and activation of p70s6k by PDK1[J].Science,1998,279(5351):707-710.
[33]Alessi DR,Kozlowski MT,Weng QP,et al.3-Phosphoinositidedependent protein kinase 1(PDK1)phosphorylates and activates the p70 S6 kinase in vivo and in vitro[J].Curr Biol,1998,8(2):69-81.
[34]Sarbassov DD,Guertin DA,Ali SM,et al.Phosphorylation and regulationofAkt/PKB by therictor-mTOR complex[J].Science,2005,307(5712):1098-1101.
[35]Ma L,Chen Z,Erdjument-Bromage H,et al.Phosphorylation and functional inactivation of TSC2 by Erk implications for tuberous sclerosis and cancer pathogenesis[J].Cell,2005,121(2):179-193.
[36]Roux PP,Ballif BA,Anjum R,et al.Tumor-promoting phorbol esters and activated Ras inactivate the tuberous sclerosis tumor suppressor complex via p90 ribosomal S6 kinase[J].Proc Natl Acad Sci U S A,2004,101(37):13489-13494.
[37]Vander HE,Lee SI,Bandhakavi S,et al.Insulin signalling to mTOR mediated by the Akt/PKB substrate PRAS40[J].Nat Cell Biol,2007,9(3):316-323.
[38]Hsu YC,Chern JJ,Cai Y,et al.Drosophila TCTP is essential for growth and proliferation through regulation of dRheb GTPase[J].Nature,2007,445(7129):785-788.
[39]Hou L,Klann E.Activation of the phosphoinositide 3-kinase-Akt-mammalian target of rapamycin signaling pathway is required for metabotropic glutamate receptor-dependent long-term depression[J].J Neurosci,2004,24(28):6352-6361.
[40]Cracco JB,Serrano P,Moskowitz SI,et al.Protein synthesisdependent LTP in isolated dendrites of CA1 pyramidal cells[J].Hippocampus,2005,15(5):551-556.
[41]Bekinschtein P,Katche C,Slipczuk LN,et al.mTOR signaling in the hippocampus is necessary for memory formation[J].Neurobiol Learn Mem,2007,87(2):303-307.
[42]Takei N,InamuraN,KawamuraM,etal.Brain-derived neurotrophic factorinducesmammalian targetofrapamycindependent local activation of translation machinery and protein synthesis in neuronal dendrites[J].J Neurosci,2004,24(44):9760-9769.
[43]Gong R,Park CS,Abbassi NR,et al.Roles of glutamate receptors and the mammalian target of rapamycin(mTOR)signaling pathway in activity-dependent dendritic protein synthesis in hippocampal neurons[J].J Biol Chem,2006,281(27):18802-18815.
[44]LeeCC,HuangCC,WuMY,etal.Insulinstimulates postsynaptic density-95 protein translation via the phosphoinositide 3-kinase-Akt-mammalian target of rapamycin signaling pathway[J].J Biol Chem,2005,280(18):18543-18550.
[45]Meijer AJ,Codogno P.Signalling and autophagy regulation in health,aging and disease[J].Mol Aspects Med,2006,27(5-6):411-425.
[46]Rubinsztein DC,Gestwicki JE,Murphy LO,et al.Potential therapeutic applications of autophagy[J].Nat Rev Drug Discov,2007,6(4):304-312.
[47]Swiech L,Perycz M,Malik A,et al.Role of mTOR in physiology and pathology of the nervous system[J].Biochim Biophys Acta,2008,1784(1):116-132.
[48]Baki L,Shioi J,Wen P,et al.PS1 activates PI3K thus inhibiting GSK-3 activity and tau overphosphorylation:effects of FAD mutations[J].EMBO J,2004,23(13):2586-2596.
[49]Paccalin M,Pain-Barc S,Pluchon C,et al.The relation between p70S6k expression in lymphocytes and the decline of cognitive test scores in patients with Alzheimer disease[J].Arch Intern Med,2005,165(20):2428-2429.
[50]Paccalin M,Al KF,Barc SP,et al.Peripheral p70S6k levels and emotional memory in patients with Alzheimer’s disease[J].Neurosci Lett,2006,410(3):162-164.
